子宫动脉栓塞治疗弥漫型子宫腺肌症的中、远期随访分析
2013-08-21姚群立陆建东徐向荣柳玉华郑宇平郁金芬
姚群立,陆建东,徐向荣,柳玉华,郑宇平,温 玲,郁金芬
子宫腺肌症是子宫内膜腺体及其基质异位于子宫肌层内,一般表现为女性下腹疼痛合并月经量过多,子宫体积增大,腺肌症可以分为弥漫型或局限型(腺肌瘤)。相对于子宫切除,子宫动脉栓塞治疗腺肌症的症状控制率为65%~85%[1-3]。但手术切除子宫对患者创伤及心理影响比较大。我院自2007年起对子宫腺肌症患者进行子宫动脉栓塞治疗,取得较好的临床疗效,现对其中随访超过3年资料完整的19例弥漫型腺肌症患者的随访结果进行分析。
1 材料与方法
1.1 临床资料
19例弥漫型子宫腺肌症患者年龄31~42岁,平均(37.4±3.2)岁;痛经史 2~12年,平均(6.2±3.7)年;月经量明显增多2~5年,平均(3.3±0.8)年;均已婚,有生育史。19例中术前轻度贫血7例,中度9例,重度3例,血红蛋白平均值为(84.27±16.69)g/L。4例合并子宫肌瘤;术前均经MRI检查及诊断性刮宫,明确诊断并排除恶性肿瘤。19例患者无介入手术禁忌证,如妇科急、慢性炎症未得到有效控制,存在严重心、肝、肾等重要脏器疾病,凝血机制明显异常,穿刺部位皮肤感染等情况。
1.2 治疗方法
应用Seldinger技术经右侧股动脉穿刺插管,将5 F子宫动脉导管超选择插入左侧子宫动脉,以聚乙烯醇颗粒(PVA)或栓塞微球(350~500 μm 和500~700 μm)对比剂混合液,透视下注入靶动脉,直至子宫动脉血管轻微铸型为止,加以明胶海绵颗粒栓塞,复查造影见异常染色及迂曲的子宫动脉远端消失为栓塞成功,然后用同样的方法栓塞对侧子宫动脉,造影复查满意后拔出导管,压迫止血,结束手术。栓塞后常规抗炎、止痛3~5 d。
1.3 随访
于术后 6、12、18、24、36 个月时复查患者痛经症状,MRI检查子宫形态、大小及病灶变化情况。痛经釆用数字疼痛程度分级法(NRS)由患者按照评分表自行评分;复查MRI时分别进行轴位、矢状位、冠状位扫描,扫描序列为T1WI、T2WI。计算子宫体积公式为:4/3π×1/8 abc,abc分别为子宫左右径、矢状径及上下径的最大值。于术后3、6、12个月随访复查血红蛋白值,观察贫血改善情况。
1.4 统计方法
采用SPSS17.0软件进行统计学分析。对血红蛋白值、子宫体积值、痛经程度评分采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 月经症状
19例患者治疗后月经量均明显减少,月经周期有所延长。1例患者3个月后出现停经,雌激素、孕激素、黄体生成素、卵泡刺激素水平提示卵巢功能正常,宫腔镜检查提示子宫内膜轻度萎缩,经治疗7个月后月经恢复,但量较少。治疗后患者贫血症状均得到明显改善,术后3个月血红蛋白值平均达(115.17±14.36)g/L,基本恢复正常,与术前血红蛋白平均值[(84.27±16.69)g/L]相比,差异有统计学意义(P < 0.001)。
2.2 痛经症状
采用NRS分级法对患者痛经情况进行评估,疼痛程度最高记为10分。19例患者在术后3个月内痛经症状均明显缓解,其中12例术后6个月痛经消失,2例术后9个月痛经完全消失。7例24个月后出现痛经逐渐加重,但较术前疼痛为轻,NRS平均评分变化见图1。分别对19例患者术前及术后6、12、18、24、36 个月的疼痛评分进行统计学分析,与术前相比,治疗后痛经程度较术前明显减轻,差异均有统计学意义(P值均<0.001)。
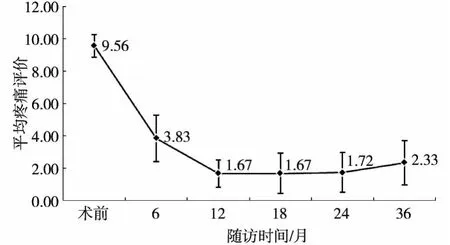
图1 19例患者痛经程度平均评分趋势图
2.3 子宫、病灶体积
治疗后MRI复查显示子宫及病灶体积进行性缩小,术后6个月子宫体积平均缩小32%,12个月后子宫体积缩小48%,7例患者24个月后临床症状有复发现象,MRI检查显示缩小的子宫体积及原有病灶变化不明显,但其中4例患者有新发小病灶,子宫体积百分率变化见图2。患者MRI随访结果见图3。
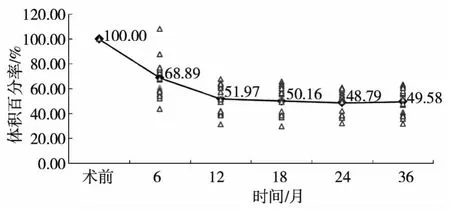
图2 19例患者子宫体积平均百分率变化趋势图
2.4 不良反应和并发症
患者术中、术后常见的不良反应主要是疼痛,为有效地减轻疼痛,术中常规肌注哌替啶75 mg,术后给予吲哚美辛、地塞米松、多瑞吉皮肤缓释贴剂等药物对症处理,疼痛得到较好控制。13例发生以恶心、呕吐和发热为表现的栓塞后综合征,体温在37.5℃~38.0℃波动,未作特殊处理均自然消退,呕吐严重者用甲氧氯普胺或格拉司琼进行镇吐等对症处理。所有患者术后恢复好,未见严重并发症。1例患者26个月时怀孕。

图3 患者术前、术后12、24、36个月的MRI随访结果
3 讨论
子宫腺肌症的病理基础为子宫内膜腺体与基质异位于子宫肌层内。一般认为,多次妊娠、分娩时子宫壁的创伤和慢性子宫内膜炎可能是导致此病的主要原因;也有认为子宫内膜侵入肌层可能与雌激素水平增高有关。腺肌症的临床症状主要表现为育龄妇女月经期间下腹疼痛、经期时间延长、不孕、异常子宫出血和贫血等。弥漫型子宫腺肌症患者月经量增多可能与子宫内膜面积增加有关,腺肌症患者内膜内微血管数量及微血管总截面积是正常人的 10 倍[1,4]。
子宫腺肌症的临床症状没有特异性,与子宫肌瘤症状相似,因此两者的鉴别非常重要,这决定患者治疗方案的选择。子宫动脉栓塞术治疗子宫肌瘤临床疗效明确,治疗成功率为80%~90%[5-6],患者临床症状明显改善。而对于腺肌症,激素治疗效果较差,子宫内膜切除术有较高的失败率,尤其是子宫肌层深部的弥漫型腺肌症。子宫切除术是根治手段,但对患者的心理不良影响和躯体创伤较大。子宫动脉栓塞治疗腺肌症的近期临床疗效明确[2,7-8],但对远期疗效有争议。Kim等[8]报道随访54例患者3年,依据临床症状复发结果认为子宫动脉栓塞治疗失败率为42.6%。本组资料显示,患者临床症状24个月内缓解明显,痛经程度明显减轻,经量较前明显减少,患者贫血症状得到改善,甚至消除,36.84%(7/19)患者24个月后临床症状有复发趋势。
子宫动脉栓塞治疗子宫肌瘤的机制已通过病理检查结果得到论证,栓塞后肌瘤经过缺血梗死、组织变性、坏死、吸收,病灶变小甚至消失,临床长期疗效明确。但腺肌症的血供和肌瘤不同,没有明显增粗的血管,尤其是弥漫型子宫腺肌症的病理特点不能以这样的理论诠释,更可能的是PVA颗粒直接栓塞腺肌症病灶处血流缓慢的微循环血管,进一步引发机体反应形成微血栓[9],肌层内异位的内膜组织得不到血液供应而萎缩,最终可以使子宫体积及宫腔内膜面积缩小,改善患者的临床症状;而侧支循环和栓塞血管的再通也可能是腺肌症小病灶继续存活或甚至复发的病理基础。因此,肌腺症比肌瘤需要更强的栓塞治疗,包括使用小直径微粒、彻底阻塞血管、明胶海绵的再次栓塞等。本组病例在栓塞过程中使用直径 350~500 μm和500~700 μm的两种PVA颗粒,先小后大,然后以明胶海绵颗粒栓塞较大血管以减缓血流速度,促进微血栓形成。
文献报道对单纯腺肌症或腺肌症合并肌瘤的患者行子宫动脉栓塞可在腺肌症内部产生无血管区,使子宫体积缩小,术后3个月绝大多数患者临床症状得到改善[8,10-11]。也有极少患者因卵巢血管网受累而出现卵巢功能减退,出现闭经[11]。随访过程中,本组患者术后前3个月内会出现月经紊乱,如周期延长等,但其痛经程度明显减轻,经量减少,患者贫血程度在3个月后得到缓解,6个月以后经期及月经量趋于稳定,未出现明显的卵巢功能减退征象。这些变化可能与术后前几个月肌层内病灶缺血坏死及内膜基底层的修复过程有关。
盆腔MR检查有助于子宫腺肌症的术前明确诊断,可观察子宫大小、异位内膜位置、病灶大小范围,明确腺肌症的分型、有无盆腔内的异位病灶及其他疾病,从而选择恰当的治疗方案并评估预后。也有研究指出由于肌瘤和腺肌症在临床和影像上不易区分,且腺肌症病灶比肌瘤更能耐受血管阻塞引起的缺血,导致腺肌症患者子宫动脉栓塞术后中期疗效欠佳。而近年来,单纯腺肌症患者行子宫动脉栓塞后MRI随访,术后3个月和1年子宫体积平均缩小26.3%和27.4%[8],说明子宫动脉栓塞术是治疗子宫腺肌症的有效方法。本组资料显示,术前MRI检查有助于肌瘤和腺肌症的鉴别,尤其是确诊弥漫型子宫腺肌症。同时,在随访过程中能够观察到弥漫型腺肌症的转归,如病灶吸收或(和)转成局限型腺肌症、子宫体积的缩小等。随访中发现,术后24个月,子宫体积缩小48.79%,7例患者24个月以后痛经逐渐加重,但总体程度仍较术前为轻,复查MRI显示子宫体积及原病灶区域变化不明显,但其中4例出现新的小病灶。这提示以前栓塞治疗前和(或)随访复查中未行MRI检查,栓塞治疗后仅凭临床症状反复便认为治疗失败的部分病例可能与新发病灶有一定关系。
综上所述,子宫动脉栓塞治疗子宫腺肌症,尤其是除子宫全切除外无法进行手术治疗的弥漫型子宫腺肌症,可以在缓解痛经、减少月经量、改善贫血方面取得良好的临床疗效。MRI对于腺肌症介入治疗前后的评估和随访非常重要,能及时发现新发小病灶。
[1]Bratby MJ,WalkerWJ.Uterine artery embolisation for symptomatic adenomyosis-mid-term results [J].Eur J Radiol,2009,70:128-132.
[2]Popovic M,Puchner S,Berzaczy D,et al.Uterine artery embolization for the treatment of adenomyosis: a review [J].J Vasc Interv Radiol,2011,22: 901-909.
[3]Liang E,Brown B,Kirsop R,et al.Efficacy of uterine artery embolisation for treatment of symptomatic fibroids and adenomyosis-an interim report on an Australian experience[J].Aust N Z J Obstet Gynaecol,2012,52: 106-112.
[4]Ota H,Igarashi S,Tanaka T.Morphometric evaluation of stromal vascularization in the endometrium in adenomyosis [J].Hum Reprod,1998,13:715-719.
[5]赵振华,王 挺,卢增新,等.子宫动脉栓塞治疗单发和多发子宫肌瘤远期疗效对比分析[J].介入放射学杂志,2013,22:557-561.
[6]韩 冰,Xiang Y.子宫动脉栓塞治疗子宫肌瘤和肌腺症的临床研究进展[J].生殖医学杂志,2008,17: 310-313.
[7]Smeets AJ,Nijenhuis RJ,Boekkooi PF,et al.Long-term followup of uterine artery embolization for symptomatic adenomyosis[J].Cardiovasc Intervent Radiol,2012,35: 815-819.
[8]Kim MD,Kim S,Kim NK,et al.Long-term results of uterine artery embolization for symptomatic adenomyosis [J].Am J Roentgenol,2007,188: 176-181.
[9]Dundr P,Mára M,Masková J,et al.Pathological findings of uterine leiomyomas and adenomyosis following uterine artery embolization[J].Pathol Res Pract,2006,202: 721-729.
[10]Kitamura Y,Allison SJ,Jha RC,et al.MRI of adenomyosis:changes with uterine artery embolization [J].Am J Roentgenol,2006,186:855-864.
[11]张宇慧,周顺科.子宫肌瘤介入治疗近展 [J].介入放射学杂志,2013,22:340-345.
