种植合金CPTi和Ti-6Al-4V对内皮细胞增殖的影响及在细胞培养液中腐蚀情况分析
2013-08-21李晶史玲玲艾红军徐坚孙伟钟鸣
李晶,史玲玲,艾红军,徐坚,孙伟,钟鸣
(1.辽宁省口腔医学研究所,中国医科大学附属口腔医学院修复科,沈阳 110002;2.中国科学院沈阳金属研究所非晶合金组,沈阳110016;3.中国医科大学附属口腔医学院中心实验室,沈阳 110002)
目前CPTi和Ti-6Al-4V是临床上应用最广泛的牙科种植体材料,CPTi属于惰性金属,在体液中的耐腐蚀性高,长期使用后会在种植体周围有钛(Ti)离子析出,但是对人体无致敏性[1];不会引起局部或者全身反应[2],因而CPTi已经被视为齿科种植体的金标准材料。但是钛合金却是临床上应用最多的齿科植入合金,因为Ti-6Al-4V比CPTi具有更好的机械性能。国内外学者对这两种材料的生物相容性的评价存在很大分歧.一部分学者认为这两种材料植入体内后并无差异,如Espoeito等[3]在分析了多例失败种植体的表面形态、成分和氧化物厚度后发现,无论是早期还是晚期失败的种植体,其种植后表面氧化物的成分和厚度均未发生明显的变化,也未发现引起种植体失败与材料有关的因素;另一部分则认为CPTi要明显优于Ti-6Al-4V,在钛合金的组成元素中,Steinemann已经将Cu和V明确列为有毒元素,同时Ti-6Al-4V的耐腐蚀性能差,已有学者报道长期的体液腐蚀会导致Al、V等金属离子的析出[4],有研究证实,Ti-6Al-4V析出的金属离子虽然不会对人体器官产生明显的影响,但却具有潜在的生物毒性风险[5]。
3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法是公认的、经典的评价材料细胞毒性的体外实验方法[6],本研究选用了MTT法评价细胞毒性,还创新性地选用了人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HU) 进行培养,同时同步X射线光电子能谱分析(X-ray photoelectron spectroscopy,XPS)分析了细胞培养液浸泡前后合金表面组元状态的变化,旨在检测CPTi和Ti-6Al-4V对HU增殖的影响及CPTi和Ti-6Al-4V是否发生腐蚀或金属离子溶解现象。
1 材料与方法
1.1 金属试件的制备
将CPTi和Ti-6Al-4V制作成直径6 mm、厚度2 mm的金属圆片(刚好放入96孔板的孔中),机械研磨后抛光,依次在丙酮、酒精和去离子水中超声清洗、吹干,超净工作台中紫外线双面照射各1h,备用。
1.2 细胞培养
HU(ATCC:CRL-1730)培养基选用高糖 DMEM(Gibieo)和10%胎牛血清(天津TBD公司),2~3 d换液,细胞生长至80%融合时进行传代。
1.3 电镜观察
将CPTi和Ti-6Al-4V金属试件放入96孔板的孔中,传代后的HU(2×104/mL)接种于96孔板内,每种金属每个时间点接种5孔,接种6 h后取出,然后固定,梯度乙醇脱水,样本喷金,扫描电镜下拍照。
1.4 MTT法检测
将CPTi和Ti-6Al-4V金属试件放入2块无菌96孔板中,接种方法同1.3。每种金属每个时间点接种8孔,同时设空白对照组8孔,即不放金属试件的情况下接种细胞。设7个时间点:接种后4 h、1 d、2 d、3 d、7 d、10 d和14 d将孔内金属试件移入新的96孔板中,每孔加入MTT(Amresco)溶液,放入培养箱孵育4 h后,取出,避光条件下加入二甲亚枫(Amresco)100 μL,570 nm 波长条件下酶标仪检测光密度(optical density,OD)值。
1.5 XPS分析
使用ESCALAB250 X-光线电子能谱仪(美国Thermo VG公司)对抛光后以及细胞培养液浸泡7 d后的金属片进行表面成分深度分析,获得的全谱和精细谱,参照C 1 s峰位(284.6 eV)进行校正,使用XPSPEAK表面化学分析软件进行数据处理。
1.6 统计学方法
利用SPSS 13.0软件,数据用±s表示,采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 电镜观察结果

如图1所示,HU接种到CPTi和Ti-6Al-4V 6 h后500倍电镜下观察到细胞呈现卵圆形,在材料表面自由铺展,2种材料细胞的数量、大小和形态基本没有差别(图1A,1B);5 000倍电镜下,观察到细胞呈摊开的“鸡蛋饼”状,在材料上自由铺展,向四周伸出很多伪足,细胞表面分泌很多球蛋白使细胞表面凹凸不平(图1C,1D);10 000倍电镜下观察到细胞的丝状伪足非常清晰,其上附挂有许多球蛋白,相邻细胞间通过伪足紧密接触(图1E,1F)。
2.2 MTT结果
如表1所示,接种后HU数量随时间延长先是逐渐增多,在3 d时达到饱和之后降低。4 h、1 d和3 d时,CPTi、Ti-6Al-4V材料和对照组所测的OD值没有统计学差异(P>0.05);而 2 d、7 d、10 d 和 14 d时CPTi和Ti-6AL-4V材料所测的OD值没有统计学差异(P>0.05),但都显著低于对照组(P<0.05)。
表1 3组材料接种后HU细胞数量MTT结果比较(±s)Tab.1 MTT results of 3 types of material after inoculation(±s)
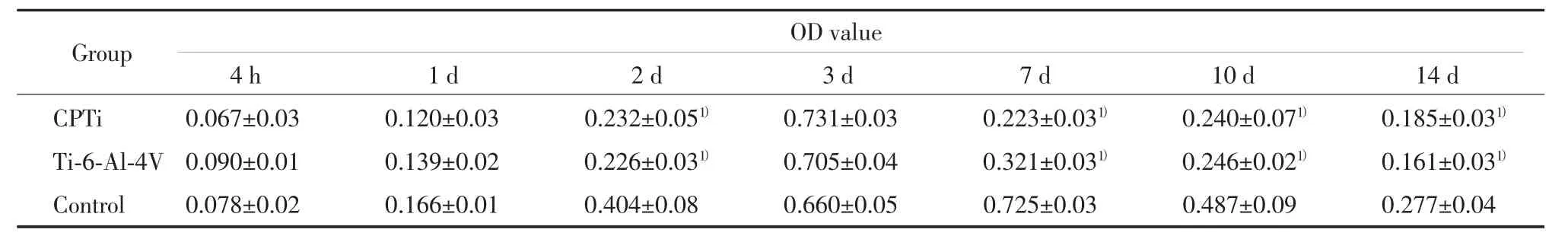
表1 3组材料接种后HU细胞数量MTT结果比较(±s)Tab.1 MTT results of 3 types of material after inoculation(±s)
1)P<0.05 vs control group.
OD value 4 h 1 d 2 d 3 d 7 d 10 d 14 d CPTi 0.067±0.03 0.120±0.03 0.232±0.051) 0.731±0.03 0.223±0.031) 0.240±0.071) 0.185±0.031)Ti-6-Al-4V 0.090±0.01 0.139±0.02 0.226±0.031) 0.705±0.04 0.321±0.031) 0.246±0.021) 0.161±0.031)Control 0.078±0.02 0.166±0.01 0.404±0.08 0.660±0.05 0.725±0.03 0.487±0.09 0.277±0.04 Group
2.3 XPS结果
如图2所示,CPTi在抛光后以及细胞培养液中浸泡7 d后表面层Ti、O组元的XPS分析可以发现随着溅射深度的增加,Ti元素含量逐渐由16 at.%增加至稳定,氧元素含量逐渐降低,氧元素的深度分布可以反映表面腐蚀氧化层的厚度,钝化膜厚度约为20 nm。随着溅射深度的变化,钛元素的价态发生改变,表面层富集氧化态Ti4+,然后峰位偏移至Ti3+价态,紧接着是Ti2+,最终金属态Ti0含量逐渐增加趋于稳定。随着溅射深度的增加,钛元素含量由14 at.%逐渐增加至稳定,氧元素含量由77 at.%逐渐降低,钝化膜厚度增加至45 nm。可以发现相比于浸泡前的抛光样品,浸泡后表面层聚集更多的氧化态Ti4+。

Ti-6Al-4V合金片在抛光后以及在细胞培养液中浸泡7 d后经过XPS分析发现,随着溅射深度的增加,Ti、Al、V元素含量逐渐增加至稳定,氧元素含量逐渐降低,钝化膜厚度约为18 nm。对抛光后样品在不同溅射深度处获得的Ti 2p、Al 2p、V 2p的XPS精细谱进行分峰拟合后的结果发现,其表面主要由氧化态Ti4+、Al3+以及少量V5+组成,随着溅射深度增加,金属态Ti0,Al0,V0出现,含量逐渐趋于稳定。在细胞培养液中浸泡7 d后表面成分Ti、Al、V、O组元的钝化膜厚度增加至49 nm左右。在不同溅射深度处获得的Ti 2p、Al 2p、V 2p的XPS精细谱进行分峰拟合后的结果可以看出最外表面处主要由氧化态Ti4+,Al3+和少量V5+组成,随着溅射深度的增加,金属态Ti0,Al0,V0出现并且逐渐达到稳定。与原始抛光后样品相比,最外表面处富集更多的氧化态Ti4+和Al3+,说明Ti和Al元素优先发生氧化以增厚钝化膜从而保护合金基体。见图3。
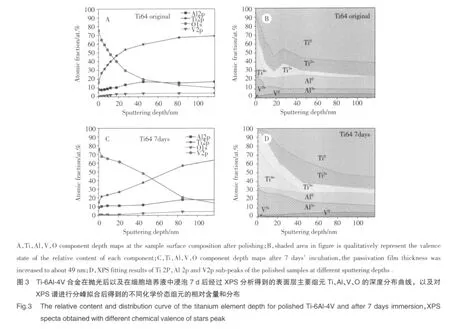
3 讨论
生物材料的表面特性对其植入效果十分重要。生物材料植入体内后,首先是通过表面与体内环境(包括体液、细胞和组织)接触,因此生物材料表面特性对其抗腐蚀性、早期植入效果、生物活性以及血液相容性等都有直接影响。对生物材料表面结构与组成进行深入分析有助于了解它们对植入体的影响及其作用过程,并为生物材料的表面改性提供理论指导。抛光后CPTi和Ti-6Al-4V合金初始表面膜主要由氧化态Ti4+组成,Ti-6Al-4V合金表面还含有少量氧化态Al3+和微量V5+,表面钝化膜厚度为20 nm左右。细胞培养液浸泡后,表面膜的生成和合金元素的溶解过程同时发生,最终表面膜增厚以保护基体金属。本实验中XPS分析浸泡14 d后的CPTi和Ti-6Al-4V表面均有不同厚度的氧化膜生成,可以有效阻止金属离子的析出,因此认为这两种种植体合金材料的耐腐蚀性能几乎没有差别,都非常好。但是种植体植入体内后组织液中氧的浓度比空气中差很多,因此氧化膜的厚度可能会减小,同时形成的时间会比较长。另外,本研究中使用的是细胞培养液,与真正植入体内后的骨组织中的组织液的浸泡还是有差别的,进一步的检测还需要动物实验来进行验证。
Turpin等[7]发现浸泡前钛金属表面的氧化膜厚度约为30 nm,在酸性口腔液中浸泡后表面钝化膜厚度有了明显提高,主要是由钛的各种氧化状态组成,这与本结果接近。本研究使用的浸泡环境是高糖DMEM(加10%胎牛血清)中含有各种无机盐离子(如 Cl-、PO43-)和有机物(如氨基酸和蛋白质)。蛋白质是一种球形的细胞外白蛋白,可与大多数固体表面发生强相互作用,金属表面吸附蛋白质分子后,一方面阻碍Cl-离子侵蚀,另一方面也阻止氧在金属表面的扩散,影响钝化膜的形成。同时,蛋白质可以与金属离子络合,加速金属离子的溶解,这3个方面相互制约导致金属表面保护膜的形成与表面金属离子溶解间的平衡。有文献报道[8]在模拟体液中CPTi和Ti-6Al-4V合金均具有较好的耐蚀能力。
现有评价牙科合金细胞毒性的研究多数选择的细胞分为两种:(1)大鼠成纤维细胞(L929)[9],这是ISO国际标准中指定的用于检测材料毒性的细胞;(2)与种植体表面直接接触的成骨细胞。目前使用的大多是小鼠成骨细胞(MC3T3)[10]和人骨肉瘤样细胞(MG-63)[11]。但是,还有一类细胞与种植体的颈部有小面积的直接接触,即人的牙龈上皮细胞,除此以外,还可以选用上皮细胞来研究种植体的细胞毒性。我们选用的HU在炎性反应中有着重要的作用,它可以分泌相关的细胞因子,表达与材料表面相互作用的黏附分子[12],可以帮助我们从炎症的角度来认识细胞与植入材料的相互作用。
综上所述,本研究认为CPTi和Ti-6Al-4V的生物相容性没有差别。Takemoto等[13]对CPTi和几种新型钛合金进行了细胞毒性的评估,将它们接种在3T3细胞上72 h,MTT结果未检测到明显的差异。因此认为,钛合金在生物环境中可能存在低腐蚀,数量极少的金属离子不足以引起明显的毒性,而本研究中将细胞接种的最长时间延至14 d,细胞的增殖过程中已经出现了一个峰值,然后逐渐降低,所得到的MTT结果仍显示2种材料没有统计学差异,同步的XPS结果观察到CPTi和Ti-6Al-4V都有钝化膜形成,也没有看到点蚀情况的发生,这在一定程度上可以说明生长在材料表面的细胞的代谢活动对材料几乎没有腐蚀作用。但是人们对Ti-6Al-4V的离子释放问题始终很担忧,因此长期的腐蚀效果观察还需要进一步的动物实验。
[1]Frisken KW,Dandie GW,Lugowski S,et al.A study of titanium release into body organs following the insertion of single threaded screw implants into the mandibles of sheep[J].J Aust Dent J,2002,47(3):214-217.
[2]Meyer U,Buhner M,Buchter A,et al.Fast element mapping of titanium wear around implantsof different surface structures[J].Clin O-ral Implants Res,2006,17(2):206-211.
[3]Esposito M,Lausmaa J,Hirsch JM,et al.Surface analysis of failed oral titanium implants[J].J Biomed Mater Res,1999,48(4):559-568.
[4]Ahmad S,Isab AA,Ali S,et al.Perspectives in bioinorganic chemistry of some metal-based therapeutic agents[J].Polyhedron,2006,25(7):1633-1645.
[5]Huang HH.Effect of fluoride and albumin concentration on the corrosion behavior of Ti-6Al-4V alloy[J].Biomaterials,2003,24(2):275-282.
[6]Yang X,Xi T.Progress in the Studies on the Evaluation of BiocompatibilityofBiomaterials[J].JBimedEngineering,2001,18(1):123-128.
[7]Turpin YL,Tardivel RD,Tallec A,et al.Corrosion susceptibility of titanium covered by dental cements[J].Dent Mater,2000,16(1):57-61.
[8]Li J,Wei JH,Zhang YM,et al.An evaluation on biocompatibility of a new titanium alloy for surgical implant application[J].J Pract Stomatol,2010,26(5):636-640.
[9]Zhang Q,Zhang W,Inoue A.New Cu-Zr-based bulk metallic glasses with large diameters of up to 1.5 cm[J].Scripta Mater,2006,55(8):711-713.
[10]Huang L,Cao Z,Meyer HM,et al.Responses of bone-forming cells on pre-immersed Zr-based bulk metallic glasses:Effects of composition and roughness[J].Acta Biomater,2011,7(1):395-405.
[11]Amaral M,Dias AG,Gomes PS,et al.Nanocrystalline diamond:In vitro biocompatibility assessment by MG63 and human bone marrow cells cultures[J].J Biomed Mater Res Part A,2008,87A(1):91-99.
[12]Tsarky R,Kalbacova M,Hempel U,et al.Response of human endothelial cells to oxidative stree on Ti6Al4V alloy[J].Biomaterials,2007,28(5):806-813.
[13]Takemoto S,Hattori M,Yoshinari M,et al.Corrosion mechanism of Ti-Cr alloys in solution containing fluoride[J].Dent Mater,2009,25(4):467-472.
