氯化镉对斑马鱼胚胎的发育毒性
2013-08-20鲁疆王占洋袁玉婷许波高永林张波郑秋生王振华
鲁疆,王占洋,袁玉婷,许波,高永林,张波,郑秋生,,王振华,,*
1.石河子大学药学院新疆特种植物药资源教育部重点实验室,石河子832002
2.烟台大学生命科学学院,烟台264005
镉(Cd)是一种常见的环境毒物,目前发现其对人体没有任何生理作用。Cd的生物半衰期长达10~35 y,可在体内长期蓄积产生毒性。Cd污染不仅影响农作物的生长发育、产品及质量,还通过食物链的形式在动物和人类体内大量蓄积,危害动物和人类的健康及生命安全。Cd可以对人体肝、肾、骨骼、及生殖等多个系统产生毒害作用。妊娠期的妇女接触Cd,不仅会受到Cd的毒性作用,而且Cd可以透过胎盘屏障损害胎儿神经系统发育,导致胎儿发育不良,新生儿体质量下降。1971年国际环境会议将Cd列为环境污染物中最危险的5种物质之一。随着工业化进程的加速,Cd暴露对人类健康的影响日益引起人们的关注[1-2]。我国目前至少有16个省(自治区、直辖市)报导过职业或环境Cd暴露对健康的不良影响。因而,开展Cd毒性研究具有巨大的现实意义和社会价值。大量实验表明,Cd的毒性机制与细胞受氧化胁迫相关[3-4]。氧化应激诱导脂质过氧化,是鱼类暴露Cd后众所周知的生物学效应[5-7]。Stohs和Bagchi研究表明[8],Cd诱导产生的抗氧化状态的变化,可能通过提高超氧阴离子自由基的产生和脂质过氧化反应,也有可能减少酶和非酶的抗氧化剂。Cd很可能触发氧化还原反应,产生自由基和活性氧(ROS)(包括 H2O2、O-2·、·OH 等),ROS 的积累会损伤DNA、蛋白质和脂类[3]。ROS在信号通路转导和转录因子调控中发挥着重要作用[9]。适量的ROS很可能作为第二信使激活转录因子NF-kappa-B,但高浓度的ROS会损伤组织[10]。在正常情况下,ROS和其他自由基会被抗氧化系统、抗氧化物酶(CAT、SOD、GPx、GST等)及非酶的抗化剂(GSH)清除[11-13]。如果ROS的量超过了抗氧化系统的防御能力,氧化应激会导致鱼类组织细胞多种类型的损伤[14]。近期,大量研究开始关注Cd暴露后氧化应激对鱼类的影响[15-17]。胡蓉等[18]研究表明,Cd2+、Hg2+对鲫鱼胚胎发育和仔鱼均有毒害作用,且随Cd2+、Hg2+质量浓度的增大和染毒时间的延长,毒性效应不断增加。研究表明,Cd积累及其毒性效应会影响日本比目鱼的生长和抗氧化系统,减少中国沿海水域商业鱼类数量。Chow等[19]2008年研究表明,Cd诱导斑马鱼胚胎神经毒性抑制神经形成,从而减少神经元分化和轴突形成。Chow等[20]2009年研究表明,Cd暴露斑马鱼胚胎幼鱼眼视网膜分化细胞减少,视网膜神经节细胞轴突形成受损和视锥细胞缺乏,是引起眼球和视力受损的主要原因。Cd暴露后,鱼类将启动多种酶类和非酶的抗氧化机制来抵御氧化应激。例如,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、还原型谷胱甘肽(GSH)及谷胱甘肽S-转移酶(GST),它们可以解除重金属暴露的毒性作用,清除ROS,从而预防鱼类受氧化损伤[21-22]。
斑马鱼(Danio rerio)是已经被人们广泛接受并用于研究胚胎发育,遗传分析,毒理学和多种人类疾病的理想模式生物[23-24]。经济合作与发展组织(OECD)在1996年将斑马鱼胚胎发育的方法列为测定单一化学毒物的标准方法之一,并制定了详细的操作指南[25]。运用斑马鱼检验环境化学物的致畸效应,具有成本低、影响因素少、可重复性好、易操作、灵敏度高以及可观察多项毒性指标的特点,并可以此判断污染物的致毒机理。
近些年来,国内外大量研究报道了Cd毒性在实验动物肝、肾、骨骼及神经系统中与金属硫蛋白[26-27]、钙[28]、线粒体[29]及诱导氧化胁迫[30]的作用机理。但是关于Cd对胚胎发育的毒性及机制的相关报道极为少见,然而关于Cd诱导氧化应激对斑马鱼胚胎发育的影响仍未见报道。以斑马鱼为实验动物考察了氯化镉对斑马鱼胚胎发育的毒性作用,并初步探讨了氧化胁迫与Cd毒性的相关性,为进一步深入研究Cd发育毒性以及合理的临床干预提供参考依据。
1 材料与方法(M aterials and m ethods)
1.1 材 料
AB系斑马鱼成鱼由国家斑马鱼模式动物北方中心惠赠,由本实验室繁育保存。
E3 培养液含 0.17mmol·L-1KCl,5mmol·L-1NaCl,0.33mmol·L-1MgSO4,0.33mmol·L-1CaCl2,pH 7.4。
CdCl2纯度为99.0%,上海中秦化学试剂公司;丙二醛(MDA)测定试剂盒,南京建成生物工程研究所;GSH和GSSG检测试剂盒均为碧云天生物技术研究所;N-乙酰半胱氨酸(NAC),麻醉剂Tricaine和活性氧荧光探针DCFH-DA均购自美国SIGMA公司;其他试剂均为国产分析纯。
1.2 方 法
1.2.1 鱼卵的收集
成年斑马鱼饲养于独立养殖单元(北京爱生),水温(28.5±0.3)℃,盐度为450~500 μS,pH为7.0 ~7.5,光周期为14 h/10 h(光照/黑暗),每日喂3次活丰年虾。在收集胚胎的前一天晚,将1条雌鱼和1条雄鱼移入交配盒,用隔板将其隔开,第2天光照1 h后移去隔板,观察产卵时间。于产卵后1 h收集受精卵,用E3培养液轻轻冲洗3次后,置于E3培养液中,28.5℃恒温光照培养箱中培养。
1.2.2 胚胎染毒实验
参照Vaughan等[31]的方法,收集受精后1 h(1 hpf)斑马鱼胚胎置于12孔细胞培养板中,10卵/孔,每孔加入2.0mL含不同浓度CdCl2的E3培养液,每处理组设胚胎80枚,另取80枚卵孵育于不含CdCl2的E3培养液作为正常对照。随后加盖封闭,置于28.5℃恒温光照培养箱内,让胚胎继续发育。每24 h更换一半E3培养液,并观察胚胎发育状况,至96 hpf。以卵凝结或心脏停跳作为胚胎死亡终点,记录胚胎和/或幼鱼的死亡、畸形及幼鱼孵化情况,计算死亡率、孵化率和畸形率:胚胎死亡率(%)=(死亡胚胎数量/总胚胎数量)×100;胚胎孵化率=(孵化的胚胎总数/总胚胎数量)×100;畸形率(%)=(畸形幼鱼数量/已孵化胚胎数量)×100。
1.2.3 NAC 干预实验
按1.2.2胚胎染毒方法,取1 hpf胚胎,胚胎暴露于含20mg·L-1CdCl2,或同时含有20mg·L-1CdCl2和10 mg·L-1NAC,或含有10mg·L-1NAC 的E3 培养液,同时设空白对照组。以卵凝结或心脏停跳作为死亡终点,在体式显微镜下观察至96 hpf,记录胚胎和/或幼鱼的死亡数、畸形数及幼鱼的孵化数,计算死亡率、畸形率和孵化率。
1.2.4 胚胎细胞凋亡观察
参照文献[32]的方法,收集1 hpf斑马鱼胚胎,按1.2.3 方法处理至24 hpf,更换为含5 mg·L-1吖啶橙(AO)的 E3培养液,28.5℃孵育 20 min,以不含AO的E3培养液洗涤3次,每次5 min,加入含0.016 mol·L-1Tricaine的 E3培养液处理1 min,麻醉胚胎后,在荧光显微镜(日本Nikon ECLIPSE 80i)下以蓝光激发,观察胚胎细胞凋亡情况并拍照。
1.2.5 胚胎活性氧水平测定
按1.2.3方法处理1 hpf胚胎3 h,E3培养液清洗胚胎3次后,更换为含20μmol·L-1DCFH-DA的E3培养液,于28.5℃孵育1 h,以E3培养液洗涤胚胎3次,吸净E3培养液,每处理选取20枚胚胎,加入预冷的200μL E3培养液后,电动组织匀浆器匀浆,匀浆液于4℃、10 000 g下离心4 min,取200μL上清液,加入96孔酶标板,于酶标仪(瑞士 Tecan Infinite M200,)测定荧光强度(激发波长485 nm,发射波长535 nm)。
1.2.6 MDA 含量测定
按1.2.3方法处理1 hpf胚胎3 h,每处理取胚胎20枚,转移到离心管中,以E3培养液洗涤胚胎3次,吸干表面液体,加入200μL E3培养液,电动组织匀浆器匀浆,匀浆液于4℃、10 000 g下离心10 min。取上清,按试剂盒说明书方法测定MDA含量。
1.2.7 GSH、GSSG 指标测定
按1.2.3方法处理1 hpf胚胎3 h,每处理取20枚胚胎,转移到1.5 mL离心管中,冰浴E3培养液洗涤3次,吸干表面液体,匀浆,4℃放置10min,4℃、10 000 g下离心10 min,取上清按照试剂盒说明书测定GSH和GSSG值。
1.2.8 统计学分析
所有实验均重复3次。实验数据采用平均值±标准差(mean±SD)表示,除特别说明外,结果均采用SAS 8.1统计软件进行单因素方差分析,P<0.05表示差异具有显著性统计学意义。
2 结果(Results)
2.1 氯化镉对斑马鱼胚胎发育的毒性效应
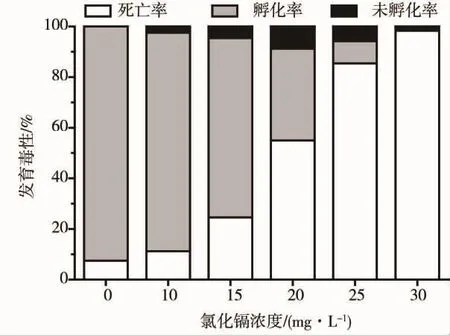
图1 氯化镉对斑马鱼胚胎的毒性效应Fig.1 Toxic effects of CdCl2 on zebrafish embryos
斑马鱼胚胎于54 hpf开始孵化出膜,对照组至78 hpf孵化完全。10 ~30mg·L-1CdCl2处理后,斑马鱼胚胎孵化率降低,死亡率升高,呈浓度依赖性。30 mg·L-1CdCl2处理组至 96 hpf时胚胎死亡率达98.3%,且未有胚胎孵化。各组斑马鱼胚胎死亡均发生于24 hpf之前。采用线性回归分析法计算出CdCl2处理至96 hpf对斑马鱼胚胎的半数致死浓度(LC50)为 18.9 mg·L-1(R2=0.973)。
2.2 氯化镉对斑马鱼胚胎发育的致畸作用
10~25 mg·L-1CdCl2暴露对斑马鱼胚胎及幼鱼多个系统的发育产生明显影响,主要表现为鱼卵发育阻滞、心脏水肿、卵黄囊水肿和脊柱弯曲等多种发育异常(图3)。10~25 mg·L-1CdCl2处理后,幼鱼心脏水肿、脊柱弯曲及总畸形率升高(图2,图3)。采用线性回归分析法计算出CdCl2处理至96 hpf对斑马鱼胚胎的半数致畸浓度(EC50)为13.7 mg·L-1(R2=0.967)。

图2 氯化镉致斑马鱼胚胎的发育畸形率Fig.2 Developmentalmalformation rate of zebrafish embryos induced by CdCl2
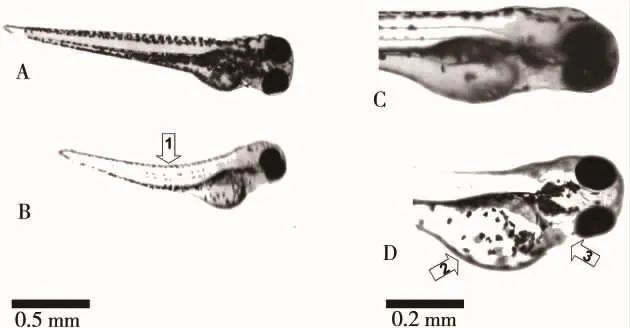
图3 氯化镉致斑马鱼胚胎发育的典型畸形特征
2.3 抗氧化剂NAC对氯化镉发育毒性的干预作用
与对照组比较,20 mg·L-1CdCl2单独处理斑马鱼胚胎,致胚胎死亡率(图4)和畸形率(图5)均明显增加(P <0.01);采用 10 mg·L-1NAC 与 20 mg·L-1CdCl2联合处理斑马鱼胚胎,与单纯CdCl2处理组相比,胚胎死亡率(图4)和畸形率(图5)均明显降低(P <0.01)。与对照组比较,20 mg·L-1CdCl2单独处理斑马鱼幼鱼体长(图6)明显缩短(P<0.05);采用10 mg·L-1NAC 与 20 mg·L-1CdCl2联合处理斑马鱼胚胎,与单纯氯化镉处理组相比,斑马鱼幼鱼体长(图6)明显增长(P<0.05)。表明NAC对CdCl2所致的斑马鱼胚胎发育毒性有一定保护作用。
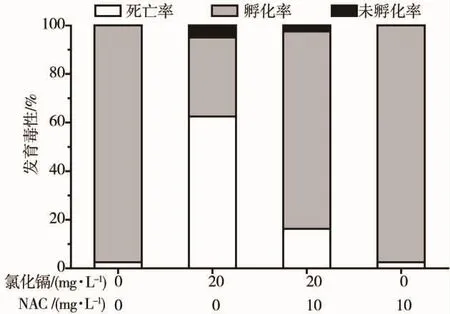
图4 NAC干预氯化镉对斑马鱼胚胎的毒性效应Fig.4 NAC intervened toxic effect of CdCl2 on zebrafish embryos
2.4 氯化镉导致斑马鱼胚胎细胞的异常凋亡

图5 NAC干预氯化镉致斑马鱼胚胎的总畸形率Fig.5 NAC intervened total aberation rate of zebrafish embryos caused by CdCl2

图6 NAC干预氯化镉对斑马鱼胚胎体长的影响Fig.6 NAC intervened short snout-vent length of zebrafish embryos caused by CdCl2
斑马鱼胚胎经吖啶橙染色后,凋亡细胞呈现亮绿色荧光。正常组胚胎卵黄囊部位可见大量深染凋亡细胞,其他部位仅见少量深染细胞(图7A)。20mg·L-1CdCl2处理后,除卵黄囊部位见大量深染细胞外,头部和尾部亦可见大量深染细胞(图7B),表明CdCl2处理可能对中枢神经系统发育有一定影响。采用10 mg·L-1NAC 与20 mg·L-1CdCl2联合处理斑马鱼胚胎后,仅见少量凋亡细胞(图7C),表明NAC对CdCl2诱导的斑马鱼胚胎细胞凋亡有明显的抑制作用。
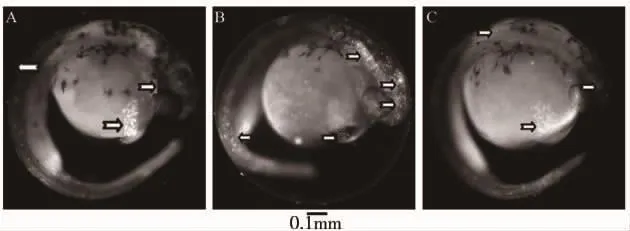
图7 氯化镉对斑马鱼胚胎细胞凋亡的影响
2.5 氯化镉暴露导致斑马鱼胚胎氧化胁迫损伤
20mg·L-1CdCl2处理斑马鱼胚胎后,胚胎ROS水平(图8A)、胚胎脂质过氧化产物丙二醛(MDA)水平(图8B)均明显高于对照组(P <0.01),GSH/GSSG 水平明显低于对照组(P<0.01)(图8C),表明CdCl2处理致斑马鱼胚胎发生了氧化应激损伤。采用10 mg·L-1NAC与20mg·L-1CdCl2共同处理斑马鱼胚胎,可明显下调胚胎组织中ROS和MDA水平(P<0.05)(图8A和B),上调 GSH/GSSG 水平(P <0.05)(图8C),表明NAC对CdCl2所致斑马鱼胚胎氧化应激损伤有一定防护作用。
3 讨论(Discussion)
Cd是一种强的脂质过氧化作用诱导剂,脂质过氧化作用可导致细胞膜通透性增强,造成细胞内外的稳态失调,从而引起一系列损害。Cd能够降低肝脏中谷胱甘肽含量,有效抑制POD、SOD和CAT活性,改变细胞内的抗氧化系统,使自由基不能及时被清除,造成机体内大量自由基积累。GSH在清除细胞内H2O2、O-2·和LOOH中扮演了重要角色,同时GST能够催化外源性毒物与GSH反应结合,以保护组织不受氧化胁迫损伤[33]。大量的 ROS会激活caspase依赖型途径,诱导细胞凋亡。而NAC作为抗氧化剂易进入细胞,脱乙酰基后成为谷胱甘肽前体,能促进还原型谷胱甘肽的合成,而谷胱甘肽氧化-还原循环在机体内具有许多功能,是组织抗氧化损伤的重要内源性防御机制。
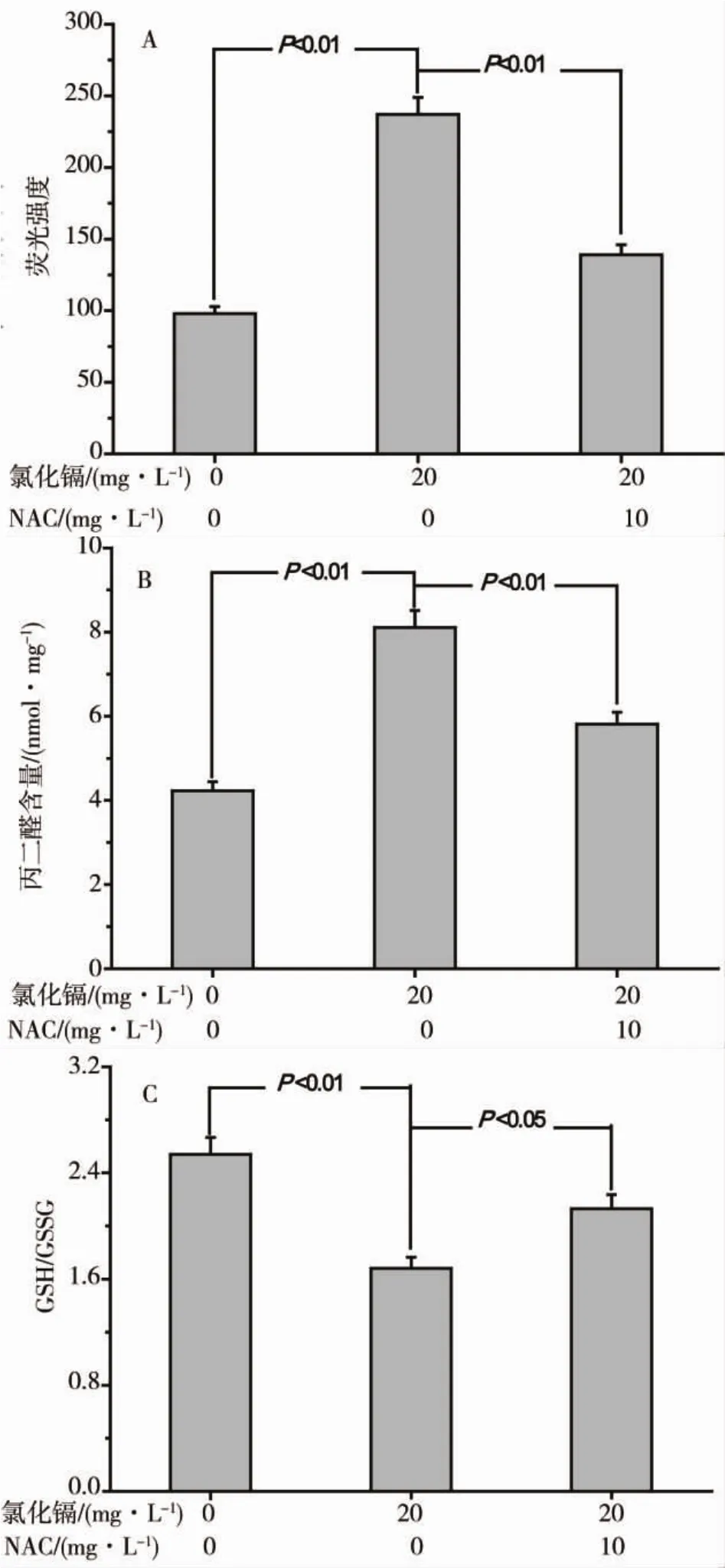
图8 氯化镉对斑马鱼胚胎氧化胁迫状态的影响Fig.8 Effect of CdCl2 on oxidative stress status of zebrafish embryos
本研究表明,斑马鱼胚胎暴露于CdCl296 h后,胚胎的死亡率、畸形率均明显升高,CdCl2处理可致胚胎凋亡细胞明显增多,幼鱼体型短小。幼鱼头部和尾部可见大量细胞凋亡,表明CdCl2处理可能对中枢神经系统发育有一定影响。Krumschnabel等[34]-12010年研究发现,Cd可以诱导虹鳟鱼细胞坏死性凋亡。Risso-de Faverney等[35]2004 年研究表明,Cd通过线粒体途径诱导虹鳟鱼肝细胞氧化胁迫,进而导致细胞凋亡。Chen等[36]研究发现,Cd诱导ROS产生,进而激活雷帕霉素(mTOR)信号通路,活化胰岛素生长因子受体(IGFR/PI3K),抑制腺苷酶活化蛋白激酶(PTEN/AMPK),导致神经细胞凋亡。Long等[37]研究发现,ABCC5/MRP5 是一种有机阴离子载体,参与机体防御和细胞信号转导。ABCC5在斑马鱼胚胎发育和解除重金属(Cd、Pb等)毒性中扮演了重要角色。显性失活的ABCC5会引起斑马鱼胚胎发育阻滞,而Cd、Pb和Hg等重金属暴露致斑马鱼胚胎 ABCC5表达上调。本研究中,较CdCl2的单独处理组,NAC与CdCl2共同处理组中斑马鱼幼鱼体长明显增长,活性氧水平和MDA含量明显降低。这说明,Cd导致斑马鱼胚胎发育阻滞,可能与ROS诱导ABCC5表达相关。进一步研究表明,CdCl2染毒可致斑马鱼胚胎ROS水平和脂质过氧化水平明显升高,降低 GSH/GSSG比率,证实CdCl2暴露可致胚胎发生严重的氧化应激损伤。细胞的正常代谢可产生各种ROS,过多的ROS会导致这一生理平衡失调,可引起细胞的氧化应激、蛋白质变性、脂质过氧化产物 MDA增加以及 DNA断裂[38-41];MDA为体内脂质过氧化产物,GSH是体内含巯基的非蛋白化合物,具有保护酶分子和蛋白质免受内源或外源性氧化损伤,二者是评价细胞内氧化还原状态的重要指标。CdCl2可造成斑马鱼胚胎氧化应激,影响胚胎正常发育,甚至造成死亡。应用抗氧化剂NAC可明显拮抗CdCl2的发育毒性,胚胎孵化率显著升高,畸形率明显降低,胚胎凋亡细胞也明显减少,幼鱼体型增长;与氧化胁迫相关的胚胎ROS和MDA明显降低,而GSH/GSSG比值明显升高。以上数据表明,抗氧化剂NAC可以有效保护Cd暴露造成斑马鱼胚胎的发育毒性,进一步表明CdCl2对斑马鱼胚胎的发育毒性作用与氧化应激相关。Hsu等[42]近期发现,斑马鱼胚胎暴露于Cd中可致Cu/Zn超氧化物歧化酶(Cu/Zn-SOD)基因表达下调,进一步影响DNA错配修复基因的表达。然而,生物体内氧化还原平衡状态的调控依赖一套复杂的ROS生成和清除系统,Cd暴露是否仅仅作用于ROS清除系统,又或者也作用于ROS生成系统,尚待更完善的研究以揭示。
[1] Takenaka S,Karg E,Kreyling W G,et al.Fate and toxic effects of inhaled ultrafine cadmium oxide particles in the rat lung[J].Inhalation Toxicology,2004,16(s1):83-92
[2] Daston G P.Toxic effects of cadmium on the developing rat lung.Ⅱ.Glycogen and phospholipid metabolism[J].Journal of Toxicology and Environmental Health,1982,9(1):51-61
[3] López E,Arce C,Oset-Gasque M J,et al.Cadmium induces reactive oxygen species generation and lipid peroxidation in cortical neurons in culture[J].Free Radical Biology and Medicine,2006,40(6):940-951
[4] Pathak N,Khandelwal S.Oxidative stress and apoptotic changes in murine splenocytes exposed to cadmium[J].Toxicology,2006,220(1):26-36
[5] Roméo M,Bennani N,Gnassia-Barelli M,et al.Cadmium and copper display different responses towards oxidative stress in the kidney of the sea bass Dicentrarchus labrax[J].Aquatic Toxicology,2000,48(2-3):185-194
[6] Pandey S,Ahmad I,Parvez S,et al.Effect of endosulfan on antioxidants of freshwater fish Channa punctatus Bloch:1.Protection against lipid peroxidation in liver by copper preexposure[J].Archives of Environmental Contamination and Toxicology,2001,41(3):345-352
[7] Sayeed I,Parvez S,Pandey S,et al.Oxidative stress biomarkers of exposure to deltamethrin in freshwater fish,Channa punctatus Bloch[J].Ecotoxicology and Environmental Safety,2003,56(2):295-301
[8] Stohs SJ,BagchiD.Oxidativemechanisms in the toxicity of metal ions[J].Free Radical Biology& Medicine,1995,18(2):321-336
[9] Flora SJ,MittalM,Mehta A.Heavymetal induced oxidative stress&its possible reversalby chelation therapy[J].Indian Journal of Medical Research,2008,128(4):501-523
[10] Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].International Journal of Biochemistry and Cell Biology,2007,39(1):44-84
[11] Basha P S,Rani A U.Cadmium-induced antioxidant defense mechanism in freshwater teleost Oreochromis mossambicus(Tilapia)[J].Ecotoxicology and Environmental Safety,2003,56(2):218-221
[12] Hansen B H,Rφmma S,GarmoФ A,et al.Induction and activity of oxidative stress-related proteins during waterborne Cd/Zn-exposure in brown trout(Salmo trutta)[J].Chemosphere,2007,67(11):2241-2249
[13] Messaoudi I,Barhoumi S,Saïd K,et al.Study on the sensitivity to cadmium of marine fish Salaria basilisca[J].Journal of Environmental Sciences,2009,21(11):1620-1624
[14] Barata C,Varo I,Navarro JC,et al.Antioxidant enzyme activities and lipid peroxidation in the freshwater cladoceran Daphnia magna exposed to redox cycling compounds[J].Comparative Biochemistry and Physiology Part C:Toxicology& Pharmacology,2005,140(2):175-186
[15] Shi H,SuiY,Wang X,etal.Hydroxyl radical production and oxidative damage induced by cadmium and naphthalene in liver of Carassius auratus[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2005,140(1):115-121
[16] Atli G,Alptekin O,Tükel S,et al.Response of catalase activity to Ag+,Cd2+,Cr6+,Cu2+and Zn2+in five tissues of freshwater fish Oreochromis niloticus[J].Comparative Biochemistry and Physiology Part C:Toxicology& Pharmacology,2006,143(2):218-224
[17] Xu Z,Bai S.Effects ofwaterborne Cd exposure on glutathionemetabolism in Nile tilapia(Oreochromis niloticus)liver[J].Ecotoxicology Environmental Safety,2007,67(1):89-94
[18] 胡蓉,谢玉华,唐正义.汞镉离子对鲫鱼胚胎发育和仔鱼的毒性效应[J].安徽农业科学,2010,38(34):19446-19448,19458 Hu R,Xie Y H,Tang Z Y.Toxic effects of Hg2+and Cd2+on embryo developmentand larva fish of Carassius auratus[J].Journal of Anhui Agricultural Sciences,2010,38(34):19446-19448,19458(in Chinese)
[19] Chow E S,HuiM N,Lin CC,etal.Cadmium inhibits neurogenesis in zebrafish embryonic brain development[J].Aquatic Toxicology,2008,87(3):157-169
[20] Chow E S,Hui M N,Cheng CW,et al.Cadmium affects retinogenesis during zebrafish embryonic development[J].Toxicology and Applied Pharmacology,2009,235(1):68-76
[21] Asagba SO,Eriyamremu G E,Igberaese M E.Bioaccumulation of cadmium and its biochemical effecton selected tissues of the catfish[J].Fish Physiology and Biochemistry,2008,34(1):61-69
[22] Ruas C B,CarvalhoúC S,de Araújo H S,et al.Oxidative stress biomarkers of exposure in the blood of cichlid species from a metal-contaminated river[J].Ecotoxicology Environmental Safety,2008,71(1):86-93
[23] Hill A J,Teraoka H,Heideman W,et al.Zebrafish as a model vertebrate for investigating chemical toxicity[J].Toxicological Sciences,2005,86(1):6-19
[24] Spitsbergen JM,Kent M L.The state of the art of the zebrafish model for toxicology and toxicologic pathology research--Advantages and current limitations[J].Toxicology Pathology,2003,31(s1):62-87
[25] Braunbeck T,BöttcherM.OECD Guideline for the Testing of Chemicals[EB/OL].(2006-05-30)[2013-11-21].http://www.oecd.org/chemicalsafety/testing/36817242.pdf
[26] Dar S,Shuja R N,Shakoori A R.A synthetic cadmium metallothionein gene(PMCd1syn)of Paramecium species:Expression,purification and characteristics of metallothionein protein[J].Molecular Biology Reports,2013,40(2):983-997
[27] Onodera A,TaniM,Michigami T,etal.Role ofmegalin and the soluble form of its ligand RAP in Cd-metallothioneinendocytosis and Cd-metallothionein-induced nephrotoxicity in vivo [J].Toxicology Letters,2012,212(2):91-96
[28] Miura S,Takahashi K,Imagawa T,et al.Involvement of TRPA1 activation in acute pain induced by cadmium in mice[J].Molecular Pain,2013,9(1):7-16
[29] Liu D,Yang J,Wang L.Cadmium induces ultrastructural changes in the hepatopancreas of the freshwater crab Sinopotamon henanense[J].Micron,2013,47:24-32
[30] Chang K C,Hsu C C,Liu S H,et al.Cadmium induces apoptosis in pancreaticβ-cells through a mitochondria-dependent pathway:The role of oxidative stress-mediated c-Jun N-terminal kinase activation[J].PLOSONE,2013,8(2):e54374,doi:10.1371/journal.pone.0054374
[31] Vaughan M,van Egmond R.The use of the zebrafish(Danio rerio)embryo for the acute toxicity testing of surfactants,as a possible alternative to the acute fish test [J]. ATLA-Alternatives Laboratory Animals,2010,38(3):231-238
[32] Chan PK,Cheng SH.Cadmium-induced ectopic apoptosis in zebrafish embryos[J].Archives of Toxicology,2003,77(2):69-79
[33] van der Oost R,Beyer J,Vermeulen N PE.Fish bioaccumulation and biomarkers in environmental risk assessment:A review [J].Environmental Toxicology and Pharmacology,2003,13(2):57-149
[34] Krumschnabel G,Ebner H L,Hess MW,et al.Apoptosis and necroptosis are induced in rainbow trout cell lines exposed to cadmium [J].Aquatic Toxicology,2010,99(1):73-85
[35] Risso-de Faverney C,Orsini N,de Sousa G,et al.Cadmium-induced apoptosis through the mitochondrial pathway in rainbow trouthepatocytes:Involvement of oxidative stress[J].Aquatic Toxicology,2004,69(3):247-258
[36] Chen L,Xu B,Liu L,et al.Cadmium induction of reactive oxygen species activates the mTOR pathway,leading to neuronal cell death[J].Free Radical Biology and Medicine,2011,50(5):624-632
[37] Long Y,LiQ,Li J,et al.Molecular analysis,developmental function and heavy metal-induced expression of ABCC5 in zebrafish[J].Comparative Biochemistry and Physiology B:Biochemistry and Molecular Biology,2011,158(1):46-55
[38] Zenzes M T,Krishnan S,Krishnan B,et al.Cadmiun accumulation in follicular fluid ofwomen in vitro fertilization embryo transfer is higher in smokers[J].Fertility and Sterility,1995,64(3):599-603
[39] Inoguchi T,Takayanagi R.Role of oxidative stress in diabetic vascular complications[J].Fukuoka Igaku Zasshi,2008,99(3):47-55
[40] Kelly K A,Havrilla C M,Brady T C,et al.Oxidative stress in toxicology:Established mammalian and emerging piscinemodel systems[J].Environmental Health Perspectives,1998,106(7):375-384
[41] Liochev S I.Reactive oxygen species and the free radical theory of aging[J].Free Radical Biology and Medicine,2013,60:1-4
[42] Hsu T,Huang K M,Tsai H T,et al.Cadmium(Cd)-induced oxidative stress down-regulates the gene expression of DNA mismatch recognition proteins MutS homolog 2(MSH2)and MSH6 in zebrafish(Danio rerio)embryos[J].Aquatic Toxicology,2012,126:9-16◆
