利用SOS/umu测试方法鉴定沙颍河河水中的遗传毒性物质
2013-08-20张建超马福俊胡建英
张建超,马福俊,胡建英,*
1.山东师范大学生命科学学院,济南250014
2.北京大学城市与环境学院,北京100871
水体的安全问题一直受到人们的广泛关注。研究表明,地表水中存在着遗传毒性物质[1-2],低剂量长期暴露于这些物质会增加人类的患癌风险[3],因此,解析水环境中遗传毒性成因是进行有效环境管理的基础。
由于水环境中的遗传毒性物质种类非常繁多,而且其浓度又非常小,因此,仅用化学检测方法较难综合评价水体中的遗传效应。生物检测方法能够检测多种物质共存下的综合毒性效应,在环境领域具有一定范围的应用。特别是以毒性检测为导向的遗传毒性物质的鉴定评价方法(toxicity identification evaluation,TIE)能够更加有效地鉴定环境样品中遗传毒性物质[2,4-5]。但是除了环境样品本身基质高给痕量物质的鉴定带来难度之外,遗传毒性物质的结构特性各异,作用机制也各不相同,仅仅采用目前常用的遗传毒性生物检测方法如Ames实验、微核实验以及SOS/umu实验进行物质鉴定依然存在较大难度。
芳香胺和硝基芳烃是两大类重要的遗传毒性物质,对细菌和哺乳动物细胞都具有致突变性[6-10],芳香胺易诱导人体产生膀胱癌[11-12]、胃癌、食道癌、肝癌和胰腺癌等癌症[13],硝基芳烃化合物是一种潜在的致癌物质,可引起肺、肝脏和肾脏的损伤[14-16]。这些物质均需要O-乙酰转移酶(O-AT)的代谢才能产生遗传毒性效应。Ames实验中,O-AT过量表达的菌株YG1024、YG1029已经应用于环境样品的检测;SOS/umu实验中,O-AT过量表达的菌株NM2009也已经被开发出来并逐渐应用于环境样品的遗传毒性检测中。这些菌株能够特异性地和高灵敏度地检测芳香胺和硝基芳烃这2类物质[17-20]。与Ames实验相比,SOS/umu实验具有所需菌株种类少、操作简单快速等优点,NM2009在检测水样中的芳香胺类物质及硝基芳烃化合物方面更具优势。
为了研究河南沈丘癌症高发地区的沙颍河河水中的潜在遗传毒性物质,本研究用HLB固相萃取柱富集水样中的微量化学物质,HPLC分割样品后,用生物检测方法测试各馏分的遗传毒性效应。选用了SOS/umu测试体系,比较了原菌TA1535/pSK1002和O-AT过表达的SOS/umu菌株NM2009的检测结果,探索沙颍河河水中是否存在芳香胺类或硝基芳烃类物质。
1 材料与方法(M aterials and methods)
1.1 实验试剂及仪器
色谱纯甲醇、丙酮、正己烷、二氯甲烷和乙腈购自 Fisher Chemical(Fair Lawn,NJ,USA),4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide,4-NQO,纯度98%,Acros Organics)和 2-氨基蒽(2-aminoanthracene,2-AA,纯度 96%,Acros Organics)用作阳性对照;二甲基亚砜(dimethyl sulfoxide,DMSO,ACS级,美国AMRESCO)为稀释溶剂和阴性对照;十二烷基磺酸钠(SDS);邻硝基酚-β-D-半乳糖苷(O-nitrophenol-b-D-galactopyranoside,ONPG,东京化成);酵母膏提取物(yeast extract,OXIOD);胰蛋白胨(tryptone,OXIOD);BIO-RAD 550酶标仪;Costar 96孔酶标板;Minishaker震荡器。
大鼠肝微粒体酶溶液(S9溶液)自提:大鼠经苯巴比妥钠和β-萘黄酮诱导后处死,取肝脏加KCl溶液后匀浆、离心。上清即为S9溶液,S9辅助因子:NADH、NADPH 和 G-6-P(购自美国 Sigma),MgCl2、KCl、Na2HPO4和NaH2PO4(购自国药集团化学试剂公司)。
1.2 样品采集与前处理
2011年12月,从河南省沈丘县赵口村的沙颍河中采集10 L水样(图1)。水样经1.2μm Whatman GF/C玻璃纤维纸(Maidstone,UK)过滤后,过HLB固相萃取柱(6mL,500mg,Waters Oasis,USA),每根HLB柱富集2 L水,流速为5~10mL·min-1。HLB柱用之前需经6mL正己烷、6 mL丙酮、6 mL甲醇和6 mL超纯水活化。HLB柱富集后,用氮气吹干。然后每根HLB柱用20mL丙酮洗脱,其中5 mL在微弱的氮气流下吹干后用DMSO定容到6.25μL;剩余的15mL吹干后用甲醇溶解,用于HPLC分割。实验空白使用相同方法富集2 L超纯水。没有检测到遗传毒性。
图1 沙颍河流域采样点Fig.1 Sampling site from Shaying River
1.3 HPLC 分割
高效液相色谱分割的色谱条件:采用RP C18柱(4.6 mm ×250 mm Waters,USA)梯度洗脱,柱温为室温,流速1 mL·min-1,流动相A为乙腈,B为超纯水。梯度设置如表1所示,在0~36 min内,每隔2 min收集1个样品,共分割获得18个馏分。分割后的样品用真空冷冻干燥除去溶剂,为了减少冷冻干燥过程中的损失,样品瓶用带有小孔的铝箔封口,尽量减少冷冻干燥的接触面积,并严格控制干燥时间,等干燥完成后立即取出样品。最后,每一馏分用95μL DMSO定容,以待生物测试。
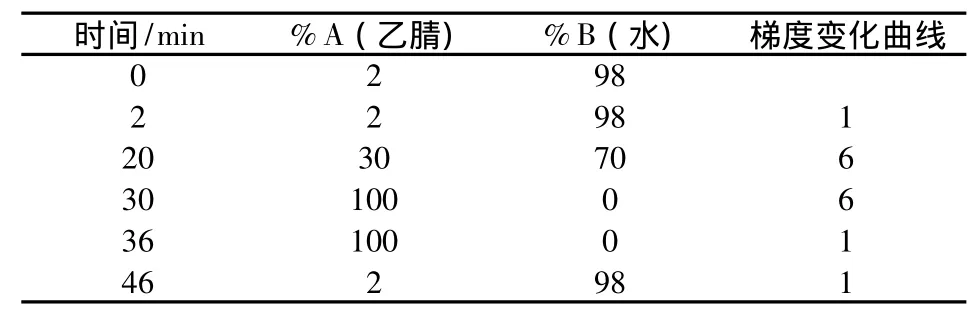
表1 HPLC分割梯度条件Table 1 Gradient conditions of HPLC fractionation
1.4 SOS/umu 实验
选用了SOS/umu实验的2种菌株:鼠伤寒沙门氏菌的原始菌株TA1535/pSK1002和O-AT过量表达的NM2009菌株。NM2009菌株对芳香胺类物质和硝基芳烃类物质有较强的响应能力。
SOS/umu测试按文献[21]所提供的方法,具体操作如下:将冻存的菌液置于含氨苄青霉素和氯霉素的LB培养基(1 g NaCl、1 g酵母膏提取物、2 g胰蛋白胨溶于200 mL超纯水,高压灭菌,放置冷却;在TA1535/pSK1002的实验中加最终浓度50 mg·L-1的氨苄青霉素,NM2009的实验中加最终浓度25mg·L-1的氨苄青霉素和最终浓度10 mg·L-1的氯霉素)中。30℃下振荡培养过夜,次日上午将前夜培养的菌液用新鲜的TGA培养基(1 g NaCl、1 g D-葡萄糖、2 g胰蛋白胨溶于200mL超纯水,高压,放置冷却,加氨苄青霉素至最终浓度为20mg·L-1)稀释100倍,用酶标仪测定595 nm处的吸光度(A595)为0.05 ~0.09 左右,37℃下振荡培养1.5 h 进行前培养。然后,将300μL前培养菌液与10μL浓缩后的水样混合,按需要添加S9溶液,37℃下振荡培养2 h进行浓缩水样暴露。取150μL培养后的菌液测定A595,另取100 μL 菌液与900 μL Z-缓冲液(0.1mol·L-1磷酸缓冲液(pH 7.4)、10mmol·L-1KCl、1mmol·L-1Mg-SO4、1mg·mL-1巯基乙醇),50 μL 1 mg·mL-1SDS 和 50 μL氯仿混合摇匀,再加入200μL的ONPG缓冲溶液(6 mg·mL-1ONPG,0.1 mol·L-1Na2HPO4和 0.1 mol·L-1KH2PO4),30℃下静置20 min进行酶促反应。最后加500 μL的1mol·L-1Na2CO3溶液终止反应,吸取150 μL的上清液于96孔酶标板中,用酶标仪测定415 nm(A415)和570 nm(A570)波长下的吸光度。
最后,β-半乳糖甘酶诱导活性可由下式获得:
β-半乳糖苷酶诱导活性(unit)=1000×(A415-1.75× A570)/(t × V × A595)
式中,t表示酶促反应的时间(min),V表示反应菌液在显色过程中的稀释倍率,A595、A415、A570为吸光度值。A595表示实验开始时的细菌密度,A415表示酶与底物反应生成物邻硝基苯酚的含量,A570表示反应结束产生的颗粒性干扰物。DMSO做溶剂对照,4-NQO和2-AA分别做TA1535/pSK1002和NM2009的阳性对照。β-半乳糖甘酶诱导活性为对照组2倍时则视为阳性。未分割样品采用2倍稀释测试8个梯度3个平行,分割样品采用3倍稀释测试6个梯度3个平行,溶剂空白测试3个平行。
为了评价所富集水样的遗传毒性强度,将样品折算为4-NQO等当量浓度和2-AA等当量浓度来进行评估。根据4-NQO、2-AA和样品的剂量效应曲线,采用以下公式:

其中,k样、k4-NQO、k2-AA分别表示浓缩水样、4-NQO 和2-AA剂量效应曲线中的线性部分的斜率。图2展示了阳性对照物质的低浓度线性部分的剂量效应曲线。
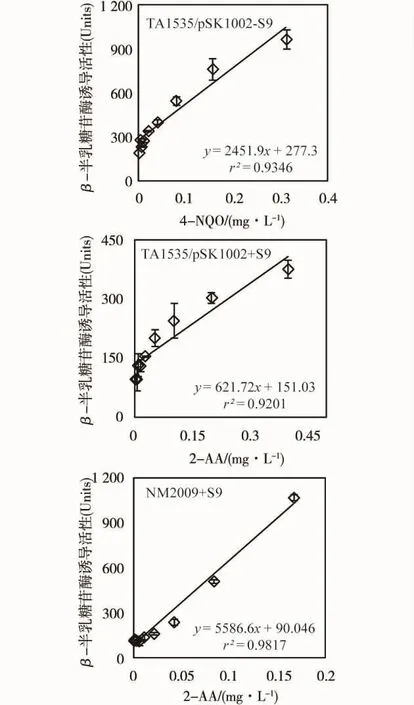
图2 阳性对照物质4NQO和2-AA的剂量效应曲线Fig.2 Dose-response curves of positive controls4-NQO and 2-AA
2 结果与讨论(Results and discussion)
图3所示为采用TA1535/pSK1002菌株(无S9溶液代谢)测定HLB柱富集后的河水样品的剂量效应曲线。可以看到,当暴露量为0.00625~0.2 L时,β-半乳糖苷酶的活性随暴露水样体积的增加而增加,表现出明显的剂量效应关系,表明水样具有遗传效应。但是当暴露量增加到0.4 L之后,随暴露水样的增加,β-半乳糖甘酶诱导活性上升缓慢。实验中观测到,当水样在0.00625~0.2 L范围时,A595值大约为0.277,随后,A595值则随水样的增加而降低,水样为0.8 L 时,A595已降低到 0.205,显示出细胞毒性。考虑到可能是河水中复杂的污染物质影响了菌株活性,因此以后的实验中,对样品进行HPLC分割,测试各馏分的遗传效应。
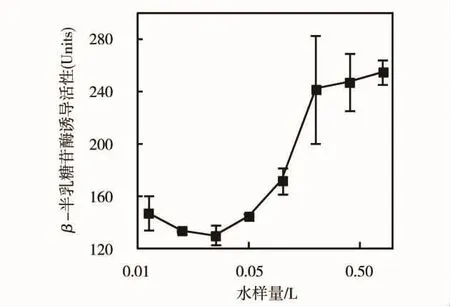
图3 用TA1535/pSK 1002菌株测定的水样遗传毒性的剂量效应曲线
图4所示为河水样品进行HPLC分割后所获得的每个馏分的活性测试结果。从图4可以看出,采用TA1535/pSK1002原始菌株和NM2009菌株进行SOS/umu实验都检测出河水样品分割后的馏分具有遗传毒性效应。TA1535/pSK1002–S9测试时,保留时间为18~20 min的馏分10(F10)表现出遗传毒性,而TA1535/pSK1002+S9测试时,除了F10外,馏分15(F15,保留时间为28~30 min)也表现出遗传毒性,说明河水中存在某些需经过S9溶液代谢活化才能显示出遗传毒性的物质。
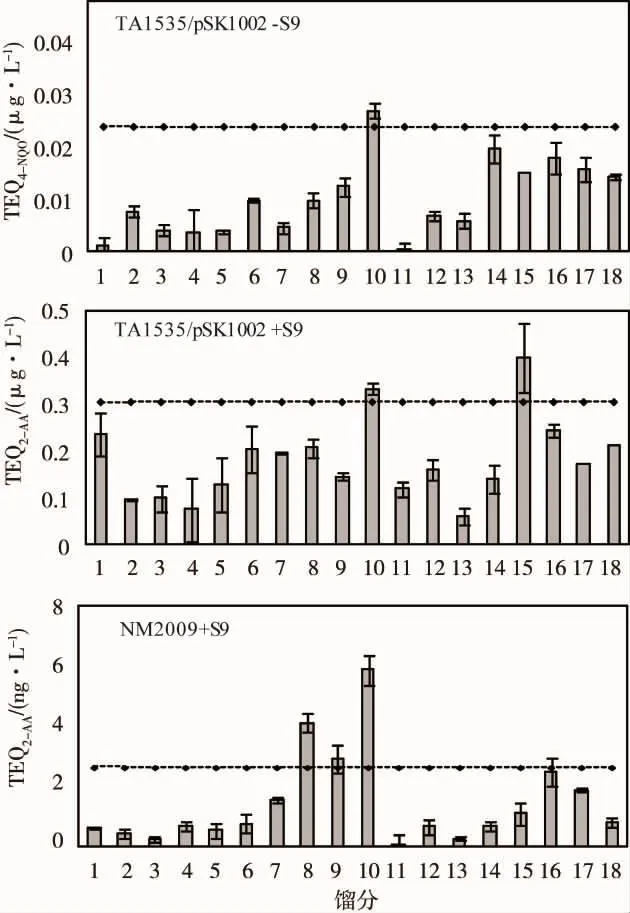
图4 利用菌株TA1535/pSK1002和NM 2009测定河水的遗传毒性
芳香胺和硝基芳烃都可以被S9溶液代谢活化[22-23]。研究表明,在Cyp1A2酶的作用下,芳香胺代谢氧化形成N-羟基胺中间体[24],然后在乙酰转移酶(AT)的作用下,产生“阳氮离子”(R2-N+)攻击DNA引起DNA损伤而癌变。硝基芳烃化合物的作用机理类似,在硝基还原酶和O-AT的作用下形成“阳氮离子”产生遗传毒性[22]。为探讨沙颍河河水中是否含有芳香胺和硝基芳烃类物质,采用对其有特殊响应的NM2009菌株对分割后的水样进行SOS/umu测试。结果表明,F8(保留时间为14~16 min)、F9(保留时间为 16 ~18 min)、F10(保留时间为18~20 min)馏分的遗传毒性测试结果都呈现阳性,但是在TA1535/pSK1002+S9测试中呈阳性结果的F15并没有表现出遗传毒性,这可能是因为NM2009菌株过量表达O-AT,可以对芳香胺类物质和硝基芳烃化合物表现出较强的响应,但是对其他一些遗传毒性物质的灵敏度低于原始菌株。例如使用菌株TA1535/pSK1002时,B[α]P的最低响应浓度为1.25 μmol·L-1,而使用 NM2009 菌株时,B[α]P 在40 μmol·L-1时都没有显现出遗传毒性[25]。为进一步鉴定河水中的遗传毒性物质,本研究进一步比较了F8、F9、F10和F15这4个馏分采用3种方法测试的剂量效应曲线。
图5所示为 F8、F9、F10和 F15采用 TA1535/pSK1002菌株和NM2009菌株测得的剂量效应曲线,纵坐标表示水样β-半乳糖甘酶活性与其溶剂对照的比值。从图中可知,即使水量达到0.4 L,A595值未出现降低,β-半乳糖甘酶活性也呈现出明显上升趋势,这主要是因为通过HPLC样品分割去除了一些共存物质,降低了高浓度暴露的细胞毒性。从图5可知,采用TA1535/pSK1002菌株检测F8和F9时,无论是否加S9代谢,β-半乳糖甘酶活性都随着暴露水量的增加而增加,即使水量增加到0.8 L,其诱导活性也不到阴性对照的2倍,这2个馏分的遗传毒性显示阴性;但是用NM2009检测F8和F9馏分,暴露水量从0.0033 L增加到0.8 L时,F8的β-半乳糖苷酶活性从阴性对照的1.1倍增加到2.7倍,F9从1.16倍增加到2.33倍,表现出了非常显著的剂量效应关系,遗传毒性显示阳性,表明这2个馏分中含有芳香胺类或硝基芳烃类遗传毒性物质。当采用TA1535/pSK1002原始菌株检测F10,不管是否添加S9,都显示出遗传效应,但是NM2009菌株测试时活性远高于原始菌,说明芳香胺类或硝基芳烃类物质是F10的主要遗传毒性物质。至于 F15馏分,TA1535/pSK1002+S9测试时,β-半乳糖甘酶活性呈现很好的剂量效应关系,暴露水量为0.8 L时,β-半乳糖甘酶活性是阴性对照的2倍,呈现阳性,但是用NM2009实验时,β-半乳糖甘酶活性仅达到阴性对照的1.4倍,由此判断F15中的遗传毒性物质不是芳香胺和硝基芳烃类物质,需要进一步鉴定。
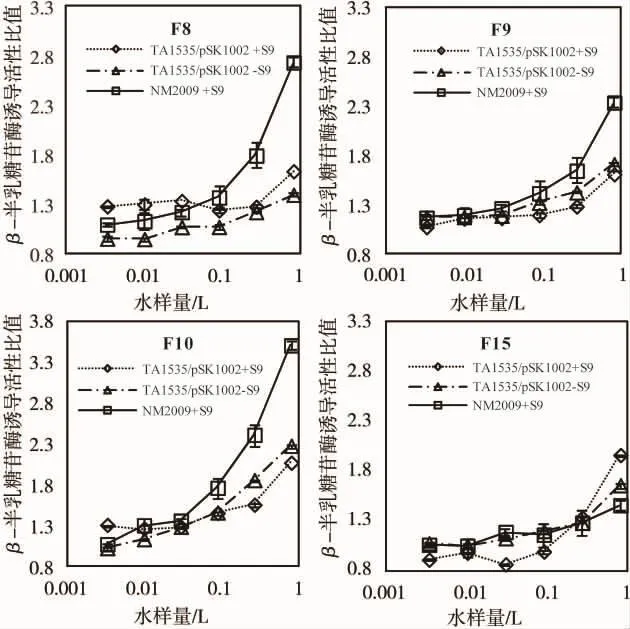
图5 TA1535/pSK1002和NM 2009菌株测定的HPLC分割活性馏分遗传毒性的剂量效应曲线
综上所述,笔者认为,河南沈丘癌症高发区的沙颍河水中含有芳香胺或硝基芳烃类遗传毒性物质,这一信息为该地区水域中的遗传毒性鉴定提供了方法,为当地癌症高发成因解析提供了基础信息。
[1] Ohe T,White P A,DeMarini D M.Mutagenic characteristics of riverwaters flowing through largemetropolitan areas in North America[J].Mutation Research-Genetic Toxicology and Environmental,2003,534(1-2):101-112
[2] Wang D,Xu Z,Zhao Y,et al.Change of genotoxicity for raw and finished water:Role of purification processes[J].Chemosphere,2011,83(1):14-20
[3] Wogan G N,Hecht SS,Felton JS,etal.Environmental and chemical carcinogenesis[J].Seminars in Cancer Biology,2004,14(6):473-486
[4] Siddiqui A H,Ahmad M.The Salmonella mutagenicity of industrial,surface and ground water samples of Aligarh region of India[J].Mutation Research-Genetic Toxicology and Environmental,2003,541(1-2):21-29
[5] Boettcher M,Grund S,Keiter S,et al.Comparison of in vitro and in situ genotoxicity in the Danube River by means of the comet assay and the micronucleus test[J].Mutation Research-Genetic Toxicology and Environmental,2010,700(1-2):11-17
[6] 戴玄吏,王晓栋,黄宏,等.应用分子全息QSAR技术预测硝基芳烃的遗传毒性[J].环境科学学报,2003,23(5):674-678 Dai X L,Wang X D,Huang H,et al.Predicting the genotoxicity of the nitroaromatics by the molecule hologram QSAR[J].Acta Scientiae Circumstantiae,2003,23(5):674-678(in Chinese)
[7] 尹学钧,李永顺,刘君卓,等.1-硝基芘的远期效应[J].国外医学卫生学分册,1990(4):208-212
[8] Weisburger JH.Past,present,and future role of carcinogenic and mutagenic N-substituted aryl compounds in human cancer causation[M]//King C M,Romano J,Schuetzle D.Carcinogenic and Mutagenic Responses to Aromatic Amines and Nitroarenes.New York:Elsevier,1988:3-19
[9] Sugimura T.Successful use of short-term tests for academic purposes:Their use in identification of new environmental carcinogens with possible risk for humans[J].Mutation Research,1988,205(1-4):33-39
[10] Sugimura T.Studies on environmental chemical carcinogenesis in Japan[J].Science,1986,233(4761):312-318
[11] Schulte P A,Ward E,Boeniger M,et al.Occupational exposure to N-substituted aryl compounds[M]//King C M,Romano J,Schuetzle D.Carcinogenic and Mutagenic Responses to Aromatic Amines and Nitroarenes.New York:Elsevier,1988:23-25
[12] Shinka T,Sawada Y,Morimoto S,et al.Clinical study on urothelial tumors of dye workers in Wakayama City[J].Journal of Urology,1991,146(6):1504-1507
[13] Gangadhar C.Human health perspectives on environmental exposure to benzidine:A review [J].Chemosphere,1996,32(2):267-291
[14] Tokiwa H,Sera N,Nakashima A,etal.Mutagenic and carcinogenic significance and the possible induction of lung-cancer by nitro aromatic-hydrocarbons in particulate pollutants [J].Environmental Health Perspectives,1994,102(s4):107-110
[15] 刘兴宇,吴建峰,戴欣,等.微生物降解硝基芳烃化合物的物种多样性及其代谢途径[C]//热带亚热带微生物资源的遗传多样性与基因发掘利用研讨会论文集,三亚市,2005
[16] 闫秀芬.硝基芳烃衍生物结构-毒性定量关系和致毒机理的理论研究[D].南京:南京理工大学,2007:1-2 Yan X L.Theoretical study on the nitroaromatics'QSAR and toxic mechanism[D].Nanjing:Nanjing University of Science and Technology,2007:1-2(in Chinese)
[17] Nohmi T,Watanabe M,Einisto P,et al.Development of new Salmonella typhimurium tester strains highly sensitive to mutagenic nitroarenes and aromatic amines[J].Mutation Research-Genetic Toxicology and Environmental,1991,252(1):99
[18] Oda Y,Yamazaki H,Watanabe M,et al.Development of high sensitive umu test system:Rapid detection of genotoxicity of promutagenic aromatic amines by Salmonella typhimurium strain NM2009 possessing high O-acetyltransferase activity [J]. Mutation Research,1995,334(2):145-156
[19] Watanabe M,Ishidate M,Nohmi T.Sensitive method for the detection ofmutagenic nitroarenes and aromaticamines:New derivatives of Salmonella typhimurium tester strains possessing elevated O-acetyltransferase levels[J].Mutation Research,1990,234(5):337-348
[20] Ohe T.Evaluation of SOS-inducing activity with an O-acetyltransferase-overexpressing strain Salmonella typhimurium NM2009 formunicipal river water and the identification of1-nitropyrene[J].Water Science and Technology,1996,33(6):313-320
[21] 朱舟,顾炜旻,安伟,等.基于umu遗传毒性效应的饮用水致癌风险评价的尝试[J].生态毒理学报,2008,3(4):363-369 Zhu Z,Gu W M,An W,et al.Carcinogen risk assessment of drinking water based on genotoxic activities using SOS/umu test[J].Asian Journal of Ecotoxicology,2008,3(4):363-369(in Chinese)
[22] 钱崇濂.致癌染料——芳香胺的致癌机理[J].整染技术,1996,18(2):30-31 Qian C L.Carcinogenic dyes-carcinogenesis ofaromatic amine[J].Textile Dyeing and Finishing Journal,1996,18(2):30-31(in Chinese)
[23] 钟金汤.偶氮染料及其代谢产物的化学结构与毒性关系的回顾与前瞻[J].环境与职业医学,2004,21(1):58-62 Chung K T.Review of the mutagenicity,carcinogenicity and autoimmunity of azo dyes and theirmetabolites from the perspective of their structure-activity relationships[J].Journal of Environmental& Occupational Medicine,2004,21(1):58-62(in Chinese)
[24] Guengerich F P,Shimada T.Oxidation of toxic and carcinogenic chemicals by human cytochrome P-450 enzymes[J].Chemical Research in Toxicology,1991,4(4):391-407
[25] Oda Y,Funasaka K,Kitano M,et al.Use of a highthroughput umu-microplate test system for rapid detection of genotoxicity produced by mutagenic carcinogens and airborne particulatematter[J].Environmental and Molecular Mutagenesis,2004,43(1):10-19. ◆
