内分泌干扰物的非单一剂量-效应研究进展
2013-08-20楼钦钦田密秦占芬魏无际
楼钦钦,田密,秦占芬,* ,魏无际
1.南京工业大学环境学院,南京210009
2.中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室,北京100085
剂量-效应关系是毒理学研究的核心内容之一。 经典毒理学理论认为,有毒物质在一定剂量下产生毒害作用,其剂量-效应曲线呈单调特征(monotonicity),即随剂量的增加效应呈线性或非线性的增加或降低(图1A-1、A-2和B-1、B-2)。近年来,随着毒理学研究的进展,一些研究显示除单调剂量-效应曲线外,还存在着另外一类可能更为普遍的非单调剂量-效应曲线(non-monotonic dose-response),即在一定的剂量范围内,剂量-效应曲线的斜率可发生正负的转换(图1C-1、C-2和C-3),其中U型和倒U型剂量-效应曲线是最常见的2种非单调剂量-效应曲线形式。在U型剂量-效应曲线中,最大效应发生在高低剂量的两端,随剂量的增加斜率由负值转为正值;倒U型剂量-效应曲线中,最大效应发生在中间剂量随剂量的增加斜率由正值转为负值;有的非单调剂量-效应曲线更为复杂,随剂量的增加斜率发生多次正负的转换。除以上这些类型的剂量-效应曲线外,还存在一种二元型(binary)的剂量-效应曲线,即在一定的阈值下不产生某一效应,当剂量到达阈值后才出现效应,但效应的大小不会随着剂量的增加而增加。虽然毒物兴奋效应(hormesis)也呈现U型或倒U型剂量-效应曲线,但一般认为毒物兴奋效应是机体对压力产生的适应性反应[1],且目前学术界对毒物兴奋效应的认识还存在争议[2-5],所以本文所讨论的非单调剂量-效应不包括毒物兴奋效应。

图1 典型剂量-效应曲线[14]
虽然从20世纪60—70年代就已经有关于非单调剂量-效应的报道[6-7],但在接下来的30多年里,非单调剂量-效应并没得到充分的关注。直到21世纪初,非单调剂量-效应才开始真正得到关注[8]。目前发现大多数激素的生物学效应都呈现非单调剂量-效应关系[9-10],相应的一些内分泌干扰物的活性也被证明具有非单调剂量-效应关系[11-12]。随着非单调剂量-效应研究案例的不断增加,一些科学家也开始致力于非单调剂量-效应机制的探索[13]。目前,细胞毒性、细胞和组织特异性的受体和共因子、受体选择性、受体下调和脱敏、受体竞争、内分泌负反馈等机制可一定程度上解释非单调剂量-效应关系[14]。非单调剂量-效应向以线性阈值剂量-效应模型为基础的传统毒理学理论以及现有的管理毒理学框架提出了挑战。
本文就内分泌干扰物的非单调剂量-效应研究进展做一综述,涉及典型的非单调剂量-效应研究案例、可能的机制以及给管理毒理学中的化学品风险评价带来的挑战3方面内容。
1 内分泌干扰物的非单一剂量-效应典型案例
激素对脊椎动物的生长发育以及生殖、神经、免疫等各系统结构和功能的维持起重要作用。目前已知雌激素、雄激素、孕激素、甲状腺激素等多种激素的生物学效应具有非单调剂量-效应特征。同样,一些具有类激素活性或干扰激素合成、代谢、转运等过程的内分泌干扰物也具有非单调剂量-效应。下面就报道比较多的激素和内分泌干扰物的非单调剂量-效应的案例做一介绍。
1.1 激素的非单调剂量-效应案例
激素通过与细胞核、细胞质和细胞膜上的受体结合而发挥生物学效应。以雌激素为例,最早的认识是雌激素与细胞核内雌激素受体(ER)结合为复合体,复合体与雌激素靶基因上的受体反应元件(ERE)结合,从而诱导靶基因的表达,产生相应的生物学效应[15]。最近,激素的非基因活性理论也得到认可,即激素可通过细胞膜上受体而引发快速的作用模式产生生物学效应[16]。目前有越来越多的证据显示激素对其靶细胞和靶组织的作用具有非单调剂量-效应特征。
雌激素与乳腺的生长发育有着密切的关系,Vandenberg等[17]报道雌激素在5 μg·kg-1·d-1以下的剂量可促进乳腺导管的延伸和末端形成,而在高剂量(5~50μg·kg-1·d-1)下抑制乳腺小管的延伸和末端形成。另外,雌激素也是乳腺癌发生的危险因素之一,早期研究显示雌激素明显诱导ER阳性的乳腺癌细胞MCF-7的增殖[18]。然而,进一步的研究证明,雌激素在低剂量(10-14~10-11mol·L-1)条件下促进MCF-7细胞增殖,在此剂量范围内呈现单一的线性剂量-效应关系;随着剂量的继续增加(10-11~10-6mol·L-1),雌激素的增殖效应不再发生变化;但当剂量增加到10-6mol·L-1以上时,雌激素转而抑制细胞增殖(图 2)[9]。同样,雄激素在低剂量时促进前列腺癌细胞增殖,而高剂量抑制细胞增殖,总体呈现倒U型剂量-效应曲线[19]。子宫也是雌激素作用的一个靶器官,低剂量的雌激素暴露可促进子宫增重,但当剂量增加到1mg·kg-1·d-1时,子宫增重趋势会下降,呈现倒U型剂量效应曲线[20]。孕期低剂量的雌激素处理可促进鼠前列腺增生,而高剂量处理可抑制前列腺增生[21]。
瘦素(leptin)是参与糖代谢的一种激素,文献显示在不同生物学水平瘦素都可表现出非单调剂量-效应。如Zhang等[22]报道,中等剂量的瘦素会减少体外培养的脂肪细胞中胰岛素介导的糖吸收,而高剂量和低剂量的瘦素能够促进胰岛素介导的糖吸收。在组织水平,瘦素对离体胰岛分泌胰岛素的效应影响呈倒 U性剂量-效应关系[23-24]。同样,在个体水平瘦素也具有非单调剂量-效应特征,比如中等剂量的瘦素暴露可降低大鼠的食物吸收,而低剂量和高剂量的瘦素却增加食物吸收[25]。以上这些证据显示非单调剂量-效应是激素生物学效应的普遍特征。
1.2 激素相关药物的非单一剂量-效应案例
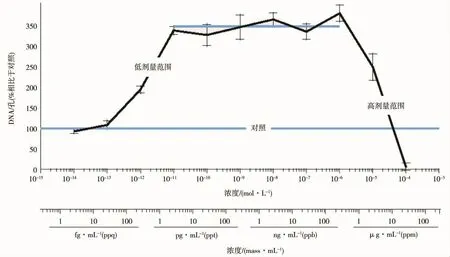
图2 MCF-7乳腺癌细胞的增殖实验[9]
激素类药物是最早被关注的内分泌干扰物之一,如己烯雌酚、苯甲酸雌二醇、乙炔雌二醇、甲地孕酮等,它们通过模拟生理激素的作用达到治疗的目的。三苯氧胺等药物因为可通过与激素受体的作用而干扰生理激素的功能,也成为一类典型的内分泌干扰物。还有些药物如甲巯咪唑,可通过影响生理激素的合成、代谢来调节体内激素的平衡以达到治疗的目的。这些激素相关的药物因为最终都要通过激素和受体的作用而产生效应,所以理论上,它们的内分泌干扰作用与生理激素类似,也具有非单调剂量-效应特征。目前有越来越多的研究结果证明确实如此。
己烯雌酚(DES)人工合成的非甾体雌激素类药物,能产生与天然雌二醇相同的作用,主要用于雌激素低下症、晚期乳腺癌的治疗。因为能够模拟生理雌激素的作用,己烯雌酚对乳腺、子宫、阴道等雌激素的靶器官有明显的干扰作用,有些报道显示这些干扰作用具有非单调剂量-效应特征。如 Shelby等[20]报道 DES 暴露未成年小鼠,10 μg·kg-1·d-1以下的剂量范围内,随剂量的增加促进子宫增重的效应增加,而当剂量增加到100 μg·kg-1·d-1时,子宫增重的效应明显降低,整个剂量-效应呈现倒U型曲线。与此相似,Newbold等[26]的结果也显示,低剂量的DES促进子宫发育相关的指标,而高剂量的DES抑制子宫发育相关的指标。另外,DES对实验动物体质量、性别比、肛门-生殖器间距离、乳腺发育的影响也具有非单调剂量-效应关系[27-29]。
三苯氧胺是一种雌激素受体拮抗剂,最早用于晚期乳腺癌的治疗,但其对乳腺癌的抑制作用严格依赖于在血液中浓度,一般认为,0.1~10μmol·L-1是有效的。但病人用药开始的2周里,血液中三苯氧胺低于这个浓度,此时病人乳腺细胞的增殖非但不会被抑制反而会进一步增生;如果继续用药,血液中三苯氧胺升高到有效的浓度时,才会抑制乳腺癌的发展;当浓度继续增加到10μmol·L-1以上,三苯氧胺将出现急性毒性(图3)[14]。体外细胞研究也显示,高剂量三苯氧胺抑制乳腺癌细胞生长,而低剂量促进乳腺癌细胞生长[30-31]。乳腺癌移植裸鼠模型研究同样显示,高剂量三苯氧胺抑制乳腺癌的发展,而低剂量促进乳腺癌的发展[32]。这些研究很好地证明了激素相关药物的内分泌干扰作用具有非单调剂量-效应特征。
1.3 植物雌激素的非单一剂量-效应案例
一般认为植物雌激素是植物中具有弱雌激素/抗雌激素作用的化合物。这些化合物通过与ER以低亲和度结合而发挥雌激素或抗雌激素的作用。目前有些植物雌激素被证明也可通过影响激素的合成代谢调节激素水平的平衡[33]。植物雌激素主要包括异黄酮、木酚素和香豆素3类。目前已知,虽然植物雌激素可导致某些动物不孕或雌性化[34],但对人还没有此类不良影响,相反植物雌激素对乳腺癌、前列腺癌、心脑血管疾病、骨质疏松、绝经综合症等与雌激素相关的疾病有预防和治疗作用[35-37]。在乳腺癌、前列腺癌等雌激素相关癌症的防治方面,植物雌激素表现出的主要是抗雌激素作用;而在骨质疏松、绝经综合症等疾病的防治方面,植物雌激素表现出的主要是雌激素作用[38]。研究显示,植物雌激素表现雌激素活性还是抗雌激素活性是与剂量相关的。

图3 三苯氧胺在乳腺癌治疗中的剂量-效应[14]Fig.3 Dose-response ranges for tamoxifen in breast cancer therapy[14]
染料木黄酮是异黄酮类植物雌激素,在不同剂量下可表现相反的效应。如Miodini等[39]曾研究染料木黄酮在0.5~20μmol·L-1对 MCF-7细胞增殖的剂量-效应关系,发现在1μmol·L-1时有最大促进值,当浓度大于5μmol·L-1时则抑制了细胞增殖。进一步研究发现,染料木黄酮在1和5μmol·L-1时抑制了ER介导的细胞生长,但却促进了2种雌激素调节基因pS2和Cathepsin-D基因的转录。这些结果显示,染料木黄酮既可表现出雌激素作用又可表现出抗雌激素作用,具体表现出什么作用取决浓度,另外与检测的终点指标也相关。因此在一定剂量范围内,染料木黄酮表现出非单调剂量-效应曲线[40-41]。
除染料木黄酮外,研究结果显示玉米赤霉醇、柚皮素、鸡豆黄素、香豆素、槲皮素等植物雌激素都可表现出非单调剂量-效应曲线[42-45],并且非单调剂量-效应关系可能是植物雌激素的普遍特征。
1.4 农药类内分泌干扰物的非单一剂量-效应案例
目前为止,很多农药被证明具有内分干扰作用,如滴滴涕/滴滴伊(DDT/DDE)、阿特拉津、西玛津、毒死蜱、甲氧氯、乙稀菌核利、马拉硫磷等等。农药已经成为内分泌干扰物中不可被忽视的一类。而且,这些农药类内分泌干扰物中的大部分已被证明具有非单一剂量-效应关系。如Wozniak等[46]报道DDE 在10-12~10-8mol·L-1的剂量范围内,诱导垂体瘤细胞分泌催乳素的效应呈倒U型曲线,另一种农药硫丹也表现出相似的剂量-效应曲线。Ohlsson等[47]研究了咪唑类抗真菌剂咪酰胺对肾上腺皮质瘤细胞H295R激素分泌的影响,结果发现在0.01~10μmol·L-1的浓度范围内,除皮质醇的分泌随浓度升高而下降外,醛固酮、皮质酮、孕酮、17α-羟基-孕酮的分泌随剂量的变化而呈现倒U型曲线。在动物实验中,目前积累的农药类内分泌干扰物的非单调剂量-效应的案例也很多。
阿特拉津是一种倍受争议的内分泌干扰物,以它对两栖动物变态的影响为例,一些研究显示对变态发育没有影响[48-49],而另外一些结果显示对变态有影响[50-52],在这些有影响的结果中,有的显示抑制作用[52],有的显示促进作用[51]。另外,也有研究显示阿特拉津对两栖动物变态的影响可能是非单调剂量-效应,如 Larson 等[53]报道75 μg·L-1的阿特拉津处理抑制虎皮蝾螈变态,而250μg·L-1时却促进变态。Brodeur等[54]报道阿特拉津在1 mg·L-1时促进南美蟾蜍变态,而5 mg·L-1时抑制变态,其他剂量时效应不明显。最近Rohr等[55]用变态分析的方法对文献中阿特拉津对两栖动物变态影响的结果进行了分析,结果认为阿特拉津可以影响两栖动物变态,根据剂量的不同,既可表现为促进作用也可变现为抑制作用,也就是说阿特拉津对两栖动物变态的影响具有的非单调剂量-效应关系。以上阿特拉津的研究证明了农药类内分泌干扰物剂量-效应关系的复杂性。
1.5 工业化学品类内分泌干扰物的非单一剂量-效应案例
大量研究显示双酚A、壬基酚、酞酸酯、多氯联苯(PCBs)、多溴二苯醚(PBDEs)等工业生产或生活中广泛应用的一些化学品具有内分泌干扰作用,而其中一些内分泌干扰作用表现为非单调剂量-效应关系。
双酚A是最早被关注也是目前研究最多的一种内分泌干扰物,它的内分泌干扰作用涉及生殖内分泌、甲状腺以及相关的神经发育等多个系统[56-57]。这些内分泌干扰作用都不同程度上表现出非单调剂量-效应。如Markey等[58]报道,高剂量(100 mg·kg-1·d-1)和低剂量(0.1 mg·kg-1·d-1)的双酚A处理都能导致小鼠阴道开放,而中间剂量(0.5~75 mg·kg-1·d-1)双酚A不影响鼠的阴道开放。与此一致,Cabaton 等[59]报道高剂量(25 μg·kg-1·d-1)和低剂量(25 ng·kg-1·d-1)的双酚A降低雌鼠的生殖能力,而中间剂量250 ng·kg-1·d-1对雌鼠的生殖能力没有明显影响。Jones等[60]的报道则相反,双酚A对雄性鼠性行为的影响仅发生在中间剂量(50μg·kg-1·d-1),而高剂量和低剂量的双酚A处理没有效应。最近这个研究组又报道,双酚A对鼠神经行为的影响也呈非单调剂量-效应特征[61]。
PCBs是另外一种被研究较多的内分泌干扰物,其内分泌干扰作用的非单调剂量效应关系也在很多研究中得到证明。如Muto等[62]报道二甲基苯蒽诱导大鼠乳腺癌模型中,以250 ng·kg-1的剂量注射PCB126可明显促进乳腺癌的发生,而高剂量(7.5 μg·kg-1)处理明显抑制乳腺癌的发生。进一步的在分子水平上的研究也证明了PCB126对乳腺癌发生的非单调剂量-效应关系[62-64]。值得注意的是,PCBs内分泌干扰作用的非单调剂量-效应关系不仅在动物实验中得到证明,一些流行病学的数据也支持PCBs对人体健康作用也存在非单调的剂量-效应关系。如Lee等[65-66]发现一些高氯代PCB同类物与糖尿病具有非线性的剂量-效应相关性。有报道显示,一些PCB同类物与DNA甲基化也有类似的相关性[67]。
除双酚A和PCBs外,壬基酚、辛基酚、酞酸酯和三氯生等很多内分泌干扰物都被证实具有非单调剂量-效应关系,越来越多的证据显示内分泌干扰物的非单调剂量-效应具有普遍性。
2 内分泌干扰物的非单调剂量-效应关系机制
随着内分泌干扰物非单调剂量-效应研究案例的不断增加,这一与经典的线性剂量-效应关系不一致的剂量-效应曲线已逐渐被接受,并认为非单调剂量-效应关系可能是内分泌干扰效应更为普遍的剂量-效应关系。因此,一些科学家开始致力于内分泌干扰物非单调剂量-效应关系机制的研究。
2.1 细胞毒性
一些环境物质的内分泌干扰活性是基于体外细胞实验获得的,如评价雌激素活性的乳腺癌MCF-7(或TD47)细胞增殖实验、评价雄激素活性的前列腺癌LNCaP-FGC细胞增殖实验等。在这些体外细胞实验中,一些内分泌干扰活性表现出的非单调剂量-效应关系可部分地用细胞毒性解释,即低剂量下表现出的对细胞增殖的促进作用是激素受体介导的作用,是真正的内分泌干扰活性的表现;而高剂量时表现的对细胞的抑制作用则是细胞毒性的结果,与内分泌干扰活性无关。但在整个测试剂量范围内,内分泌干扰物对细胞增殖的影响整体上呈现倒U型剂量-效应曲线。如Welshons等[9]报道的雌激素在10-14~10-11mol·L-1时促进 MCF-7细胞增殖,剂量-效应呈单一线性关系;随着剂量增加到10-11~10-6mol·L-1时,雌激素的增殖效应不再变化;当剂量增加到10-6mol·L-1以上,雌激素转而抑制细胞增殖。
细胞毒性除部分地解释一些细胞实验中的非单调剂量-效应关系外,可能还能够在一定程度上外推到一些体内实验中,即高剂量的抑制结果是急性毒性的反映,而不是内分泌干扰效应。这一推测还需要进一步验证。
2.2 两个(或以上)相反单调效应的叠加
某些非单调剂量-效应曲线可能是两个(或以上)相反的单调效应共同作用的结果。如有研究显示,某些激素对细胞增殖的非单调剂量-效应曲线是因为细胞中存在对激素具有不同响应的两种类型的细胞,一种细胞表现为接受激素而增殖,而另一种细胞表现为接受激素而凋亡,两种效应叠加而出现非单调剂量-效应曲线[68]。如体外培养的乳腺癌MCF-7细胞中有一类细胞可接受雌激素的诱导而增殖,另外一类细胞可在雌激素的作用下凋亡[69]。于是,在一定剂量范围内,两种效应叠加时可能出现非单调剂量-效应曲线。
2.3 受体多样性和选择性
细胞或组织中通常存在与配体亲和能力不同的两种或更多的受体亚型,而不同的受体亚型介导的效应通常相反[70-71]。低浓度时具有高亲和力的受体亚型发挥作用,高浓度时低亲和力的受体亚型发挥作用,并且这时低亲和力受体的高容量将变得相当重要。当在一个较宽的剂量范围内评价内分泌干扰物活性时,就会出现典型的非单一剂量-效应。以子宫组织中ER为例,ERα介导细胞增殖反应,而ERβ介导细胞凋亡[72]。由于内分泌干扰物与这两种ER的结合能力存在差异,所以由两种受体介导的相反的单调效应共同作用而产生非单调剂量-效应。
另外,一些内分泌干扰物可以与多种激素受体结合,但是与各种受体的亲和力存在差异,所以在不同剂量下会表现为与受体的选择性结合。比如双酚A,与ER的亲和力最强,在低剂量时只能和ER结合;但在高剂量时,双酚 A也能与 AR、TR等受体结合[73-74]。也就是说,一些内分泌干扰物在高剂量时表现出的某一活性可能是由多种受体介导的,而在低剂量下的活性可能是由一种受体介导的。因此,在比较宽泛的剂量范围内,内分泌干扰物对某一终点指标的影响可能呈现复杂的非单调剂量-效应关系。
2.4 受体竞争
有观点认为,内分泌干扰物在非单一剂量-效应中,高剂量效应和低剂量效应形成的机制是不同的[9]。低剂量时,内分泌干扰物对机体的扰动处于激素的调控活性范围之内,剂量上升能够通过正常的受体介导途径使得效应增加。当内分泌干扰物浓度远大于生理激素浓度时,受体结合出现饱和,较大的剂量改变仅能引起较小的生物学效应的变化或不能引起生物学效应的变化。而数学模型显示,当有内源性激素存在时,内分泌干扰物可与非占位的激素受体结合,导致生物学效应的增加[75]。在低剂量时,内分泌干扰物和内源性激素都能和激素受体结合而激发生物学效应;而在高剂量时,内分泌干扰物与受体的结合超过内源性激素与受体的结合。因为内分泌干扰物的活性低于生理激素的活性,所以当内分泌干扰物的剂量升高时,总体的效应会下降,因而呈现倒U型剂量-效应曲线。
2.5 受体下调和受体脱敏
激素配体与受体的结合最终导致靶基因转录的变化,之后受体通过某些途径降解或脱敏,从而调节生物学效应的变化[74,76]。在一些受体降解过程中,激素配体本身起重要作用。如雌激素、孕激素和糖皮质激素介导相应受体的降解,而雄激素的结合阻止雄激素受体的降解[77-78],另外,一些激素受体的降解依赖于其他激素配体的参与[79]。也就是说,随激素或内分泌干扰物剂量的变化,其生物学的效应也在发生变化,反过来又影响激素受体数量的变化。脱敏是另外一条调节激素配体与受体结合导致生物学效应的途径,即不是通过受体降解减少受体数目而是通过减小受体对激素配体的反应性来调节生物学效应。目前有研究发现,人绒毛膜促性腺激素、促卵泡激素、前列腺素等激素的受体都存在脱敏的现象[80]。生物学的研究显示,激素浓度与结合受体的数目之间、结合受体的数目与生物学效应之间的关系呈非线性关系[9]。所以,受体下调和脱敏可能部分参与了某些内分泌干扰物的非单调剂量-效应。
2.6 其他机制
以上仅是几种导致内分泌干扰物非单调剂量-效应可能的机制。由于内分泌系统及其调节的复杂性,可能还存在其他的导致非单调剂量-效应的机制。如激素的反馈调节,很多激素的合成分泌受一系列的正负反馈调节,通过这些调节激素被控制在一个相对稳定的水平。在反馈调节的过程中,可能会出现不同时间内的生物学效应,因此出现非单调剂量-效应曲线。
总之,内分泌干扰物的非单调-剂量效应是普遍的现象,导致这一复杂的剂量-效应曲线的机制还需进一步探索。
3 非单调剂量-效应对传统管理毒理学的挑战
在传统管理毒理学中,所谓化学品的安全剂量是基于线性阈值剂量-效应曲线获得的,即毒性实验从高剂量做起,获得最低可观察效应剂量(LOAEL)和无可观察效应剂量(NOAEL),NOAEL除以一个安全系数(3~1000),即为安全剂量(参考剂量)。但目前存在的化学品的安全剂量是否真的安全,很少有实验验证过。与目前发现的内分泌干扰物的非单调剂量-效应曲线比较来看,这种基于线性阈值剂量-效应曲线获得的安全剂量存在很大问题(图4),在所谓的安全剂量下会漏掉潜在的风险。另外,有观点认为从内分泌干扰效应是相对体内稳定的内分泌系统而言,即使很低剂量的内分泌干扰物也能对生理的内分泌系统产生干扰作用,所以内分泌干扰物像致癌物一样不存在安全阈值[81-82]。因此,内分泌干扰物的非单调剂量-效应对传统的管理毒理学提出了空前的挑战。
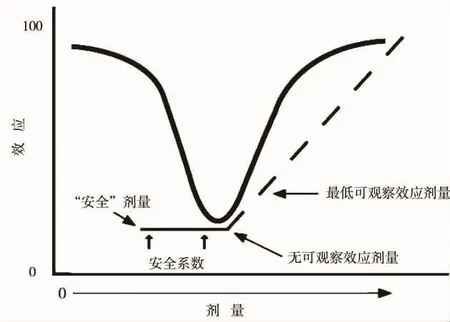
图4 非单调剂量-效应曲线和作为计算安全剂量理论基础的线性剂量-效应曲线[14]Fig.4 Non-monotonic dose-response curve and linear dose-response curve as the theoretical base for calculating the safe dose[14]
为应对非单调剂量-效应关系的挑战,一种观点认为今后的内分泌干扰研究应设计包含环境相关剂量在内的更为宽泛的剂量范围,探索更为精细的终点评价指标,选择更为合理的暴露时间和检查终点指标的时间,而直接揭示相对低剂量下的内分泌干扰效应,而不是从高剂量的结果推导低剂量的效应[14,83]。尽管这种观点的呼声很高,但目前包括内分泌干扰在内的毒理学研究仍以高剂量为主,因为一般认为低剂量暴露不容易产生明显的毒理学效应。另一种观点认为,尽管在比较宽泛的剂量范围内存在非单调剂量-效应关系,但不能否定高剂量在毒理学研究中的作用,建立在科学基础上的由高剂量到低剂量的外推是必要的[13]。Conolly 和 Lutz[13]主张结合系统生物学研究的成果,探索新的适合于非单调剂量-效应关系的外推模型。
尽管有关内分泌干扰物非单调剂量-效应关系的报道越来越多,非单调剂量-效应关系也引起学术界的关注,但与线性的剂量-效应研究相比,目前对非单调剂量-效应的认识还很肤浅。所以,无论是从优化实验设计直接揭示从低剂量到高剂量的非单调剂量-效应的角度,还是从建立由高剂量到低剂量的新的外推模型的角度,开展非单调剂量-效应这一崭新领域的研究都是必要的。
[1] Calabrese E J,Baldwin L A.Defining hormesis[J].Human& Experimental Toxicology,2002,21(2):91-97
[2] Calabrese E J,Baldwin L A,Kostecki P T,et al.A toxicologically based weight-of-evidencemethodology for the relative ranking of chemicals of endocrine disruption potential[J].Regulatory Toxicology and Pharmacology,1997,26(1):36-40
[3] Calabrese E J,Baldwin L A.Hormesis as a biological hypothesis [J].Environmental Health Perspectives,1998,106(1):357-362
[4] Mushak P.Hormesis and its place in nonmonotonic dose-response relationships:Some scientific reality checks[J].Environmental Health Perspectives,2007,115(4):500-506
[5] Kendig E L,Le H H,Belcher SM.Defining hormesis:Evaluation of a complex concentration response phenomenon[J].International Journal of Toxicology,2010,29(3):235-246
[6] Young E D,Brownell W E.Responses to tones and noise of single cells in dorsal cochlear nucleus of unanesthetized cats [J].Journal of Neurophysiology,1976,39(2):282-300
[7] Bliznakov EG.Immunostimulation or immunodepression[J].Biomedicine,1977,26(2):73-76
[8] Melnick R,Lucier G,Wolfe M,et al.Summary of the National Toxicology Program's report of the endocrine disruptors low-dose peer review [J].Environmental Health Perspectives,2002,110(4):427-431
[9] Welshons W V,Thayer K A,Judy B M,et al.Large effects from small exposures.I.Mechanisms for endocrine-disrupting chemicals with estrogenic activity [J].Environmental Health Perspectives,2003,111(8):994-1006
[10] Fallah N,Mohammad K,Nourijelyani K,etal.Nonlinear association between serum testosterone levels and coronary artery disease in Iranian men[J].European Journal of Epidemiology,2009,24(6):297-306
[11] Endo F,Monsees TK,Akaza H,etal.Effects of single non-ortho,mono-ortho,and di-ortho chlorinated biphenyls on cell functions and proliferation of the human prostatic carcinoma cell line,LNCaP [J].Reproductive Toxicology,2003,17(2):229-236
[12] Jenkins S,Wang J,Eltoum I,et al.Chronic oral exposure to bisphenol A results in a nonmonotonic dose response in mammary carcinogenesis and metastasis in MMTV-erbB2 mice[J].Environmental Health Perspectives,2011,119(11):1604-1609
[13] Conolly R B,Lutz W K.Nonmonotonic dose-response relationships:Mechanistic basis,kinetic modeling,and implications for risk assessment[J].Toxicological Sciences,2004,77(1):151-157
[14] Vandenberg L N,Colborn T,Hayes T B,et al.Hormones and endocrine-disrupting chemicals:Low-dose effects and nonmonotonic dose responses[J].Endocrine Reviews,2012,33(3):378
[15] Brown M,Sharp P A.Human estrogen receptor forms multiple protein-DNA complexes[J].The Journal of Biological Chemistry,1990,265(19):11238-11243
[16] Watson C S,Alyea R A,Jeng Y J,et al.Nongenomic actions of low concentration estrogens and xenoestrogens on multiple tissues[J].Molecular and Cellular Endocrinology,2007,274(1-2):1-7
[17] Vandenberg L N,Wadia P R,Schaeberle C M,et al.Themammary gland response to estradiol:Monotonic at the cellular level,non-monotonic at the tissue-level of organization?[J].Journal of Steroid Biochemistry and Molecular Biology,2006,101(4-5):263-274
[18] Soto A M,Sonnenschein C,Chung K L,et al.The EScreen assay as a tool to identify estrogens—An update on estrogenic environmental-pollutants[J].Environmental Health Perspectives,1995,103(s7):113-122
[19] Geck P,Szelei J,Jimenez J,et al.Expression of novel genes linked to the androgen-induced,proliferative shutoff in prostate cancer cells[J].Journal of Steroid Biochemistry and Molecular Biology,1997,63(4-6):211-218
[20] Shelby M D,Newbold R R,Tully D B,etal.Assessing environmental chemicals for estrogenicity using a combination of in vitro and in vivo assays[J].Environmental Health Perspectives,1996,104(12):1296-1300
[21] vomSaal F S,Timms B G,Montano M M,et al.Prostate enlargement inmice due to fetal exposure to low doses of estradiol or diethylstilbestrol and opposite effects at high doses[J].Proceedings of the National Academy of Sciences,1997,94(5):2056-2061
[22] Zhang H H,Kumar S,Barnett A H,et al.Intrinsic site-specific differences in the expression of leptin in human adipocytes and its autocrine effects on glucose uptake[J].Journal of Clinical Endocrinology& Metabolism,1999,84(7):2550-2556
[23] Pallett A L,Morton N M,Cawthorne M A,etal.Leptin inhibits insulin secretion and reduces insulinmRNA levels in rat isolated pancreatic islets[J].Biochemical and Biophysical Research Communications,1997,238(1):267-270
[24] Haddad N,Howland R,Baroody G,etal.Themodulatory effect of leptin on the overall insulin production in ex-vivo normal rat pancreas[J].Canadian Journal of Physiology and Pharmacology,2006,84(2):157-162
[25] Thorburn AW,Holdsworth A,Proietto J,etal.Differential and genetically separable associations of leptin with obesity-related traits[J].International Journal of Obesity,2000,24(6):742-750
[26] Newbold R R,Jefferson W N,Padilla-Banks E,et al.Developmental exposure to diethylstilbestrol(DES)alters uterine response to estrogens in prepubescentmice:Low versus high dose effects[J].Reproductive Toxicology,2004,18(3):399-406
[27] Palanza P,Parmigiani S,vom Saal F S.Effects of prenatal exposure to low doses of diethylstilbestrol,o,p'DDT,and methoxychlor on postnatal growth and neurobehavioral development inmale and femalemice[J].Hormones and Behavior,2001,40(2):252-265
[28] Utsuyama M,Kanno J,Inoue T,et al.Age/sex dependent and non-monotonous dose-response effect of diethylstilbestrol on the immune functions in mice[J].Toxicology Letters,2002,135(1-2):145-153
[29] Kohlerova E,Skarda J.Mouse bioassay to assess oestrogenic and anti-oestrogenic compounds:Hydroxytamoxifen,diethylstilbestrol and genistein [J].Journal of Veterinary Medicine Series A-Physiology Pathology Clinical Medicine,2004,51(5):209-217
[30] Reddel R R,Sutherland R L.Tamoxifen stimulation of human breast cancer cell proliferation in vitro:A possible model for tamoxifen tumour flare[J].European Journal of Cancer& Clinical Oncology,1984,20(11):1419-1424
[31] Berthois Y,Pons M,Dussert C,et al.Agonist-antagonistactivity of anti-estrogens in the human breast cancer cell line MCF-7:An hypothesis for the interaction with a site distinct from the estrogen binding site[J].Molecular and Cellular Endocrinology,1994,99(2):259-268
[32] Osborne C K,Hobbs K,Clark GM.Effectof estrogens and antiestrogens on growth of human-breast cancer-cells in athymic nude-mice[J].Cancer Research,1985,45(2):584-590
[33] Lacey M,Bohday J,Fonseka SM,etal.Dose-response effects of phytoestrogens on the activity and expression of 3beta-hydroxysteroid dehydrogenase and aromatase in human granulosa-luteal cells[J].The Journal of Steroid Biochemistry and Molecular Biology,2005,96(3-4):279-286
[34] 从琳,秦占芬,周景明,等.植物雌激素对动物和人体健康的影响[J].环境与健康杂志,2006,23(2):176-178 Cong L,Qin Z F,Zhou JM,et al.Effects of phytoestrogens on the health of human and animals[J].Journal of Environment and Health,2006,23(2):176-178(in Chinese)
[35] Ganry O.Phytoestrogen and breast cancer prevention[J].European Journal of Cancer Prevention,2002,11(6):519-522
[36] Altavilla D,Crisafulli A,MariniH,etal.Cardiovascular effects of the phytoestrogen genistein[J].Current Medicinal Chemistry-Cardiovascular&Hematological Agents,2004,2(2):179-186
[37] Szkutnik-Fiedler D,Jedrzejczyk M,Grzeskowiak E,et al.The role of phytoestrogen therapy in relieving postmenopausal symptoms[J].Ginekologia Polska,2010,81(12):929-934
[38] Bingham SA,Atkinson C,Liggins J,et al.Phyto-oestrogens:Where are we now?[J].British Journal of Nutrition,1998,79(5):393-406
[39] Miodini P,Fioravanti L,Di Fronzo G,et al.The two phyto-oestrogens genistein and quercetin exert different effects on oestrogen receptor function[J].British Journal of Cancer,1999,80(8):1150-1155
[40] Chen A C,Donovan SM.Genistein at a concentration present in soy infant formula inhibits Caco-2BBe cell proliferation by causing G2/M cell cycle arrest[J].Journal of Nutrition,2004,134(6):1303-1308
[41] El Touny L H,Banerjee P P.Identification of a biphasic role for genistein in the regulation of prostate cancer growth andmetastasis[J].Cancer Research,2009,69(8):3695-3703
[42] Collins B M,McLachlan J A,Arnold S F.The estrogenic and antiestrogenic activities of phytochemicalswith human estrogen receptor expressed in yeast[J].Steroids,1997,62(4):365-372
[43] Almstrup K,Fernandez M F,Petersen JH,et al.Dual effects of phytoestrogens result in u-shaped dose-response curves[J].Environmental Health Perspectives,2002,110(8):743-748
[44] Yuri T,Tsukamoto R,Miki K,etal.Biphasic effects of zeranol on the growth of estrogen receptor-positive human breast carcinoma cells [J].Oncology Reports,2006,16(6):1307-1312
[45] Liu M,Yanagihara N,Toyohira Y,et al.Dual effects of daidzein,a soy isoflavone,on catecholamine synthesis and secretion in cultured bovine adrenal medullary cells[J].Endocrinology,2007,148(11):5348-5354
[46] Wozniak A L,Bulayeva N N,Watson C S.Xenoestrogens at picomolar to nanomolar concentrations trigger membrane estrogen receptor-alpha-mediated Ca2+fluxes and prolactin release in GH3/B6 pituitary tumor cells[J].Environmental Health Perspectives,2005,113(4):431-439
[47] Ohlsson A,Ulleras E,Oskarsson A.A biphasic effectof the fungicide prochloraz on aldosterone,but not cortisol,secretion in human adrenal H295R cells—Underlyingmechanisms[J].Toxicology Letters,2009,191(2-3):174-180
[48] Du Y,Shi X,Liu C,et al.Chronic effects of waterborne PFOSexposure on growth,survival and hepatotoxicity in zebrafish:A partial life-cycle test[J].Chemosphere,2009,74(5):723-729
[49] Oka T,Tooi O,Mitsui N,et al.Effect of atrazine on metamorphosis and sexual differentiation in Xenopus laevis[J].Aquatic Toxicology,2008,87(4):215-226
[50] Freeman J L,Rayburn A L.Developmental impact of atrazine on metamorphing Xenopus laevis as revealed by nuclear analysis and morphology[J].Environmental Toxicology and Chemistry,2005,24(7):1648-1653
[51] Forson D,Storfer A.Effects of atrazine and iridovirus infection on survival and life-history traits of the long-toed salamander(Ambystoma macrodactylum)[J].Environmental Toxicology and Chemistry,2006,25(1):168-173
[52] Langlois V S,Carew A C,Pauli B D,et al.Low levels of the herbicide atrazine alter sex ratios and reducemetamorphic success in Rana pipiens tadpoles raised in outdoor mesocosms[J].Environmental Health Perspectives,2010,118(4):552-557
[53] Larson D L,McDonald S,Fivizzani A J,et al.Effects of the herbicide atrazine on Ambystoma tigrinummetamorphosis:Duration,larval growth,and hormonal response[J].Physiological Zoology,1998,71(6):671-679
[54] Brodeur JC,Svartz G,Perez-Coll CS,etal.Comparative susceptibility to atrazine of three developmental stages of Rhinella arenarum and influence on metamorphosis:Non-monotonous acceleration of the time to climax and delayed tail resorption [J].Aquatic Toxicology,2009,91(2):161-170
[55] Rohr JR,McCoy K A.A qualitativemeta-analysis reveals consistent effects of atrazine on freshwater fish and amphibians [J].Environmental Health Perspectives,2010,118(1):20-32
[56] Golub M S,Wu K L,Kaufman F L,et al.Bisphenol A:Developmental toxicity from early prenatal exposure[J].Birth Defects Research Part B-Developmental and Reproductive Toxicology,2010,89(6):441-466
[57] Rubin B S.Bisphenol A:An endocrine disruptor with widespread exposure and multiple effects[J].The Journal of Steroid Biochemistry and Molecular Biology,2011,127(1-2):27-34
[58] Markey C M,Michaelson C L,Veson E C,et al.The mouse uterotrophic assay:A reevaluation of its validity in assessing the estrogenicity of bisphenol A[J].Environmental Health Perspectives,2001,109(1):55-60
[59] Cabaton N J,Wadia PR,Rubin B S,et al.Perinatal exposure to environmentally relevant levels of bisphenol A decreases fertility and fecundity in CD-1 mice[J].Environmental Health Perspectives,2011,119(4):547-552
[60] Jones B A,Shimell JJ,Watson N V.Pre-and postnatalbisphenol A treatment results in persistent deficits in the sexual behavior ofmale rats,but not female rats,in adulthood[J].Hormones and Behavior,2011,59(2):246-251
[61] Jones B A,Watson N V.Perinatal BPA exposure demasculinizes males in measures of affect but has no effect on water maze learning in adulthood[J].Hormones and Behavior,2012,61(4):605-610
[62] Muto T,Wakui S,Imano N,etal.Mammary gland differentiation in female rats after prenatal exposure to 3,3',4,4',5-pentachlorobiphenyl[J].Toxicology,2002,177(2-3):197-205
[63] Wakui S,Yokoo K,TakahashiH,etal.CYP1 and AhR expression in 7,12-dimethylbenz[a]anthracene-induced mammary carcinoma of rats prenatally exposed to3,3,4,4',5-pentachlorobiphenyl[J].Toxicology,2005,211(3):231-241
[64] Wakui S,Yokoo K,TakahashiH,etal.Prenatal3,3',4,4 ',5-pentachlorobiphenyl exposure modulates induction of rat hepatic CYP1A1,1B1,and AhR by 7,12-dimethylbenz[a]anthracene [J].Toxicology and Applied Pharmacology,2006,210(3):200-211
[65] Lee D H,Steffes M W,Sjodin A,et al.Low dose of some persistent organic pollutants predicts type 2 diabetes:A nested case-control study[J].Environmental Health Perspectives,2010,118(9):1235-1242
[66] Lee D H,Steffes MW,Sjödin A,et al.Low dose organochlorine pesticides and polychlorinated biphenyls predict obesity,dyslipidemia,and insulin resistance among people free of diabetes[J].PLoSONE,2011,6(1):e15997
[67] Kim H,Jeong JH,Hwang JH,et al.Enhancement of immunostimulation and anti-metastasis in submerged culture of bearded tooth mushroom(hericium erinaceum)mycelia by addition of ginseng extract[J].Food Science and Biotechnology,2010,19(5):1259-1266
[68] Soto A M,Sonnenschein C.The two faces of Janus:Sex steroids as mediators of both cell proliferation and cell death[J].Journal of the National Cancer Institute,2001,93(22):1673-1675
[69] Song R X D,Mor G,Naftolin F,et al.Effect of longterm estrogen deprivation on apoptotic responses of breast cancer cells to17 beta-estradiol[J].Journalof the National Cancer Institute,2001,93(22):1714-1723
[70] Heldring N,Pike A,Andersson S,et al.Estrogen receptors:How do they signal and what are their targets[J].Physiological Reviews,2007,87(3):905-931
[71] Li L,Andersen M E,Heber S,et al.Non-monotonic dose-response relationship in steroid hormone receptormediated gene expression[J].Journal ofMolecular Endocrinology,2007,38(5):569-585
[72] Morani A,Warner M,Gustafsson JA.Biological functions and clinical implications of oestrogen receptors alfa and beta in epithelial tissues[J].Journal of Internal Medicine,2008,264(2):128-142
[73] Moriyama K,Tagami T,Akamizu T,etal.Thyroid hor-mone action is disrupted by bisphenol A as an antagonist[J].Journal of Clinical Endocrinology& Metabolism,2002,87(11):5185-5190
[74] Ismail A,Nawaz Z.Nuclear hormone receptor degradation and gene transcription:An update[J].International Union of Biochemistry and Molecular Biology Life,2005,57(7):483-490
[75] Kohn M C,Melnick R L.Biochemical origins of the nonmonotonic receptor-mediated dose-response[J].Journal of Molecular Endocrinology,2002,29(1):113-123
[76] Lonard DM,O'Malley BW.Emerging roles of the ubiquitin proteasome system in nuclear hormone receptor signaling[J].Progress in Molecular Biology and Translational Science,2009,87:117-135
[77] Nawaz Z,Lonard D M,Dennis A P,etal.Proteasomedependent degradation of the human estrogen receptor[J].Proceedings of the National Academy of Sciences,1999,96(5):1858-1862
[78] Lin H K,Altuwaijri S,Lin W J,et al.Proteasome activity is required for androgen receptor transcriptional activity via regulation of androgen receptor nuclear translocation and interaction with coregulators in prostate cancer cells [J].Journal of Biological Chemistry,2002,277(39):36570-36576
[79] Kinyamu H K,Archer T K.Estrogen receptor-dependent proteasomal degradation of the glucocorticoid receptor is coupled to an increase in Mdm2 protein expression[J].Molecular and Cellular Biology,2003,23(16):5867-5881
[80] Shankaran H,Wiley H S,ResatH.Receptor downregulation and desensitization enhance the information processing ability of signalling receptors[J].BMC Systems Biology,2007,1(9):48
[81] Sakaue M,Ohsako S,Ishimura R,et al.Bisphenol-A affects spermatogenesis in the adult rat even at a low dose[J].Journal of Occupational Health,2001,43:185-190
[82] Gupta C.Reproductive malformation of the male offspring following maternal exposure to estrogenic chemicals[J].Proceedings of the Society for Experimental Biology and Medicine,2000,224(2):61-68
[83] Myers JP,Zoeller R T,vom Saal F S.A clash of old and new scientific concepts in toxicity,with important implications for public health [J].Environmental Health Perspectives,2009,117(11):1652-1655 ◆
