氯化镉暴露对斑马鱼幼鱼神经行为毒性作用
2013-08-20史慧勤张利军苑晓燕彭辉赵君彭双清
史慧勤,张利军,苑晓燕,彭辉,赵君,彭双清
军事医学科学院疾病预防控制所毒理学评价研究中心,北京100071
镉是一种重要的环境重金属污染物,由吸入含镉的烟雾和灰尘引起急性镉中毒历来是危害公共卫生安全的重要事件,而对食品安全问题的担忧使得人们更加重视水源、可食水生生物以及农作物中镉污染的问题。镉具有蓄积性,可造成肝、肾、骨骼等全身多脏器的损伤[1-2],并且可透过胎盘影响胎儿,因而对出生前后低剂量镉暴露引起的发育障碍尤其是对胎儿和婴幼儿神经发育方面影响也广受关注。临床研究认为,胎儿期慢性镉暴露能够抑制神经系统发育并引起婴幼儿认知功能障碍以及感觉运动能力减弱、多动症和注意力障碍等[3-5]。儿童期体内镉负荷量增高可造成精神运动性发育障碍,损害感知觉能力、语言能力并造成智力下降[3-4]。啮齿动物实验结果表明,出生前后低水平的镉暴露会影响小鼠电生理学功能和高级神经系统功能[6]。另外,低剂量长期染毒会减少海马CA3区神经元和反应性增多星型神经胶质细胞,导致小鼠学习、记忆能力降低[7]。小鼠胎仔宫内镉暴露后,出现剂量依赖性的获得性条件回避反射能力损害及异常行为表现,并在发育至成年后具有远期行为损害效应[8-9]。
斑马鱼具有典型的脊椎动物脑部形态特征,并且分子遗传学和发育生物学背景明确,已被广泛应用于毒理学神经发育研究[10]。Chow 等[11]研究发现,发育早期镉暴露能够抑制斑马鱼胚胎的神经元和神经胶质细胞分化,导致胚胎头部发育不良,神经前体基因表达降低,进而证实镉通过损害斑马鱼神经细胞生成,导致神经分化显著降低和轴突形成减少来发挥神经发育毒性作用。斑马鱼的神经组织和器官结构虽然简单但能够支配复杂行为活动,如逃避、捕食、群体交互及学习、记忆等[12-13]。本实验检测了发育早期阶段经过低剂量镉长时间暴露的斑马鱼幼鱼的运动行为特征,目的是为探索应用高通量的神经行为学方法检测水环境中镉污染和提高斑马鱼幼鱼作为神经发育毒理学模型的应用效能提供实验依据。
1 材料与方法(M aterials and methods)
1.1 主要试剂及配制
氯化镉(cadmium chloride)(99.0%),北京化工厂。幼鱼孵化液(30%Danieau's 液):17.4 mmol·L-1NaCl、0.21 mmol·L-1KCl、0.12 mmol·L-1MgSO4、0.15 mmol·L-1Ca(NO3)2、1.5mmol·L-1Hepes(pH 7.2)。参照文献[11,14],用幼鱼孵化液配制0.5 ~2.0 μmol·L-1的氯化镉受试液和0.5% ~4%乙醇溶液。亚甲基蓝,温州市化学试剂有限公司,先用灭菌水配制0.1%母液,使用时稀释500倍。
1.2 动物饲养和鱼卵采集
斑马鱼亲鱼为AB系,由北京大学生命科学研究院惠赠。斑马鱼的养殖和繁殖参照Westerfield的方法[15]。光照周期 L∶D=14 h∶10 h,水温(28±1)℃,养鱼系统循环水为去离子水加海盐,保持电导率450~500 μs·cm-1,用 NaHCO3调节 pH 值为7.0左右。使用新鲜孵化的丰年虾喂养,一日2次。5月龄后雌雄鱼分箱饲养。
实验前1天晚间将7~18月龄成鱼放入交配缸(雌∶雄=1∶1)。次日清晨取隔板后,采集30 min内产受精卵,用循环水清洗2遍后放入孵化液中,同时加入亚甲基蓝溶液防止真菌产生,于28.5℃继续孵化。受精后2 h(2 hpf)体式显微镜下观察,确定发育阶段[16]并选择正常受精卵备用。
1.3 实验仪器
Noldus幼鱼运动行为仪(Noldus Information Technology,美国);体式显微镜及成像系统(OLYMPUS SZX16,日本);电子天平(Sartorius BT224S和LP1200S,德国)。
1.4 行为学实验准备和受试液处理
将收集36 hpf斑马鱼胚胎置于6孔板中,约60枚/孔。吸净孵化水后迅速加入5 mL氯化镉受试溶液,每孔一个剂量浓度。给药后放入28.5℃孵箱中继续孵化。及时取出死亡鱼卵或幼鱼。至6 dpf前每日更换2次受试液,每次更换2.5mL。实验同时设正常对照组,每日更换新鲜孵化水。6 dpf时在体式显微镜下观察记录幼鱼的形态变化,记录死亡和畸形情况以及畸形特征。选择96 hpf死亡率和畸形率<5%的剂量组幼鱼作为实验用鱼。将外观正常的幼鱼逐条放入洁净48孔板中,24条/剂量组。每孔保持1 mL受试液。乙醇处理方法:将5 mL不同浓度乙醇溶液分别放入洁净6孔板中,1剂量组/孔。用小滤勺将正常对照6 dpf幼鱼迅速移至6孔板中,60条/剂量组。然后逐条转移幼鱼至48孔板中,24条/剂量组。每孔1 mL受试液。同时设立正常对照。
1.5 幼鱼自发运动观察
将48孔板放入Noldus幼鱼运动行为仪内适应5 min。采集3 min幼鱼自发运动视频。应用Ethovision XT软件(Noldus Information Technology)将运动轨迹可视化,导出3 min内幼鱼移动距离、运动速度等运动参数。乙醇暴露组的实验时间为:4%组为暴露后30 min;1%、2%组为暴露后45 min;0.5%组为暴露后1 h。实验同时设正常对照。实验时段为12:30—15:30,接近幼鱼运动平台期[14]。
1.6 幼鱼对强光刺激的惊恐逃避反射实验
将48孔板放入Noldus幼鱼运动行为仪内适应5 min后,控制Noldus幼鱼运动行为仪采集11 min幼鱼运动视频,其中前5 min为黑暗期,第6 min通过Ethovision XT软件编程控制行为仪开启底灯强光照射1 min后迅速关闭。应用Ethovision XT软件导出每分钟幼鱼运动速度、移动距离等参数。实验同时设正常对照。实验时段为12:30—15:30。
1.7 结果统计和分析
将运动参数按剂量组整理汇总,用平均数±标准误差(Mean±SD)表示。应用软件SPSS11.5进行单因素One-Way方差分析,即在方差齐性检验的基础上分别采用LSD(方差齐时)或Tamhane(方差不齐时)检验,比较正常对照组和各剂量组间运动参数差异,当P<0.05时,认为差异具有统计学意义。
2 结果(Results)
在36 hpf~6 dpf期限内镉暴露组幼鱼死亡率畸形率均低于5%。体式显微镜下观察可见,暴露剂量≤1.0 μmol·L-1时,除个别幼鱼体色变浅外,外观形态未见明显异常,可用于行为学实验。
2.1 低剂量氯化镉暴露对斑马鱼幼鱼自发运动的影响
将6 dpf幼鱼的自发运动轨迹可视化,结果显示:与正常对照相比,0.1 ~0.5 μmol·L-1暴露组幼鱼运动自发运动轨迹增多、紊乱,并伴有刻板式转向活动增多,触壁反射活动减少;而0.5 ~1.0 μmol·L-1暴露组幼鱼出现僵直、震颤和小范围内转圈现象,以1.0μmol·L-1组更为明显(见图1)。以上结果表明,胚胎期和幼鱼早期阶段持续性氯化镉暴露能够改变幼鱼的运动方式。
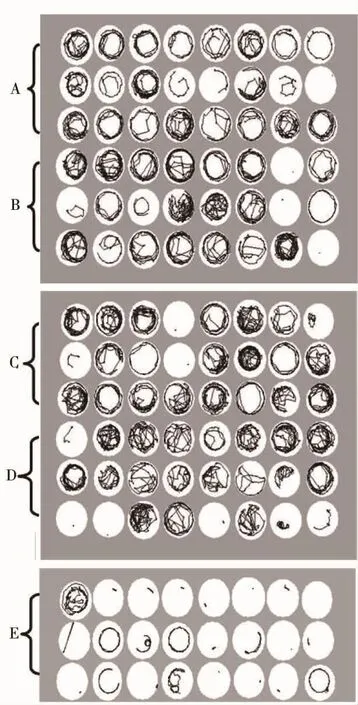
图1 36 hpf~6 dp f氯化镉暴露后6 dpf幼鱼运动轨迹
自发运动参数分析发现,在0.1 ~1.0 μmol·L-1范围内随暴露剂量增大,幼鱼自发运动距离由增高转向降低,呈现明显的剂量依赖性倒“U”型反应趋势(图2A),而由于 0.25 ~1.0 μmol·L-1暴露组幼鱼增快和减慢2种运动并存,因而平均速度值没有显著性差异(图2B),通过最大移动速度、快速运动(速度≥2.0 cm·s-1)持续时间及出现频率比较(图2C、2D、2E),发现虽然组内参数差异较大,但各剂量组依然从一定程度上能够反映组间倒“U”型毒性效应,这与实验中乙醇暴露后幼鱼产生的倒“U”型运动效应相类似,即0.5% ~2%乙醇较长时程暴露具有运动兴奋效应,而4%乙醇较短时程暴露则具有明显的抑制作用(见图3)。结果表明,早期氯化镉暴露能够损害幼鱼的自发运动能力。
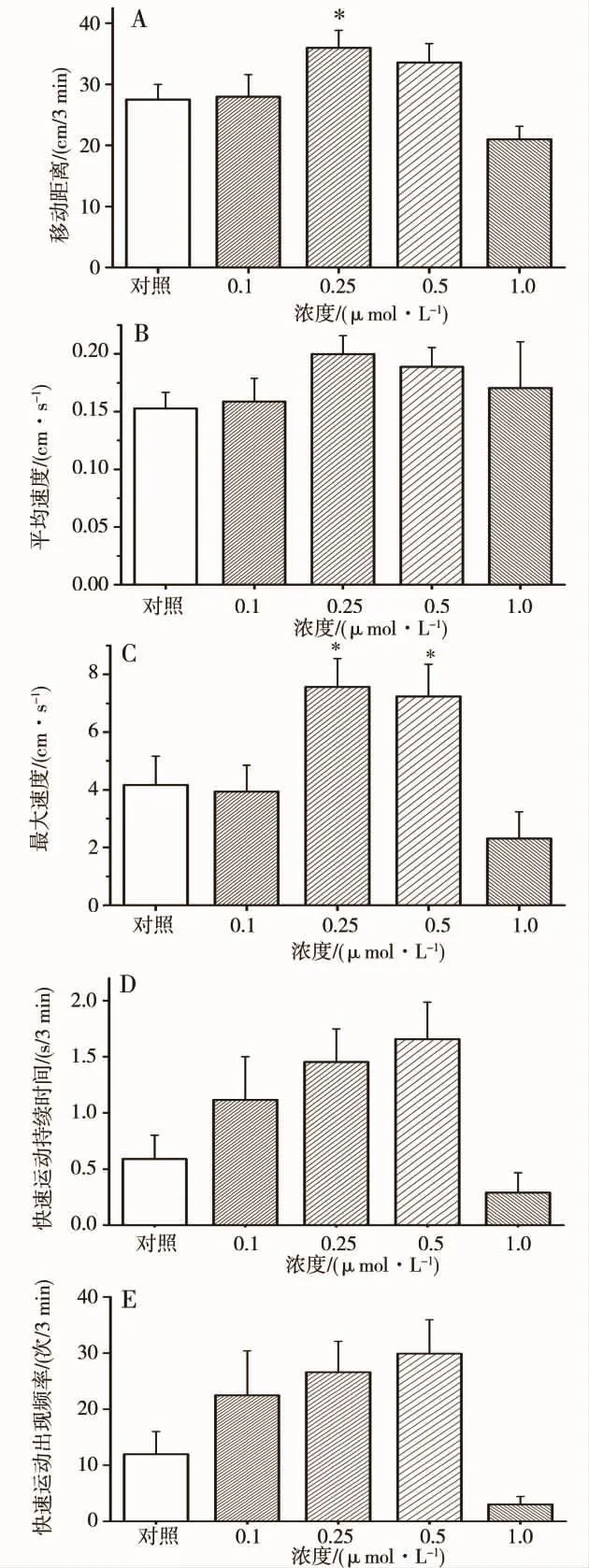
图2 36 hpf~6 dpf氯化镉暴露对6 dpf幼鱼自发运动的影响
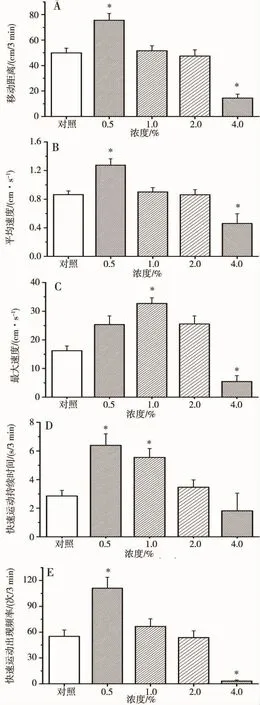
图3 乙醇急性暴露对6 dpf幼鱼自发运动的影响
2.2 镉暴露后幼鱼惊恐反射及适应能力改变
本研究选择的实验时间为斑马鱼白天活动平台期,在转移至黑暗环境中适应一段时间后,斑马鱼幼鱼表现为静息或平稳游动。突然给予强光照射,正常幼鱼对外界刺激的反应表现为惊跳后迅速静止不动或速度明显降低。而突然撤除光源后,幼鱼表现为速度激增后又逐渐减慢的过程。以光、暗交替时刻前后1 min内速度变化以及光、暗期内每分钟移动距离作为行为学指标评价幼鱼对外界刺激的反应和适应能力。如图4所示。其中,0.1~0.5 μmol·L-1组幼鱼暗-光交替时加速度增大运动状态以兴奋为主;而光-暗交替时,暴露组幼鱼运动加速度呈剂量依赖性降低。此外,正常对照组幼鱼在转入黑暗环境后5 min即可恢复到光照前运动水平。与正常对照组光照前的平均水平相比,0.1 和0.25 μmol·L-1暴露组在撤除光源后5 min运动仍很活跃;0.5 μmol·L-1暴露组暗恢复时程则缩短为4 min;1.0 μmol·L-1暴露组除在第3分钟时运动水平有所下降外,其余时间均未表现出显著变化。与同时间内正常对照组运动水平相比,在撤除光源4 min内暴露组幼鱼恢复能力呈剂量依赖性倒“U”型改变。

图4 36 hpf~6 dpf氯化镉暴露对6 dpf幼鱼惊恐反射实验中反应能力和适应能力的影响
以上结果表明,0.1 ~0.5 μmol·L-1组幼鱼对外界刺激反应比较敏感,0.1 和 0.25 μmol·L-1组刺激后恢复能力减弱。而1.0μmol·L-1组反应比较迟钝,运动能力一直在低水平徘徊。
3 讨论(Discussion)
镉作为一种重要的环境重金属污染物污染,可以在生物体内富集,并通过食物链进入人体,引起慢性镉中毒。因此镉对人体健康,特别是对未成年人发育的毒性影响日益引起关注。模式动物斑马鱼除具有容易饲养、实验操作方便等特点外,胚胎和早期幼鱼在神经发育毒性研究中又有独特优势[10,17]。首先,斑马鱼发育早期通体透明,容易应用染色剂、荧光抗体、基因探针等技术整体观察神经组织或器官的器质性病变。第二,幼鱼运动行为按照固定的顺序发育,发育过程中能够产生运动、探索、学习等一系列复杂行为的变化。而行为活动作为最敏感的指标[18],是机体通过自身机能的调整消除或减少损伤的表观反映。行为学的检测虽然相对比较简单,但能够从宏观上早期发现外源化合物引起的神经功能性障碍,较引起器质性改变后的病理学检查更为直接、敏感并且经济、有效。本次实验中造成神经行为学改变的最高暴露剂量为1.0μmol·L-1,比斑马鱼的半数致死浓度(168 μmol·L-1)[19]、嗅觉依赖性对捕食者回避行为损伤的剂量(125μmol·L-1)[20]或引起胚胎脑部发育不良的暴露剂量(100 μmol·L-1)[11]要小100多倍。而最早染毒时期为36 hpf,此时胚胎体轴、肌节和心脏、脑等已基本形成[16]。因此,实验中暴露组幼鱼的神经行为表现能够充分反映整体神经功能变化,较于病理损伤或死亡更为直观、敏感。
本实验检测了早期持续性镉暴露所致斑马鱼幼鱼自发运动能力变化,结果表明,镉暴露组幼鱼的行为强度变化与环境污染物之间存在倒“U”型剂量-效应关系。这与乙醇急性暴露时斑马鱼幼鱼产生的行为方式相类似。有研究认为,乙醇暴露能够损伤斑马鱼的视神经[17,21],降低视觉敏感性,损伤中枢神经元、运动神经元和抑制骨骼的发育[22-23],亦或影响脑内多巴胺受体的敏感性[24],从而改变斑马鱼的运动能力。而镉在生物体内具有明显的蓄积作用,本实验中暴露组幼鱼的兴奋行为是否源于镉暴露导致的神经痛;运动抑制行为产生的原因是否是为镉中毒所致的中枢神经和运动神经功能障碍或相关组织如眼、骨骼肌发育不良等,尚需进一步研究。
光照惊恐反射是一种由视觉诱导的明显生理反应。正常斑马鱼在经过一段时间的适应后,如其所在区域的光线突然变暗或者变亮,它会有一个迅速逃脱该区域的动作。斑马鱼的惊恐反应于68 hpf产生,斑马鱼的眼睛正在形成且视网膜神经元突触也正在建立,而发育至96 hpf后,幼年斑马鱼具有自由运动的能力[25]。因此,光照刺激引发的惊恐反应能力和刺激撤除后行为恢复能力的变化,可用于检测由视觉引发的感觉运动高级神经回路是否正常。本实验中镉暴露后斑马鱼幼鱼在惊恐反射中表现出对突发外界刺激的反应能力以及撤除刺激后的适应能力呈现剂量依赖性增强或减弱的变化。一方面印证了自发运动中行为毒性效应在光刺激出现时引起运动兴奋或抑制效应,并因此导致相应的暗适应时程的延缓或加速。另一方面,惊恐反应敏感提示暴露剂量下幼鱼的视觉功能未受到影响,但运动功能受到损伤;而1.0μmol·L-1组幼鱼反应迟钝则表明,在该剂量下幼鱼除运动功能受损外还可能存在视觉功能障碍。另外,本实验中正常幼鱼在惊恐反射光照期内表现出短暂逃避行为后的运动抑制现象与笔者之前于夜间所做的惊恐反射实验中运动激增的表现不一致[26],表明斑马鱼在白天和夜晚对视觉引导的惊恐反应方式存在差异。
本实验应用幼鱼运动行为仪和相关软件的基础上采用的视频采集、图像跟踪技术进行高通量的检测,能够同时观察对多个剂量组、多实验对象运动轨迹的实时变化、并对多个运动参数进行定量分析,减少了哺乳动物实验中存在的实验时间耗时长、实验动物存在应激等弊端,提高检测效率和实验结果的客观、真实性。并且,实验中对乙醇急性暴露后斑马鱼幼鱼的倒“U”型行为毒性效应不仅验证了前人的[14,24]研究结果,还证明了斑马鱼幼鱼运动行为学的高通量检测技术具有良好的可重复性。此项技术的应用能够拓展模式动物斑马鱼作为替代模型在毒理学研究中的应用空间,同时为建立环境污染监测预警技术提供理论依据。
[1] Saygi S,Denis C,Kutsal O,et al.Chronic effects of cadmium on kidiney,liver,testis and fertility of male rats[J].Biological Trace Element Research,1991,31(3):209-214
[2] 梁友信.劳动卫生与职业病学[M].4版.北京:人民卫生出版社,2000:167-681
[3] Weiss B,Spyker JM.The susceptibility of the fetus and child to chemical pollutants:Behavioral implications of prenatal and early postnatal exposure to chemical pollutants[J].Pediatrics,1974,53(5):851-859
[4] Chisolm Jr J J.Heavy metal exposures:Toxicity from metal-metal interactions,and behavioral effects [J].Pediatrics,1974,53(5):841-843
[5] Thatcher RW,Lester M L,McAlaster R,etal.Effects of low levels of cadmium and lead on cognitive functioning in children [J].Archives of Environmental Health,1982,37(3):159-166
[6] Dési I,Nagymajtényi L,Schulz H.Behavioural and neurotoxicological changes caused by cadmium treatment of rats during development[J].Journalof Applied Toxicology,1998,18(1):63-70
[7] 朱俊德,余资江,戈果,等.慢性镉中毒对小鼠学习记忆及海马CA3区的影响[J].环境与健康杂志,2009,26(7):576-579 Zhu JD,Yu Z J,Ge G,et al.Effects of chronic cadmium exposure on learning,memory and hippocampus CA3 in mice[J].Journal of Environment and Health,2009,26(7):576-579(in Chinese)
[8] Baranski B.Effect of prenatal exposure to cadmium on avoidance acquisition in rats [J].Medycyna Pracy,1983,34(5-6):381-383
[9] Ali M M,Murthy R C,Chandra S V.Developmental and long term neurobehavioral toxicity of low level inutero cadmium exposure in rats[J].Neurobehavior Toxicoloy and Teratology,1986,8(5):463-468
[10] Linney E,Upchurch L,Donerly S.Zebrafish as a neurotoxicologicalmodel[J].Neurotoxicology and Teratology,2004,26(6):709-718
[11] Chow E S,HuiM N,Lin CC,etal.Cadmium inhibits neurogenesis in zebrafish embryonic brain development[J].Aquatic Toxicology,2008,87(3):157-169
[12] 邹苏琪,殷梧,杨昱鹏,等.斑马鱼行为学实验在神经科学中的应用[J].生物化学与生物物理进展,2009,36(1):5-12 Zou SQ,YinW,Yang Y P,etal.The ethology application of zebrafish in neuroscience[J].Progress in Biochemistry and Biophysics,2009,36(1):5-12(in Chinese)
[13] Tierney K B.Behavioural assessments of neurotoxic effects and neurodegeneration in zebrafish [J].Biochimica et Biophysica Acta,2011,1812(3):381-389
[14] MacPhail RC,Brooks J,Hunter D L,etal.Locomotion in larval zebrafish:Influence of time of day,lighting and ethanol[J].Neurotoxicology,2009,30(1):52-58
[15] Westerfield M.The Zebrafish Book(4th)[M].Eugene:University of Oregon Press,2000:28-196
[16] Kimmel C,Ballard W W,Kimmel SR,et al.Stages of embryonic development in the zebrafish[J].Developmental Dynamics,1995,203(3):253-310
[17] Parng C,Roy N M,Ton C,etal.Neurotoxicity assessment using zebrafish[J].Journal of Pharmacological and Toxicological Methods,2007,5(1):103-112
[18] Agency for Toxic Substances and Disease Registry(ATSDR).Toxicological Profile for Cadmium [R].Atlanta:U.S.Department of Health and Human Services,1999
[19] Cheng SH,Wai A W K,So C H,et al.Cellular and molecular basis of cadmium-induced deformities in zebrafish embryos[J].Environmental Toxicology and Chemistry,2000,19(12):3024-3031
[20] Blechinger SR,Kusch R C,Haugo K,et al.Brief embryonic cadmium exposure induces a stress response and cell death in the developing olfactory system followed by long-term olfactory deficits in juvenile zebrafish [J].Toxicology and Applied Pharmacology,2007,224(1):72-80
[21] Matsui JL,Egana A L,Sponboltz TR,etal.Effects of ethanol on photoreceptors and visual function in developing zebrafish[J].Investigative Opthalmology& Visual Science,2006,47(10):4589-4597
[22] Carvan IIIM J,Loucks E,Weber D N,et al.Ethanol effects on the developing zebrafish:Neurobehavior and skeletalmorphogenesis[J].Neurotoxicology and Teratology,2004,26(6):757-768
[23] Sylvain N J,Brewster D L,AliDW.Zebrafish embryos exposed to alcohol undergo abnormal development of motor[J].Neurotoxicology and Teratology,2010,32(1):472-480
[24] Irons T D,MacPhail R C,Hunter D L,et al.Acute neuroactive drug exposures alter locomotor activity in larval zebrafish [J].Neurotoxicology and Teratology,2010,32(1):84-90
[25] Easter SS,Nicola G N.The development of vision in the zebrafish(Danio rerio)[J].Developmental Biology,1996,180(2):646-663
[26] 史慧勤,张利军,彭辉,等.氯丙嗪在斑马鱼胚胎和早期幼鱼发育过程中的神经毒性作用[J].中国比较医学杂志,2011,21(10-11):150-156 Shi H Q,Zhang L J,Peng H,et al.Developmental neurotoxicity effect of chlorpromazine on zebrafish embryo and larvae[J].Chinese Journal of Comparative Medicine,2011,21(10-11):150-156(in Chinese)◆
