芘污染对马氏珠母贝(Pinctada martensi)D型面盘幼虫发育的影响
2013-08-20谢嘉刁晓平杨宝赵春风3杜俊俏周海龙3
谢嘉,刁晓平 ,杨宝,赵春风3,,杜俊俏,周海龙3,,#
1.海南大学环境与植物保护学院,海口570228
2.海南大学海口市环境毒理学重点实验室,海口570228
3.海南省热带生物资源可持续利用重点实验室,海口570228
4.海南大学农学院,海口570228
多环芳烃是(PAHs)是一类广泛存在于环境中的难降解、半挥发性有机污染物,具有致癌、致畸、致突变等特性[1]。其主要来源于人类活动和能源利用过程,比如沿海城市生活污水、工业废弃物、汽车尾气的排放,石油、煤、木材等的不完全燃烧和海上石油开发及石油溢漏等[2]。多环芳烃是由2个或2个以上苯环分子组成的以线状、角状或簇状排列的碳氢化合物,可分为2类:第1类是含有2~3环的低分子量芳烃(LMW PAHs),如萘(NA)、菲(PHE)等;第2类是含有4~6环的高分子量芳烃(HMW PAHs),如荧蒽(FA)、屈(CHR)、芘(Py)、苯并[a]芘(B[a]P)等[3]。低环多环芳烃具有分子量小、易挥发,且对水生生物的毒性作用大的特点,高环多芳烃分子量大、难挥发,具有强致癌和致突变的作用。PAHs通常以水体中的悬浮物和大气溶胶为主要载体,进入海洋环境并广泛分布。迄今为止,已发现致癌性的多环芳烃及其衍生物多达400多种。海洋环境中的PAHs会通过生物积累和食物链作用进入鱼类、贝类等海洋生物体中,不仅影响海洋生物的生殖繁衍,而且会破坏海洋生态环境,影响海产品的产量和质量继而影响人类健康。
芘(pyrene)是多环芳烃类的一种重要代表性污染物。在水体中,芘会随着食物链进入生物体内并积累,继而对海洋动物产生毒害作用。软体动物为沿海生态系统中的优势种,且具有较高的经济价值[4]。胚胎和早期幼虫发育是软体动物的生活史中的组成部分,因此早期幼虫数量的变动将影响成体的数量。马氏珠母贝(Pinctadamartensi),又名日本合浦珠母贝,海产软体动物,瓣鳃纲(Lamellibranchia),珍珠贝目(Pterioida),珠母贝科(Pteriidae),广泛分布于热带和亚热带沿海,属于热带海洋环境中的一种优势贝类,是国内生产海水珍珠的主要种类,因此具有重要的经济价值[5-6]。海洋贝类在幼虫阶段对外界环境的变化比较敏感,而幼虫的生长及存活情况对种群的可持续发展非常重要[7]。何盛毅等[8]在研究外界海洋环境酸化胁迫对马氏珠母贝胚胎和早期幼虫发育的影响中发现,海洋酸化虽然未明显影响马氏珠母贝胚胎发育,但对D型幼虫的影响是显著的。王鹏飞等[9]报道马氏珠母贝在D型面盘幼虫阶段对外界环境的影响较敏感。但是,目前芘对马氏珠母贝早期发育毒性作用的相关研究尚未见报道。本文拟通过芘污染对马氏珠母贝胚胎发育的毒理效应研究,探讨芘污染对马氏珠母贝种群发育的影响,为评估芘污染对海洋动物的影响提供科学依据。
1 材料与方法(M aterials and methods)
1.1 实验材料
实验模式动物为马氏珠母贝(Pinctada maetensi),购自海南省陵水县黎安镇贝类养殖场,挑选性腺成熟,健康的个体作为亲贝,贝龄约为2年,壳高(8.0 ± 0.6)cm,壳长(7.6 ± 0.1)cm,壳厚(2.8± 0.2)cm,质量(68.3 ± 0.3)g,实验所用海水均取自海南陵水黎安港无污染区域的自然海水,经80目筛绢网过滤处理后待用。
1.2 仪器与试剂
仪器:BX41/45显微镜(Olympus公司,日本)、5702台式冷冻低速离心机(Eppendorf公司,德国)。
试剂:芘(Sigma公司,美国)、丙酮(Amresco公司,美国)等均为分析纯。
1.3 实验方法
根据国内外自然海区中芘的污染情况[10-11]和预实验,将芘以丙酮为溶剂配制成2、4、8、16和32 μg·L-15个浓度,作为实验组,同时分别设置丙酮和海水空白对照组。马氏珠母贝进行人工受精[12],然后在盐度为32‰、pH 值为8.3、温度为(27±1)℃的海水中待发育到D型期,然后将马氏珠母贝胚胎转移到不同芘浓度的海水中进行暴露实验,每个处理组胚胎初始密度为3.5~4个·mL-1。同时,设置3个平行。然后,分别于 12、24、36、48、60、72 和 84 h各取100 mL D型面盘幼虫,在25℃、以2 000 r·min-1离心5 min,再将幼虫样品铺于载玻片上,于显微镜下统计死亡数和畸形数。
1.4 数据分析
1.4.1 死亡率和畸形率
死亡率和畸形率的计算方法参照金启增等[6]的方法,其中畸形评价标准参考His等[13]的报道:D型幼虫畸形包括壳缘内凹、绞合线内凹、锯齿状的壳缘、不完全的壳和凸出覆盖物的个体。死亡率=(初始密度-D型期密度)/初始密度,密度单位为个·mL-1;畸形率为某一时期畸形个数占测量总个体数的百分率。
1.4.2 半数致死浓度(LC50)
对于LC50的计算,参照解静芳等[14]的方法:采用直线回归法,以避免一些主观因素的影响,直线回归方程为y=bx+a。式中:x为浓度的对数;y为死亡率转换成的概率单位;a、b分别为直线的截距和斜率,当死亡率为50%时其概率单位为y=5,即可由回归方程求得LC50(LC50的95%置信区间计算公式为 log-1[x±2S×1.96/(2n)1/2],式中:S为标准偏差;n为实验动物总数),从而求出LC50值,并制表分析。
胡锦涛总书记在庆祝清华大学建校100周年大会上指出,要“着力增强学生服务国家服务人民的社会责任感、勇于探索的创新精神、善于解决问题的实践能力,努力培养德智体美全面发展的社会主义建设者和接班人”[1]。《国家中长期教育改革与发展规划纲要》也明确要求“着力提高学生服务国家服务人民的社会责任感、勇于探索的创新精神和善于解决问题的实践能力”[2]。可见,社会责任感教育问题已上升到国家战略层面。高校校园文化作为一种重要的教育形式,在师生中具有持久的向心力和凝聚力,对于培养大学生的社会责任感具有重要作用。
1.5 数据统计
采用SPSS 17.0统计分析软件,在P=0.05的置信水平对死亡率和畸形率进行单因素方差分析(One– Way ANOVA)。
2 结果(Results)
2.1 芘对马氏珠母贝D型面盘幼虫死亡率的影响
在芘暴露下,D型面盘幼虫死亡率情况如表1所示。海水空白对照与丙酮溶剂对照组的死亡率无显著差异(P >0.05),染毒初期(12 h)随着浓度的增加,D型面盘幼虫死亡率不断增加,LOEC(最低可见有效浓度)为16 μg·L-1,最大浓度组(32 μg·L-1)的死亡率为14.90%;染毒36 h后,LOEC变化为2 μg·L-1,LOEC并未随染毒时间的延长而变化,直至染毒后84 h,LOEC 仍为2 μg·L-1。84 h时,最高浓度组(32μg·L-1)死亡率达到56.75%,显示出明显的剂量-效应关系。从8μg·L-1浓度组开始,死亡率超过50%,呈现出明显的时间-效应关系。
随着染毒时间的推移,不同浓度组D型面盘幼虫死亡率不断增加。16和32μg·L-1浓度组在初始染毒时(12 h),死亡率与空白对照组相比,就表现出明显差异(P <0.05)分别达到15.40%和14.90%;随着时间的推移,染毒36 h后,从最低浓度组(2μg·L-1)开始,死亡率就显著高于对照组,呈明显的剂量-效应关系,染毒36 h、84 h 后,最高浓度组(32 μg·L-1)的死亡率分别达33.67%和56.75%,与对照组相比,有极显著差异(P<0.01)。上述结果表明,芘污染对马氏珠母贝D型面盘幼虫死亡率有明显的影响。
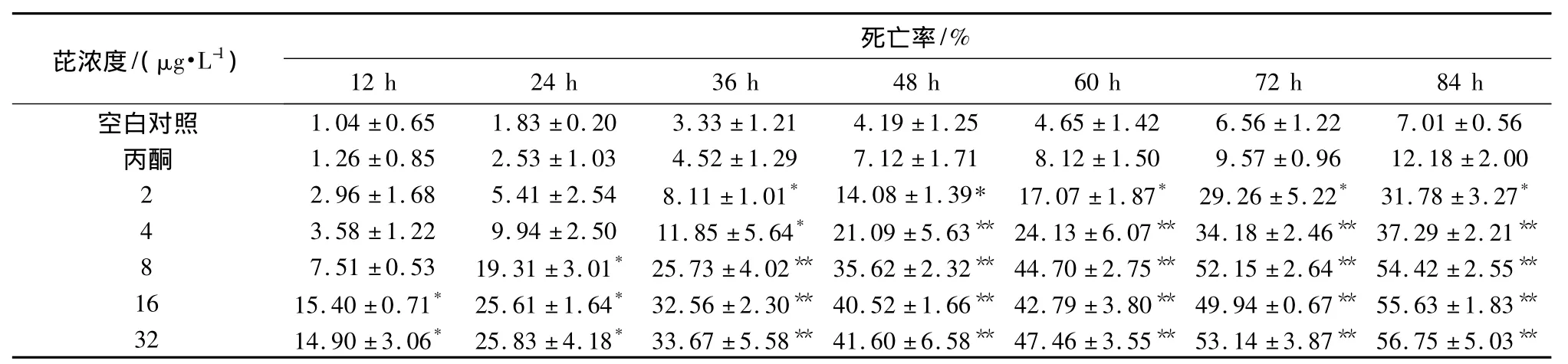
表1 在不同浓度芘中暴露不同时间后马氏珠母贝D型面盘幼虫的死亡率Table 1 Mortality of D-shaped veliger larvae of Pinctadamartensi after exposure to pyrene at different concentrations for different times
2.2 芘对马氏珠母贝D型面盘幼虫畸形率的影响
芘对D型面盘幼虫畸形率的影响结果见表2。海水空白对照与丙酮溶剂对照组的畸形率无显著差异(P >0.05),在相同的染毒时间内,不同浓度组D型面盘幼虫畸形率与对照组相比均有显著差异(P<0.05),表现出一定的剂量-效应关系,最大的畸形率达8.66%(8 μg·L-1,84 h)。D 型面盘幼虫畸形率随时间的延长而增加,表现出一定的时间-效应关系;60~84 h期间8和16μg·L-1浓度组的畸形率与对照相比,差异极显著(P <0.01),且平均畸形率高于32 μg·L-1浓度组,其中8 μg·L-1浓度组从60 h开始,畸形率皆高于其他浓度组,并与对照组相比存在极显著差异(P <0.01);染毒72 h时后,从8μg·L-1浓度组开始,D型面盘幼虫的畸形率与对照相比均有极显著差异(P <0.01)。结果表明,芘暴露对马氏珠母贝D型面盘幼虫的形态有明显影响。
2.3 芘对马氏珠母贝D型面盘幼虫形态学的影响
在实验中观察到以下几种畸形个体形态:壳缘内凹、绞合线内凹、不完全的壳、锯齿状的壳缘、凸出覆盖物(见图1)。

表2 在不同浓度芘中暴露不同时间后D型面盘幼虫的畸形率Table 2 Abnormalities of D-shaped veliger larvae after exposure to pyrene at different concentrations for different times

图1 芘染毒后D型面盘幼虫的几种畸形形态(40×)Fig.1 Abnormal types of D-shaped veliger larvae after exposure to pyrene(40×)
此外,随着时间的推移,D型幼虫的畸形程度也逐渐加大,在12~48 h期间,D型幼虫的畸形形态不明显(图2A),绞合线及壳缘轻微的凹陷,到60 h时D型幼虫的畸形形态明显,壳的四周开始出现清晰裂痕,并开始出现凸出覆盖物个体(图2B),直至84 h壳发生破裂。另外,由于限食,幼虫的发育受到影响[15],出现了空壳的现象(图2C)。
2.4 芘对马氏珠母贝D型面盘幼虫的LC50
在芘暴露下,通过计算,随着时间的推移LC50呈下降趋势(见图3),60 h后逐渐趋于平稳,12、24、36、48、60、72 和 84 h 的 LC50分别为 309.43、110.39、67.31、56.28、43.50、40.17 和 33.87 μg·L-1,60 h和72 h这2个时间点的LC50无显著性差异(P>0.05)。
3 讨论(Discussion)
已有研究发现,PAHs对很多物种的早期发育阶段能够产生一定的毒性效应。例如,1989年美国油轮埃克森·瓦尔迪兹(Exxon Valdez)号原油泄漏事故引起了一系列关于PAHs对在近海岸水域和潮间带产卵的太平洋鲱鱼(Clupea pallasi)和粉鲑(Oncorhynchus gorbuscha)发育毒性的研究[16-21]。丛伟等[22]研究了多环芳烃对海洋鱼类斜带髭鲷(Hapalogenys nitens Richardson)和鲈鱼(Lateolabrax japonicus)胚胎的发育毒性效应,发现PAHs暴露能激活芳香烃受体AhR通道及诱导基因、酶的表达,继而导致鱼类胚胎出现一系列异常症状,使其在发育阶段出现死亡和畸形。目前,关于PAHs对水生生物早期发育阶段的毒性效应研究主要集中在鱼类,而对贝类早期幼虫发育的影响探讨较少。
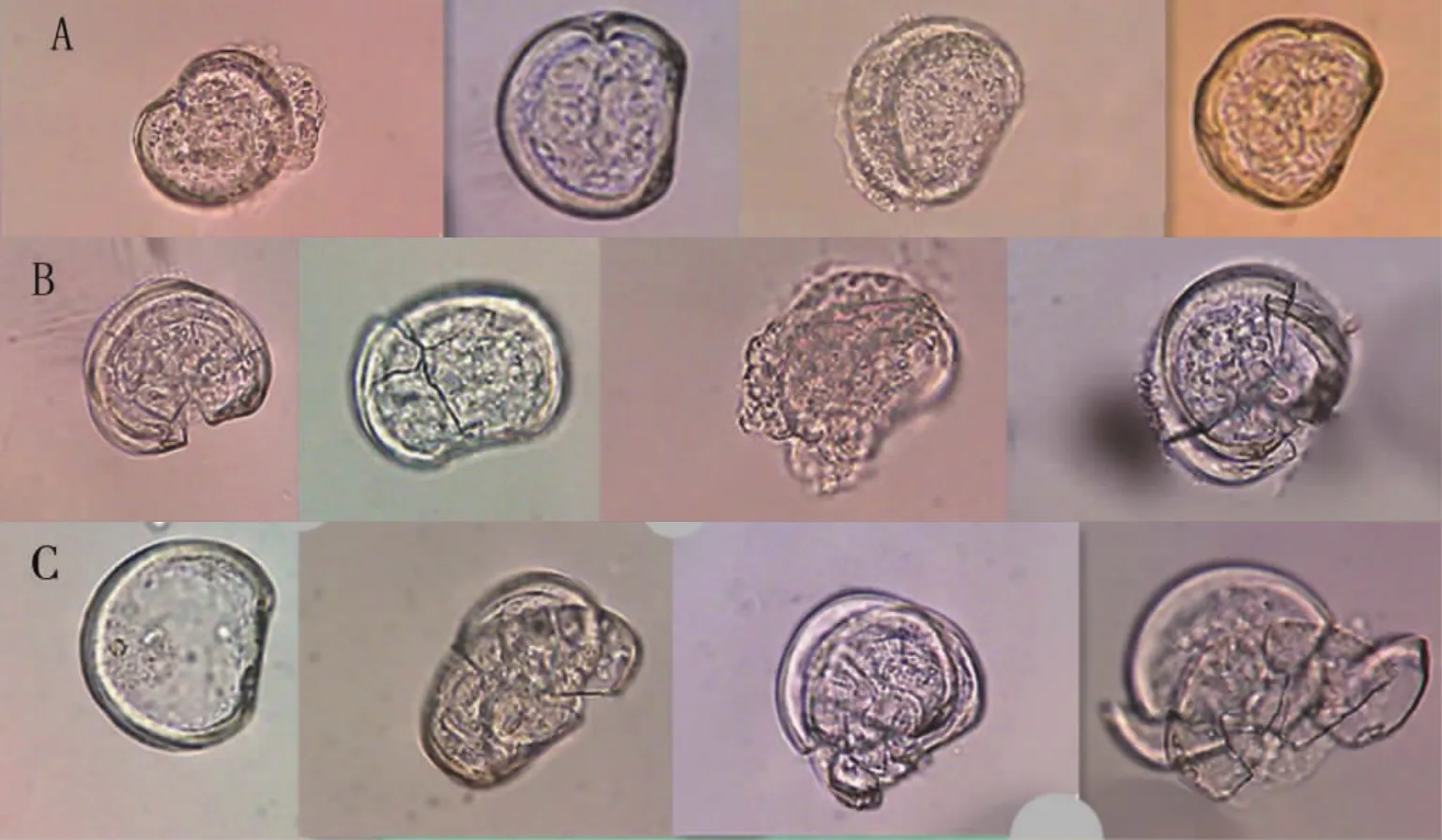
图2 芘染毒48(A)、60(B)和84 h(C)后D型幼虫的形态学变化(40×)Fig.2 Abnormalities of D-larvae after exposure to pyrene for 48(A),60(B)and 84 h(C)(40×)
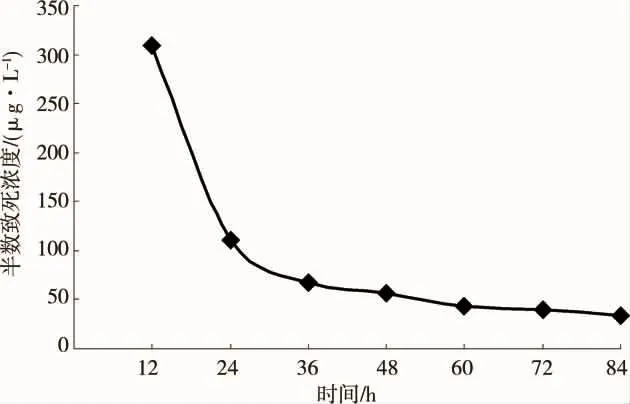
图3 D型面盘幼虫半数致死浓度(LC50)Fig.3 Half lethal concentration of B[a]P for D-larvae of Pinctadamartensi
本研究是第一次探讨芘胁迫对海洋贝类早期幼虫发育的影响,实验结果显示,芘对马氏珠母贝的死亡率有显著影响,在2~32μg·L-1浓度的芘暴露下,D型面盘幼虫死亡率随着浓度的升高而增大,呈明显的剂量-效应关系;并且在初始的12 h,高浓度组(16 μg·L-1和32 μg·L-1)就出现了较高的死亡率,分别达到15.40%和14.90%,这表明D型面盘幼虫对芘污染敏感。刘睿智[23]等发现,PAHs引发的胚胎和仔鱼的毒性效应基本上随暴露浓度的升高而升高,并随其结构中苯环数的增加有增强趋势。此外,随着染毒时间延长,死亡率迅速升高,染毒36 h后,从最低浓度组(2μg·L-1)开始,死亡率就显著高于对照组;到72 h时,8、16 和32 μg·L-1浓度组死亡数平均已过半(51.74%),有明显的时间-效应关系。有研究报道,联苯胺类化合物对斑马鱼胚胎发育均具有明显抑制作用,可以造成仔鱼畸形甚至死亡[24]。氯代酚和烷基酚使最初72 h内发育的斑马鱼胚胎出现死亡,且这种影响表现出剂量-效应正相关性[25]。引起死亡率增加的原因可能有以下两种:第一,芘暴露对幼虫组织结构的破坏性,且伴随着浓度的增加而增大;第二,畸形个体的基本功能受阻导致其存活率大大降低,从而影响死亡率。有报道指出,芘通过作用于AhR对发育相关的酶CYPlA产生影响,会导致胚胎发育时期的多种畸形如外周循环系统障碍、贫血、心包囊水肿和神经管细胞非正常死亡等[26-28]。
从实验结果来看,芘暴露致使D型面盘幼虫出现畸形个体,且随着暴露浓度的增大畸形个体出现的数量增多,最高畸形率可达 8.66%(8 μg·L-1,84 h)。其中,8μg·L-1浓度相较于其他浓度组,其畸形率普遍高一些,即从60 h开始至84 h,畸形率分别达到7.58%、7.73%和 8.66%,并与对照组相比存在极显著差异(P<0.01),这说明马氏珠母贝D型面盘幼虫对这个浓度更敏感。此外,污染物暴露的时间与畸形率也存在时间-效应关系,相对于对照组,实验组的畸形率随芘暴露时间的延长呈递增趋势。李瑞霞等[29]发现,在苯并[a]芘、芘和菲暴露下褐菖鲉出现大量畸形胚胎和仔鱼,而芘暴露组畸形情况最多,说明芘的致畸性大于菲和苯并[a]芘。CO2酸化的海水(pH值为7.4左右)对双壳类的牡蛎和紫贻贝幼虫也具有明显的致畸性[30-31],D型面盘幼虫期生命力和抵抗力是胚胎发育最弱的时期[32]。李秀秀等[33]发现,农利灵对斑马鱼胚胎也有明显的致畸性。此外,刘文广等[34]发现,随着发育时间的延长,马氏贝幼虫对CO2酸化海水(pH值为7.4左右)的耐受性逐渐下降,表现为其生长速度下降的同时畸形率和死亡率显著升高。
双壳类软体动物幼虫壳的形成一般受到特殊组织-壳腺的控制,马氏珠母贝在担轮幼虫后期形成壳腺,在面盘幼虫初期壳腺才开始分泌并逐渐形成第一原壳,这一过程称为钙化[6]。在芘暴露下,观察到D型面盘幼虫畸形形态,包括壳缘内凹 、绞合线内凹、不完全的壳、锯齿状的壳缘和凸出覆盖物,以及有些幼虫个体偏小等现象,此外,D型幼虫的畸形程度也随时间加大。因此,我们推测芘污染可能在面盘幼虫钙化的过程中产生了某些毒害作用,从而导致D型面盘幼虫出现畸形个体。总之,芘暴露对马氏珠母贝D型面盘幼虫期有较明显致畸性,但致畸的机理和过程有待进一步研究。
随着时间的推移,芘暴露对马氏珠母贝D型面盘幼虫的LC50呈大幅下降趋势,至60 h后趋于稳定,LC50为43.50 μg·L-1,这说明 60 h 是一个非常敏感而又关键的时期,且染毒60 h之前,D型面盘幼虫对芘的响应敏感。然而在72 h时其LC50为40.17 μg·L-1,84 h 时 LC50仅为 33.87 μg·L-1,出现这种现象的原因很可能是由于当毒性作用60 h后,马氏珠母贝D型面盘幼虫启动了自身的损伤修复机制,从而提高了对芘毒性作用的抵抗能力。
综上所述,实验从个体水平上研究了芘暴露对马氏珠母贝D型面盘幼虫的毒性效应,初步阐明了在芘暴露下,马氏贝D型面盘幼虫的畸形率和死亡率随着芘暴露的浓度和时间的变化情况及其形态学影响。结果表明,芘对马氏珠母贝D型面盘幼虫的死亡率、畸形率均具有明显的影响,并存在显著的浓度-时间-效应关系。本研究为进一步揭示芘对马氏珠母贝早期发育毒理机制打下一定基础,同时为评价芘的生态风险提供了科学依据。
[1] 陈皓,刘颖,刘海玲,等.超高效液相色谱法检测土壤中的多环芳烃[J].色谱,2008,26(6):769-771 Chen H,Liu Y,Liu H L,et al.Determination of polycyclic aromatic hydrocarbons in soil by ultra performance liquid chromatography[J].Chinese Journal of Chromatography,2008,26(6):769-771(in Chinese)
[2] 江锦花,董官真.海洋环境中多环芳烃的污染状况及源解析[J].水资源保护,2008,24(5):48-54 Jiang JH,Dong G Z.Pollution and sources of polycyclic aromatic hydrocarbons in oceanic environment[J].Water Resources Protection,2008,24(5):48-54(in Chinese)
[3] 蔡立哲,马丽,袁东星,等.九龙江口红树林区底栖动物体内的多环芳烃[J].海洋学报,2005,27(5):112-118 Cai L Z,Ma L,Yuan D X,et al.Polycyclic aromatic hydrocarbons in zoobenthos in mangrove swamp in the Jiulong River Estuary [J].Acta Oceanologica Sinica,2005,27(5):112-118(in Chinese)
[4] Gutiérrez JL,Jones CG,Strayer D L,et al.Mollusks as ecosystem engineers:The role of shell production in aquatic habitats[J].Oikos,2003,101(1):79-90
[5] 何毛贤,史兼华,林岳光,等.马氏珠母贝选育子一代生长特性研究[J].热带海洋学报,2006,25(1):19-22 He M X,Shi JH,Lin Y G,et al.Studies on growth traits of firstgeneration of selective line of Pinctadamartensii Dunker[J].Journal of Tropical Oceanography,2006,25(1):19-22(in Chinese)
[6] 金启增,魏贻尧,郭澄联,等.珍珠贝种苗生物学[M].北京:海洋出版社,1992:50
[7] Kurihara H.Effects of CO2-driven ocean acidification on the early developmental stages of invertebrates[J].Marine Ecology Progress Series,2008,373:275-284
[8] 何盛毅,林传旭,何毛贤,等.海洋酸化对马氏珠母贝胚胎和早期幼虫发育的影响[J].生态学杂志,2011,30(4):747-751 He SY,Lin C X,He M X,et al.Impacts of ocean acidification on the development of Pinctada martensii embryo and early larva[J].Chinese Journal of Ecology,2011,30(4):747-751(in Chinese)
[9] 王鹏飞,王梅芳,余祥勇,等.马氏珠母贝胚胎和早期幼虫冷冻的研究[J].广东海洋大学学报,2008,28(1):25-28 Wang PF,Wang M F,Yu X Y,etal.Study on cryopr-eservation of embryo and early larvae of Pinctada martensii[J].Journal of Guangdong Ocean University,2008,28(1):25-28(in Chinese)
[10] 朱文锋.广东省沿海表层沉积物中多环芳烃研究[D].北京:中国科学院研究生院,2007:1-60 Zhu W F.Occurrence of polycyclic aromatic hydrocarbons in coastal sediments off Guangdong Province[D].Beijing:Graduate School of the Chinese Academy of Sciences,2007:1-60(in Chinese)
[11] 罗孝俊.珠江三角洲河流、河口和邻近南海海域水体、沉积物中多环芳烃与有机氯农药研究[D].北京:中国科学院研究生院,2004:1-105 Luo X J.A Study of PAHs and OCPs on water body and sediments of rivers in Pearl River Delta,Pearl River Estuary and offshore of South China Sea[D].Beijing:Graduate School of the Chinese Academy of Sciences,2004:1-105(in Chinese)
[12] Hiromi O,Takayuki K,Kiyoshi I,et al.Motility of spermatozoa obtained from testes of Japanese pearl oyster Pinctada fucata martensii [J]. Fisheries Science,2007,73(1):107-111
[13] His E,Seaman M N L,Beiras R.A simplification of the bivalve embryogenesis and larval development bioassaymethod forwater quality assessment[J].Water Research,1997,31(2):351-355
[14] 解静芳,潘绍先,王军锋,等.气相色谱法估算多环芳烃半数致死浓度[J].中国环境科学,2000,20(1):36-39 Xie JF,Pan SX,Wang JF,et al.The estimation of median tolerance limit of polynuclear aromatic hydrocarbons by gas chromatography[J].China Environmental Science,2000,20(1):36-39(in Chinese)
[15] 刘文广,何毛贤.限食对合浦珠母贝幼虫生长、成活及变态的影响[J].南方水产,2010,6(2):7-12 Liu W G,He M X.Effects of food restriction on growth,survival and metamorphosis of Pinctada fucata [J].South China Fisheries Science,2010,6(2):7-12(in Chinese)
[16] Carls M G,Rice SD,Hose JE.Sensitivity of fish embryos to weathered crude oil:Part I.Low-level exposure during incubation causes malformations,genetic damage,and mortality in larval Pacific herring(Clupea pallasi)[J].Environmental Toxicology and Chemistry,1999,18(3):481-493
[17] Heintz R A,Short JW,Rice S D.Sensitivity of fish embryos to weathered crude oil:Part II.Increased mortality of pink salmon(Oncorhynchus gorbuscha)embryos incubating downstream from weathered Exxon Valdez crude oil[J].Environmental Toxicology and Chemistry,1999,18(3):494-503
[18] Brown E D,Baker T T,Hose JE,et al.Injury to the early life history stages of Pacific herring in Prince William Sound after the Exxon Valdez oil spill[C]//Rice SD,Spies R B,Wolfe D A,et al.Proceedings of the Exxon Valdez Oil Spill Symposium.,Anchorage:American Fisheries Society,1996:448-462
[19] Hose JE,McGurk M D,Marty G D,et al.Sublethal effects of the Exxon Valdez oil spill on herring embryos and larvae:Morphological,cytogenetic,and histopathological assessments,1989-1991[J].Canadian Journal of Fisheries and Aquatic Sciences,1996,53(10):2355-2365
[20] Kocan R M,Hose JE,Brown E D,et al.Pacific herring(Clupea pallasi)embryo sensitivity to Prudhoe Bay petroleum hydrocarbons:Laboratory evaluation and in situ exposure atoiled and unoiled sites in PrinceWilliam Sound[J].Canadian Journal of Fisheries and Aquatic Sciences,1996,53(10):2366-2387
[21] Middaugh D P,Shelton M E,McKenney Jr C L,et al.Preliminary observations on responses of embryonic and larval Pacific herring,Clupea pallasi,to neutral fraction biodegradation products ofweathered Alaska North Slope oil[J].Archives of Environmental Contamination and Toxicology,1998,34(2):188-196
[22] 丛伟.多环芳烃(PAHs)对海洋鱼类胚胎发育的毒性效应研究[D].厦门:厦门大学,2007:1-77 CongW.The developmental toxicity of PAHs on themarine fish embryos[D].Xiamen:Xiamen University,2007:1-77(in Chinese)
[23] 刘睿智.多环芳烃对褐菖鲉成体及其胚胎幼体毒性效应的初步研究[D].厦门:厦门大学,2006:1-78 Liu R Z.Preliminary study on toxic effects of polycyclic aromatic hydrocarbons on adult,embryo and larva of Sebastiscusmarmoratus[D].Xiamen:Xiamen University,2006:1-78(in Chinese)
[24] 刘红玲,于红霞,姜威,等.联苯胺类化合物对斑马鱼胚胎发育毒性的初步研究[J].生态毒理学报,2007,2(1):94-99 Liu H L,Yu H X,JiangW,etal.Preliminary study on zebrafish embryo-toxicity of benzidine congeners[J].Asian Journal of Ecotoxicology,2007,2(1):94-99(in Chinese)
[25] 刘红玲,周宇,许妍,等.氯代酚和烷基酚类化合物对斑马鱼胚胎发育影响的研究[J].安全与环境学报,2004,4(4):3-17 Liu H L,Zhou Y,Xu Y,et al.Investigation of toxicity effect for chlorophenols and alkyl phenols on zebrafish embryos[J].Journalof Safety and Environment,2004,4(4):3-17(in Chinese)
[26] Belair CD,Peterson R E,Heideman W.Disruption of erythropoiesis by dioxin in the zebrafish[J].Developmental Dynamics,2001,222(4):581-594
[27] Kastner P,Mark M,Chambon P.Nonsteroid nuclear receptors:Whatare genetic studies telling us about their role in real life?[J].Cell,1995,83(6):859-869
[28] Moreau R,Daoud G,Masse A,et al.Expression and role of calcium-ATPase pump and sodium-calcium exchanger in differentiated trophoblasts from human term placenta[J].Molecular Reproduction and Development,2003,65(3):283-288
[29] 李瑞霞.苯并[a]芘,芘,菲三种多环芳烃对褐菖鲉仔鱼生长发育的影响[D].厦门:厦门大学,2008:1-75 Li R X.Effects of three polycyclic aromatic hydrocarbons:Benzo[a]pyrene,pyrene and phenanthrene on development of early life stages of Sebastiscusmarmoratus[D].Xiamen:Xiamen University,2008:1-75(in Chinese)
[30] Kurihara H,Kato S,Ishimatsu A.Effects of increased seawater pCO2 on early development of the oyster Crassostrea gigas[J].Aquatic Biology,2007,1(1):91-98
[31] Kurihara H,Asai T,Kato S,et al.Effects of elevated pCO2on early development in the mussel Mytilus galloprovincialis[J].Aquatic Biology,2008,4(3):225-233
[32] 张才学.马氏珠母贝人工育苗的若干关键技术[J].水产科技情报,2005,32(3):102-104
[33] 李秀秀,杨新军,闻洪涛.农利灵对斑马鱼胚胎发育的毒性[J].环境与职业医学,2008,25(4):378-380 Li X X,Yang X J,Wen H T.Study on embryo toxicity of vinclozolin in zebrafish[J].Journal of Environmental& Occupational Medicine,2008,25(4):378-380(in Chinese)
[34] 刘文广,林坚士.海洋酸化对马氏珠母贝受精及早期发育的影响[J].海洋科学,2012,36(4):19-23 Liu W G,Lin JL.Effect of ocean acidification on fertilization and early developmentof the pearl oyster Pinctadamartensii Dunker[J].Marine Sciences,2012,36(4):19-23(in Chinese) ◆
