苜蓿黄酮对雌性大鼠生长和繁殖性能的影响
2013-08-20王伟马登坦翟新莹王成章田苗苗严学兵
王伟,马登坦,翟新莹,王成章,田苗苗,严学兵
(河南农业大学牧医工程学院,河南 郑州450002)
紫花苜蓿(Medicago sativa)系豆科苜蓿属植物,是重要的饲料植物,有“牧草之王”的美誉,紫花苜蓿适口性好,产量高,营养丰富,在世界各地都有广泛的种植[1]。在我国《名医别录》、《本草纲目》中都有记载。随着畜牧业的大力发展,紫花苜蓿已经被广泛的应用于养殖生产中,并取得了良好的效果。2005年底全国苜蓿种植面积曾达到200万hm2,居世界第5位。随着国家农业产业结构的调整,苜蓿产业的重要地位突显出来,广大苜蓿经营者的热情也不断高涨,并掀起了一轮新高潮[2]。由于人们生活水平的不断提高,对畜产品的要求也发生了转变,安全、绿色、健康食品越来越成为人们的首选,因此苜蓿中生物活性成分的研究和应用逐渐引起了人们的关注[3]。目前国内外学者对紫花苜蓿的主要化学成分已经确定,主要包括黄酮、皂甙、香豆素类、多糖、氨基酸、微量元素等[4]。苜蓿黄酮是紫花苜蓿的一种生物活性成分,黄酮具有类雌激素样作用,目前根据结构可以分为:黄酮及苷类、黄酮醇及苷类、异黄酮类、二氢黄酮等[5]。夏素银等[6]在蛋鸡饲粮中添加苜蓿草粉可以改善蛋品质和蛋黄颜色。彭保安等[7]通过在不同水平的苜蓿鲜草替代精料,发现母猪的繁殖性能明显改善,初生窝产仔猪总数、初生窝产活仔数等指标都有增加。张丽娜[8]在蛋鸡日粮中添加500,1 000mg/kg的苜草素,对58~65周龄的蛋鸡产蛋率有显著提高。但也有一些不同结果的研究,Baker等[9]报道,在妊娠期日粮中添加脱水5%的紫花苜蓿,并没有改善母猪的繁殖性能。通过对配种期、怀孕期、泌乳期,饲喂脱水18%的紫花苜蓿,也没有显著提高或降低母猪的繁殖性能[10]。由于黄酮具有雌激素样作用,这种雌激素样作用可能会影响到母畜的性激素、排卵、胚胎的存活等因素。早在19世纪40年代,人们就发现在牧草丰沛的牧场上,母羊出现不孕综合症是由于食入过多的含异黄酮类的芒柄花素红三叶(Trifolium pratense)引起的[11]。因此,通过对紫花苜蓿中的具体生物活性物质——苜蓿黄酮的研究,了解其对不同生理阶段雌性动物(未性成熟和性成熟)是否存在雌激素样作用,在不同阶段生理作用有何不同,对动物繁殖是否发挥正面作用。
1 材料与方法
1.1 实验动物与材料
SPF级65日龄SD雌鼠75只、21日龄雌鼠25只,由河南省实验动物中心提供。雌鼠自由采食饮水,室温控制在18~22℃,湿度在40%~70%,光照时间14h光/10h暗。试验期为2011年9-11月,在河南农业大学草业科学实验室进行。苜蓿总黄酮纯度35%,由西安和霖生物工程有限公司生产。己烯雌酚由合肥久联制药有限公司生产。
1.2 试验分组
65日龄雌鼠分为5组,每组15只,每只大鼠作为1个重复。分别为空白对照组、苜蓿黄酮120mg/kg、苜蓿黄酮400mg/kg、苜蓿黄酮1 200mg/kg、己烯雌酚0.5mg/kg[12]。连续灌胃28d。21日龄雌鼠分为5组,每只大鼠作为1个重复。每组5只,分别为空白对照组、苜蓿黄酮120mg/kg、苜蓿黄酮400mg/kg、苜蓿黄酮1 200 mg/kg、己烯雌酚0.5mg/kg。连续灌胃14d。每只大鼠灌胃2mL。
1.3 样品采集及处理
2批试验大鼠在灌胃结束,禁食1d,将雌鼠称重记录后,每组随机处死5只大鼠,取卵巢、子宫组织器官。分别将卵巢、子宫在电子天平上称重并及时放入液氮中保存。采用心脏采血的方法,采集血液3mL放入4℃冰箱中过夜后,3 000r/min下20min,取上清液血清放入-20℃中保存。
1.4 激素的测定
采集的大鼠血清在郑州第五人民医院,采用微粒子化学发光免疫分析法测定孕酮(progesterone,P)、雌二醇(estradiol,E2)、催乳素(prolactin,PRL)、生长激素(growth hormone,GH)。
1.5 统计方法
数据采用SPSS 13.0分析软件。单因素方差分析,数据相关分析结果采用平均值±标准差(mean±SD)表示。P<0.05为差异有显著性。
2 结果与分析
2.1 苜蓿黄酮对雌鼠采食量及生长性能的影响
通过对大鼠每天采食量的分析发现,苜蓿黄酮对大鼠的采食量可能有一定的影响,并且对性成熟和未性成熟的影响不同。对性成熟大鼠,苜蓿黄酮3个剂量组的采食量均呈现在一定时间内采食量上升,随后又下降的趋势。对未性成熟大鼠,除低剂量组外,其他各试验组均呈现先下降后上升的趋势(表1和2)。

表1 各剂量组每周平均每只性成熟大鼠采食量Table 1 Feed intakes of one sexual mature rat in different dose group on every week
对于生长性能,苜蓿黄酮3个剂量组对性成熟大鼠的日增重和空白对照组相比都表现出下降趋势,但不存在显著差异(P>0.05)。而己烯雌酚组的日增重和空白对照相比显著下降(P<0.05)。苜蓿黄酮3个剂量组之间相比,高剂量组日增重和空白对照相比下降较多,下降11.94%(P>0.05)。未性成熟的日增重和性成熟大鼠情况相似,己烯雌酚组的日增重和空白对照相比显著下降(P<0.05)。其中中剂量组和空白对照相比下降较多,下降了15.76%(P>0.05)。说明苜蓿黄酮雌激素样作用,有可能抑制大鼠的增重(表3和4)。

表2 各剂量组每周平均每只未性成熟大鼠采食量Table 2 Feed intakes of one immature rat in different dose group on every week

表3 各剂量组性成熟大鼠日增重Table 3 Daily body gain of sexual maturity rats in different dose group

表4 各剂量未性成熟大鼠日增重Table 4 Daily body gain of immaturity rats in different dose group
2.2 苜蓿黄酮对性成熟雌鼠产仔数、初生窝重的影响
通过对雌鼠配种后,对产仔数及初生窝重的统计,苜蓿黄酮中、高剂量组的产仔数比空白对照分别提高了0.4%和2.2%,但差异不显著(P>0.05)。中、高剂量组苜蓿黄酮初生窝重比空白对照组分别提高了5.14%和0.10%,但差异不显著(P>0.05)。而己烯雌酚组产仔数、初生窝重则显著降低(P<0.05)(表5)。
2.3 苜蓿黄酮对雌鼠生殖器官的影响
通过对性成熟和未性成熟雌鼠的卵巢和子宫称重比较,性成熟雌鼠中低剂量组的卵巢湿重/系数明显低于空白对照组(P<0.05),子宫湿重/系数显著高于空白对照组(P<0.05),存在显著性差异。此外,苜蓿黄酮各剂量组的性成熟大鼠子宫湿重/系数均高于空白对照组。在未性成熟的雌鼠中,低、中剂量组的卵巢湿重显著低于空白对照组(P<0.05),苜蓿黄酮各剂量组子宫湿重和空白对照组相比不存在显著性差异(P>0.05)。在未性成熟的雌鼠生殖器官的数据中,苜蓿黄酮3个剂量组的卵巢、子宫湿重都随剂量的升高增重(表6~9)。
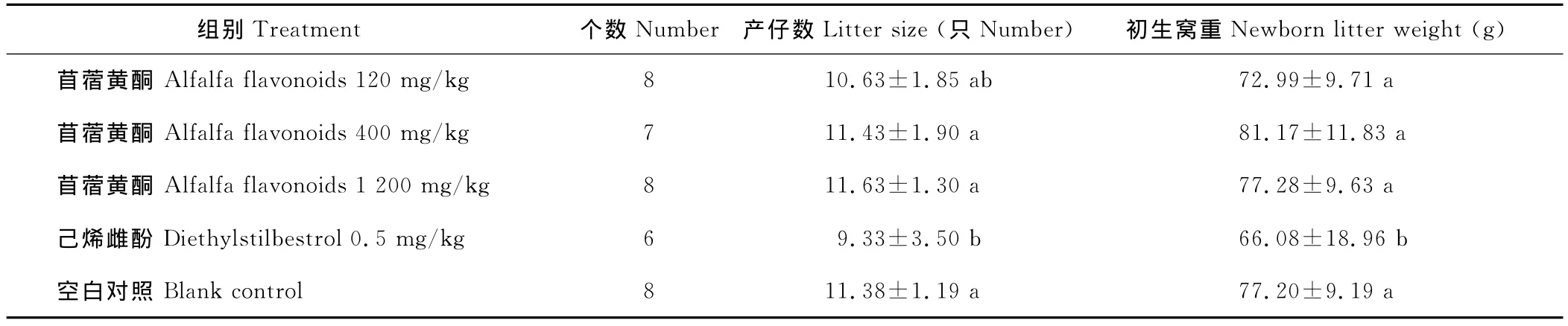
表5 各剂量组性成熟大鼠产仔数、初生窝重Table 5 Litter size,newborn litter weight of sexual maturity rats in different dose group
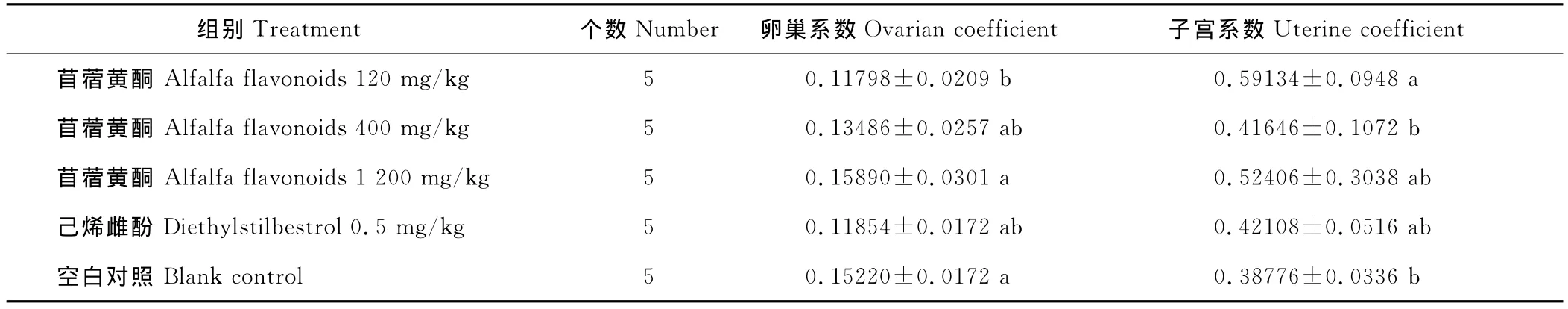
表6 各剂量组性成熟大鼠卵巢、子宫系数Table 6 Ovarian or uterine coefficient of sexual maturity rats in different dose group

表7 各剂量组未性成熟大鼠卵巢、子宫系数Table 7 Ovarian or uterine coefficient of immaturity rats in different dose group

表8 各剂量组性成熟大鼠卵巢、子宫湿重Table 8 Ovarian or uterine weight of sexual maturity rats in different dose group

表9 各剂量组未性成熟大鼠卵巢、子宫湿重Table 9 Ovarian or uterine weight of immaturity rats in different dose group
2.4 苜蓿黄酮对雌鼠血清中雌二醇、孕酮、催乳素的影响
通过对性成熟和未性成熟大鼠灌胃苜蓿黄酮发现,苜蓿黄酮对大鼠血清中的性激素存在影响,结果表明,已性成熟的大鼠,在120mg/kg的低剂量组作用下,血清中的雌二醇显著升高,并和空白对照组、己烯雌酚组之间存在显著性差异(P<0.05)。其他各剂量组的雌二醇和空白对照组、己烯雌酚组之间尽管差异不显著,但均高于对照组。此外,苜蓿黄酮的3个剂量组,随着剂量的增加,血清中的雌二醇呈现降低的趋势,其中低剂量组和高剂量组之间存在显著差异(P<0.05)。催乳素和孕酮在苜蓿黄酮各剂量组与空白对照组之间均不存在显著性差异(P>0.05),但苜蓿黄酮各剂量组和己烯雌酚组的催乳素均高于空白对照,说明黄酮的雌激素样作用对大鼠乳腺的发育有一定的影响。对未性成熟的雌鼠,各试验组之间激素均不存在显著性差异,但苜蓿黄酮3个剂量组的雌二醇均高于空白对照组,并且苜蓿黄酮3个剂量组,随着剂量的升高呈现升高的趋势(表10和11)。

表10 各剂量组性成熟大鼠激素含量Table 10 Hormone level of sexual maturity rats in different dose group

表11 各剂量组未性成熟大鼠激素含量Table 11 Hormone level of immaturity rats in different dose group
3 讨论
随着人类社会的发展,人们越来越多的接触到各种内分泌干扰化学物质(EDCs),而根据世界卫生组织(WHO)2002年的报道,长期接触此类物质会干扰激素分泌系统,影响生殖健康。黄酮作为植物雌激素的一种,可以和内生性雌激素相互作用。黄酮可以结合并激活雌激素受体(ERs),这种外源性雌激素可以干扰或消除内源性雌激素在体内的平衡,从而影响改变性行为、发情期、妊娠期、怀孕期、泌乳期的生理功能。植物雌激素不是典型的雌激素激动剂,异黄酮的雌激素活性,可能是在特定细胞类型或组织的特殊时期的共同催化或联合抑制的存在或补充下产生作用。这与ERα和ERβ在公母繁殖和发育系统中,交叉但不相同的表达模式有关[13]。
3.1 苜蓿黄酮对性成熟大鼠繁殖性能的影响
产仔数、初生窝重作为动物繁殖性能评价的重要指标,在产仔数、初生窝重方面,使用不同的实验动物,相同的实验动物不同生理阶段得到的结论也各不相同。王明伟等[14]在妊娠母猪预产期前20d,日粮中添加60 mg/kg的大豆黄酮,可以显著提高仔猪的初生重,21d断奶体重,平均断奶体重。对妊娠后期的母猪饲料中添加大豆黄酮,结果显著提高了仔猪初生窝重、20日龄窝重及存活率。原因可能是和大豆黄酮提高母畜及仔猪的免疫能力有关[15]。陈乃富等[16]通过蕨菜黄酮对果蝇的繁殖性能的研究发现,在培养基中添加0.01%,0.03%,0.09%的蕨菜黄酮,每个培养基10只雌蝇,10只雄蝇。结果各剂量组的子代果蝇都显著高于空白对照。尹艳云等[17]在妊娠前期饲喂大豆异黄酮,结果产仔数及初生窝重都不存在显著提高,而在妊娠期间饲喂大豆异黄酮,则显著提高了产仔数。本试验中,通过对性成熟大鼠配种发现,中、高剂量组的苜蓿黄酮的产仔数和空白对照组相比,分别提高0.4%(P>0.05)和2.2%(P>0.05)。在初生窝重方面,苜蓿黄酮中、高剂量组的初生窝重均高于空白对照组,分别比空白对照组增重5.14%(P>0.05)、0.1%(P>0.05)。因此,在本试验中,苜蓿黄酮对大鼠的产仔数及初生窝重均未出现显著性差异。说明在妊娠前期灌胃苜蓿黄酮对产仔数、初生窝重没有明显影响,这与尹艳云等[17]的结果一致。但己烯雌酚则是显著降低了产仔数和初生窝重(P<0.05)。表明己烯雌酚作为一种人工合成的雌激素,对雌鼠的繁殖性能伤害极大。而苜蓿黄酮的这种弱雌激素样作用,通过对产仔数和初生窝重两方面的数据分析,则没有产生不利的一面。本试验和上述相关文献中大豆黄酮的显著性效果是不太一致的。这可能与各试验中黄酮的添加量,黄酮的含量以及动物的不同生理时期有关。
黄酮作为一种外源植物雌激素,性激素的分泌和下丘脑—垂体—卵巢性腺轴有相关性。黄酮的雌激素样作用,通过影响下丘脑—垂体—卵巢性腺轴,进而影响其对激素的分泌。用大豆黄酮(3mg/kg)饲喂330日龄罗曼蛋鸡,T3、T4和孕酮水平均比对照组显著升高[18]。聂芙蓉等[19]在十二指肠灌注大豆黄酮能显著地提高血清中T3、T4、GH 和E2的水平(P<0.01)。朱河水等[20]在泌乳后期的奶牛日粮中添加10mg/kg的大豆黄酮,结果血浆中E2、GH和PRL的含量都有所提高,当饲喂到第30天的时候,GH、PRL含量显著升高,分别提高了18.33%(P<0.05)、42.46%(P<0.01),血浆中T3和T4的水平有升高的趋势,但差异不显著。本试验中尽管在配种前饲喂苜蓿黄酮,对大鼠提高产仔数、初生窝重没有显著性影响。但苜蓿黄酮对性激素以及性器官的发育还是有一些显著性影响。苜蓿黄酮对雌二醇的影响明显高于催乳素、孕酮及生长激素。试验结果表明,性成熟大鼠在外源性雌激素苜蓿黄酮的影响下,使雌二醇的分泌量增加。特别是灌胃120mg/kg的苜蓿黄酮显著增加了性成熟大鼠雌二醇的分泌(P<0.05)。但不同剂量的黄酮对不同生理阶段的大鼠的性腺轴的影响也是不同的,从而血清中激素含量的变化也不相同。灌胃120mg/kg的苜蓿黄酮,未性成熟大鼠的雌二醇分泌量尽管增加,但未出现显著性差异(P>0.05)。低剂量的苜蓿黄酮除了对内分泌显著性影响外,对性器官也有显著性影响,低剂量的苜蓿黄酮显著降低了性成熟大鼠卵巢湿重及系数(P<0.05),显著提高了子宫湿重及系数(P<0.05)。中、高剂量的苜蓿黄酮对大鼠激素和生殖器官未呈现显著性影响,可见苜蓿黄酮对二者的影响并非呈线性关系,说明在大鼠体内低剂量的苜蓿黄酮,产生了明显的雌激素样作用。卵巢、子宫作为雌性哺乳动物的重要生殖器官,在生殖系统中扮演着重要的角色。卵巢的发育与衰老与内外激素的调节及其他因素的调控有密切联系,在其发育过程中任何异常的改变都可能对卵巢产生影响[21]。子宫容量是限制窝产仔数的重要决定因素。因此,产仔数的高低与卵巢的发育、排卵是否良好以及子宫容量的大小有密切联系。目前的研究发现,从原始卵泡发育形成优势卵泡,雌激素在这个过程中有决定性作用[22]。尽管苜蓿黄酮对内分泌及性器官的影响,显示了苜蓿黄酮的雌激素样作用,但这种雌激素样作用在本实验中没有显著改善或降低大鼠繁殖性能。
3.2 苜蓿黄酮对未性成熟大鼠繁殖性能的影响
苜蓿黄酮对未性成熟大鼠性激素的影响与性成熟大鼠相似,和基础日粮组比都提高了E2的分泌,雌二醇是随着剂量的增加,分泌不断增加,呈线性趋势,但差异不显著(P>0.05)。本试验中,未性成熟大鼠各剂量组的卵巢湿重都低于空白对照组。低、中剂量组的苜蓿黄酮卵巢湿重显著降低(P<0.05),与性成熟大鼠的结果比较一致。这说明苜蓿黄酮的雌激素样作用,可能影响了卵巢的分化,抑制了卵巢发育。但在子宫方面,己烯雌酚组明显升高了子宫湿重(P<0.05),但苜蓿黄酮各剂量组的子宫湿重没有显著升高,说明在子宫内未呈现明显的雌激素样作用。卵巢或子宫重量的变轻、缩小,可能是卵巢或子宫衰老的产生。这与Awoniyi等[23]的研究结果近似,他们使在母体内的仔鼠接触染料木素,结果雌鼠成年后,子宫、卵巢的重量都明显减轻。此外,采食苜蓿的幼年母羊,与对照相比卵巢重量降低[24]。但也有不同研究结果,Casanova等[25]发现,给母鼠饲喂0.02%或1.00%的染料木素,仔鼠出生后,子宫系数增加,差异极其显著。低剂量刺芒柄花素使去势大鼠的子宫系数有所提高,而高剂量的则使子宫系数升高,且和对照组极差异[26]。给出生后1~5d的小鼠口服染料木黄酮,出生后5d的小鼠子宫增重[27,28]。饲喂大豆异黄酮的雌鼠,子宫重量显著增加[29]。不同的结论,极有可能与黄酮添加量密切相关。因此,苜蓿黄酮对生殖器官的影响,和剂量具有相关性。这种相关性可能还和不同生理阶段的生殖器官的特殊时期有关。
3.3 苜蓿黄酮对雌鼠生长性能的影响
本试验对雌鼠每天的采食量进行分析发现,苜蓿黄酮对雌鼠采食量具有一定的影响。体重维持及能量稳态和采食量有密切的联系,而二者又受高级中枢神经系统的调控,苜蓿黄酮作为一种外源雌激素,干扰了下丘脑对摄食与能量平衡之间的调控。对于本试验,性成熟雌鼠采食量呈现先上升后下降的趋势,以及未性成熟雌鼠采食量先下降后上升的趋势的结果表明,苜蓿黄酮对下丘脑的影响,可能是依赖于剂量积累。而苜蓿黄酮对性成熟和未性成熟雌鼠影响相反的结果,也进一步说明苜蓿黄酮干扰了下丘脑—垂体—卵巢轴反馈调节。
朱宇旌等[30]通过苜蓿黄酮对生长性能的研究发现,40,120mg/kg的苜蓿黄酮对雌鼠的生长性能没有促进作用,而400mg/kg的苜蓿黄酮使雌鼠的日增重和对照组相比有明显下降的趋势。给大鼠皮下注射大豆黄酮(30mg/kg)16d,雌性大鼠日增重极显著降低(P<0.01)[31]。本试验的结果与这两个结论相似。本试验中己烯雌酚使性成熟和未性成熟雌鼠日增重均显著降低(P<0.05),苜蓿黄酮各剂量组,雌鼠日增重也呈现下降趋势。日增重下降的原因和体内激素分泌有关,内源性雌激素和生长激素之间存在相关性,苜蓿黄酮作为外源雌激素可以干扰下丘脑、垂体对激素的分泌及反馈调剂机制,造成相关激素的增加或降低,导致动物肌肉的增加。苜蓿黄酮这种外源性雌激素是通过与ERs受体相结合,影响内源性雌激素的分泌,但这种结合是对内源性雌激素的分泌呈现激活作用还是抑制作用,与苜蓿黄酮的含量以及动物的不同生理时期有密切联系。这同时也说明植物雌激素不是典型的雌激素激动剂,异黄酮的雌激素活性,可能是在特定细胞类型或组织的特殊时期的共同催化或联合抑制的存在或补充下产生作用的[32]。
4 结论
关于植物雌激素样作用,对动物繁殖性能的影响,目前还没有明确的结论。有正面的,也有负面的。对于生长性能,苜蓿黄酮对大鼠生长没有呈现促进作用。并且抑制了大鼠的日增重。本实验通过妊娠前连续28d灌胃苜蓿黄酮,对雌鼠繁殖性能的结果分析显示,苜蓿黄酮的类雌激素样作用,对雌鼠的内分泌激素及生殖器官有一定的影响,而且不同剂量的苜蓿黄酮对不同生理阶段雌鼠的内分泌激素和生殖器官的影响也各不相同。结果显示,低剂量的苜蓿黄酮对雌二醇及卵巢、子宫的影响显著。其显著降低了性成熟和未性成熟大鼠卵巢湿重及系数(P<0.05),显著提高了性成熟子宫湿重及系数(P<0.05)。但这些影响都没有明显提高或降低产仔数、初生窝重。改善动物的繁殖性能是畜牧业的一个重要课题,动物繁殖是一个复杂的过程,紫花苜蓿作为一种优质牧草,其生物活性成分对动物的生长及繁殖的影响,还需要进一步的深入研究。
[1] 王胜超,张国刚.紫花苜蓿化学成分的研究[J].中南药学,2008,6(6):690-693.
[2] 曹宏,章会玲,盖琼辉,等.22个紫花苜蓿品种的引种试验和生产性能综合评价[J].草业学报,2011,20(6):219-229.
[3] 王成章,王彦华,史莹华,等.苜蓿皂苷对断奶仔猪脂质代谢、抗氧化和免疫的影响[J].草业学报,2011,20(4):210-218.
[4] 何春年,高微微,徐文燕,等.紫花苜蓿黄酮类化学成分的研究[J].中草药,2008,39(12):1783-1785.
[5] 朱见明,李娜,张亚军,等.苜蓿黄酮的研究进展[J].草业科学,2009,26(9):156-162.
[6] 夏素银,王成章,詹发柏,等.苜蓿草粉饲粮添加纤维素酶对蛋鸡生产性能、蛋品质及养分利用率的影响[J].草业学报,2011,20(5):183-191.
[7] 彭宝安,高永革,王成章,等.妊娠母猪饲粮中不同苜蓿鲜草替代量对其生产性能的影响[J].草业学报,2011,20(4):219-228.
[8] 张丽娜.苜草素对蛋鸡生产性能及其鸡蛋与组织脂质的影响[D].扬州:扬州大学,2010.
[9] Baker D H,Molitoris B A,Jensen A H,et al.Sequece of protein feeding and value of alfalfa meal and fish meal for pregnant gilts and sows[J].Journal of Animal Science,1974,38(2):325-329.
[10] Baker D H,Harmon B G,Jensen A H.Value of alfalfa meal and wheat bran in diets for swine during prefarrowing and lactation[J].Journal of Animal Science,1974,39(5):838-840.
[11] Adams N R.Organizational and activational effects of phytoestrogens on the reproductive tract of the ewe[J].Experimental Biology and Medicine,1995,208(1):87-91.
[12] 崔洪斌,迟晓星,李白祥,等.大豆异黄酮对雄性大鼠生殖系统的影响[J].卫生毒理学杂志,2003,17(3):164-166.
[13] Matthews J,Gustafsson J A.Estrogen signaling:a subtle balance between ER alpha and ER beta[J].Molecular Interventions,2003,3(5):281-292.
[14] 王明伟,王子荣,杨开伦.几种添加物对猪乳成分、仔猪成长及部分血液生化指标的影响[J].饲料工业,2005,26(9):37-40.
[15] 张荣庆,韩正康,陈杰,等.大豆黄酮对母猪免疫功能和血清及初乳中GH、PRL、SS水平的影响[J].动物学报,1995,41(2):201-206.
[16] 陈乃富,张莉,韩邦兴,等.蕨菜黄酮对果蝇寿命和繁殖性能的影响[J].营养学报,2007,9(6):625-626.
[17] 尹艳云,刘京威,鲍文玉,等.饲喂雌鼠大豆异黄酮对后代雌性生殖性状的影响[J].中国实验动物学报,2009,17(4):299-302.
[18] 刘燕强,韩正康.异黄酮植物雌激素—大豆黄酮对产蛋鸡生产性能及其血液中几种激素水平的影响[J].中国畜牧杂志,1998,34(3):9-10.
[19] 聂芙蓉,王老七,王艳玲.大豆黄酮对山羊血液中几种内源性激素水平的影响[J].安徽农业科学,2007,35(21):6442.
[20] 朱河水,王月影,王艳玲,等.大豆黄酮对奶牛泌乳性能及血浆中激素水平的影响[J].中国农学通报,2006,22(5):20-22.
[21] 庄小兰,傅玉才,许锦阶,等.槲皮素对大鼠卵巢发育和卵巢寿命的影响[J].中国组织工程研究与临床康复,2010,14(15):2727-2730.
[22] Kessel Bruce,Hu Y X,Jia X C,et al.Autocrine role of estrogen in augmentation of luteinizing hormone receptor formation in cultured rat granulosa cells[J].Biology of Reproduction,1985,32:1038-1050.
[23] Awoniyi C A,Roberts D,RaoVeeramachaneni D N,et al.Reproudctive sequelae in female rats after in utero and neonatal exposure to the phytoestrogen genistein[J].Fertility and Sterility,1998,70(3):440-447.
[24] 黄金明,王根林,柳尧波.植物雌激素对动物生殖及生殖内分泌的影响[J].动物医学进展,2003,24(3):18-21.
[25] Casanova M,You L,Gaido K W,et al.Developmental effects of dietary phytoestrogens in Sprague-Dawley rats and interactions of genistein and daidzein withrat estrogen receptors alpha and beta in vitro[J].Toxicological Sciences,1999,51(2):236-244.
[26] 幸奠霞,刘先玲,薛存宽,等.刺芒柄花素雌激素样作用及对大鼠心房雌激素受体表达的影响[J].中药材,2010,33(9):1445-1449.
[27] Jefferson W N,Daniel Doerge,Elizabeth Padilla-Banks,et al.Oral exposure to genistin,the glycosylated form of genistein,during neonatal life adversely affects the female reproductive system[J].Environmental Health Perspectives,2009,117(12):1883-1887.
[28] Jefferson W N,Elizabeth Padilla-Banks,Goulding E H,et al.Neonatal exposure to genistein disrupts ability of female mouse reproductive tract to support preimplantation embryo development and implantation[J].Biology of Reproduction,2009,80:425-431.
[29] 张文众,李宁,李蓉.大豆异黄酮的雌激素样作用研究[J].卫生研究,2008,37(6):707-709.
[30] 朱宇旌,张勇,宁自利,等.苜蓿异黄酮提取物对小鼠生长和免疫功能的影响[J].营养学报,2008,30(6):615-618.
[31] 王国杰,韩正康,陈伟华.大豆黄酮对大鼠肌肉生长和几种内源激素水平的影响[J].动物学研究,1995,16(1):23-29.
[32] Christopher Robin Cederroth,Céline Zimmermann,Serge Nef.Soy,phytoestrogens and their impact on reproductive health[J].Molecular and Celluar Endocrinology,2012,355:192-200.
