阿托伐他汀对Aβ1-40诱导AD模型的氧化应激及凋亡的影响
2013-08-20马兴荣孙治坤刘艳茹贾延劼张博爱
马兴荣 孙治坤 刘艳茹 贾延劼 张博爱△
1)郑州大学第一附属医院神经内科 郑州 450052 2)河南省人民医院神经内科 郑州 450003
阿尔茨海默病(Alzheimer disease,AD)是以进行性认知功能障碍和记忆力减退为主要临床表现的中枢神经系统退行性疾病,Aβ样淀粉蛋白沉积是其重要的病理学特征。越来越多的证据表明Aβ样淀粉蛋白沉积引起的氧化应激和细胞凋亡是AD的重要发病机制[1-2]。大量的临床研究表明,他汀类药物可以明显降低AD的发病率,减缓AD的进展,其机制尚未完全清楚[3]。本研究我们通过阿托伐他汀干预大鼠AD模型,观察其对脑组织内丙二醛(MDA)、超氧化物歧化酶(SOD)及谷胱甘肽(GSH)活性的影响,及Bcl-12和Caspase-3蛋白表达的影响,来探讨阿托伐他汀对AD的神经保护作用。
1 材料与方法
1.1 实验动物 雄性SD大鼠40只,体质量250~300g(河南省实验动物中心),随机分为空白对照组、假手术组、β淀粉样蛋白(Aβ)组、Aβ+生理盐水组、Aβ+阿托伐他汀组,每组8只。
1.2 动物模型的制作及分组 参照我们自己的制作模型方法[4],用无菌生理盐水将 Aβ1-40(由首都医科大学宣武医院多肽室提供)稀释为10g/L,37℃孵育1周,使其变为聚集状态的Aβ。Aβ组、Aβ+生理盐水、Aβ+阿托伐他汀组:大鼠以体积分数为10%水合氯醛腹腔注射麻醉(0.4g/kg)后,固定于脑立体定向仪上(由郑州大学人体解剖学教研室提供),选择双侧海马CA1区为注射靶区,于前囟向后3.0mm、中线旁开2.0mm处,用牙科钻钻开颅骨,暴露硬脑膜,微量注射器自脑表面垂直进针2.8mm,将Aβ溶液1μL缓慢注入,留针5min,以保证溶液充分弥散,缓慢撤针,缝合切口,常规饲养。假手术组注入等体积生理盐水。空白对照组不做任何处理。Aβ+阿托伐他汀组给予阿托伐他汀20mg/(kg·d)灌胃,术前1周至术后4周,1次/d,共5周。Aβ+生理盐水组,与相同的时间点给予等量生理盐水灌胃,方法同上,共5周,其余各组不做治疗干预。
1.3 大鼠皮层、海马组织 MDA、SOD及GSH活性检测各组大鼠在行为学检测结束后,随机取各组4只大鼠行MDA、SOD及GSH活性检测,将大鼠断头取脑,在冰盒上剥离皮层与海马组织并称质量,按照重量和体积比1:10的比例,加入预冷的0.9%生理盐水冰浴匀浆,4℃离心(3 000r/min,10min),取上清液,立即测定。(1)MDA 活性测定:过氧化脂质降解产物中的MDA可与硫代巴比妥酸(TBA)缩合,形成红色产物,在540nm处有最大吸收峰。MDA活性以nmol·mg-1Pro表示。(2)SOD活性测定:采用黄嘌呤氧化法,SOD活性以每毫克组织蛋白中SOD抑制率达50%时所对应的SOD量为一个亚硝酸盐单位(U·mg-1Pro)表示。(3)GSH活性检测:二硫代二硝基甲酸与巯基化合物反应时能产生一种黄色化合物,在405nm测吸光度值。GSH活性以nmol·mg-1Pro表示。具体操作按试剂盒说明进行。
1.4 蛋白印迹技术检测大鼠海马区Bcl-2及Caspase-3的表达 各组大鼠在行为学检测结束后,各组剩余4只大鼠行蛋白印迹技术检测大鼠海马区Bcl-2及Caspase-3的表达,各组大鼠断头处死后迅速取出大脑组织,用预冷的PBS液冲去表面血迹,置冰盘上快速分离出双侧海马组织,加入蛋白裂解液,冰上裂解、匀浆,5 000r/min离心15min,提取总蛋白,BCA法测蛋白浓度。经10%SDS-PAGE凝胶电泳、转膜、封闭后,加入一抗孵育过夜。加入标记辣根过氧化酶的二抗,室温下孵育1h,ECL显示。β-actin为内参照,实验在相同的条件下重复3次。
1.5 统计学处理 采用统计软件SPSS 16.0进行数据处理。数据用(±s)表示,对结果进行方差齐性检验,符合条件后进行后续分析,多组数值间比较采用单因素方差分析,方差分析后多个样本间比较用LSD法。取α=0.05作为检验水准。
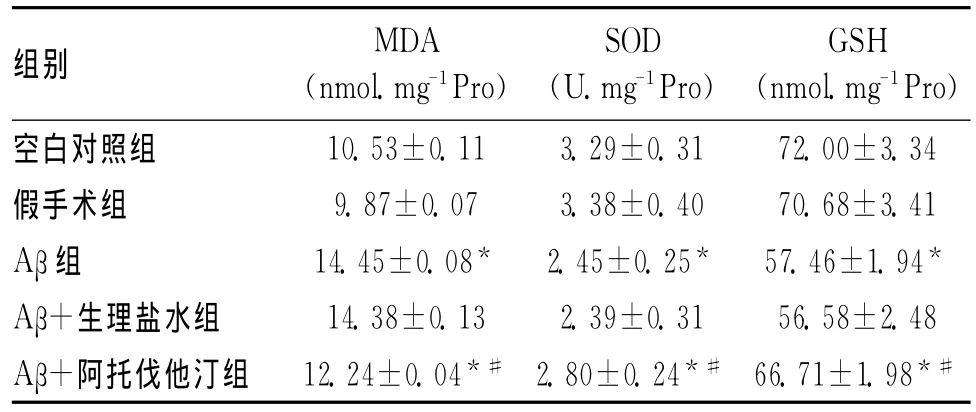
表1 阿托伐他汀对AD大鼠模型皮层、海马MDA、SOD及GSH活性的影响
2 结果
2.1 阿托伐他汀对AD大鼠模型皮层、海马的 MDA、SOD及GSH活性的影响 与空白对照组相比,Aβ组大鼠脑皮质、海马组织内 MDA的活性明显升高(P<0.05)、SOD及GSH的活性明显降低(P<0.05);与 Aβ组相比,Aβ+阿托伐他汀治疗治疗组大鼠脑皮质、海马组织内MDA的活性明显降低(P<0.05)、SOD及 GSH 的活性明显升高(P<0.05)。
2.2 阿托伐他汀对 AD大鼠模型海马组织Bcl-2及Caspase-3表达的影响 Aβ组与空白对照组相比Bcl-2表达明显下降(P<0.05),Caspase-3表达明显升高(P<0.05);Aβ+阿托伐他汀治疗组与Aβ组相比Bcl-2表达上升(P<0.05),Caspase-3表达下降(P<0.05)。

3 讨论
AD是痴呆中最常见的一种类型,随着人类社会的老龄化进展,发病率在不断升高,对于其防治的研究也成为目前研究的热点。他汀类药物作为一种调脂药物,目前在临床上广泛用于降低胆固醇水平和改善冠脉疾病患者的预后。近期他汀类药物降脂作用以外的药理作用,受到越来越多的关注,如其抗炎症和抗氧化的作用。近期大量的研究结果显示,他汀类药物可以降低AD的发病率,改善AD患者的认知功能和延缓AD的病程进展[5-6]。但目前他汀类药物对于AD的保护作用机制仍不十分明确,总结近几年的试验显示,他汀类药物对AD的保护作用机制可能与以下几方面有关[7]:(1)减少β淀粉样蛋白的产生;(2)降低血浆中胆固醇和24S胆固醇的含量,保护神经细胞;(3)减少载脂蛋白E(ApoE),阻止老年斑块的形成;(4)抗炎作用;(5)改善血液供应;(6)阻断异戊二烯化过程。
诸多实验研究表明脑组织的氧化应激反应参与了AD的发生和发展[8],且氧化应激是AD的主要致病因素,而且在一定程度上氧化应激假说可以综合其他几种假说。MDA、SOD和GSH是与机体氧化还原状态密切相关的物质,直接反映机体的氧化还原状态。MDA是氧自由基引发的生物膜不饱和脂肪酸过氧化反应的代谢产物,MDA的含量可以反映体内脂质过氧化的程度并间接反映引起脂质过氧化的氧自由基水平。因此组织内MDA含量可以反映组织中氧自由基水平和脂质过氧化反应的强弱[9]。SOD是生物体最主要的自由基清除酶,可催化O2发生歧化反应,通过歧化反应清除体内生成的氧自由基,阻断自由基病理性连锁反应,对保护细胞不受氧自由基损伤有重要作用,通过测定SOD活性可以反映组织清除自由基的能力。GSH在体内广泛存在,特异性催化还原型谷胱甘肽对过氧化氢的还原反应,起到保护细胞膜结构和功能的作用[10-11]。因此,我们对MDA、SOD及GSH的活性进行了检测,结果发现,Aβ组与空白对照组相比,MDA的活性明显升高,SOD及GSH的活性明显降低(P<0.05);同时,我们还发现,Aβ+阿托伐他汀治疗组 MDA活性较 Aβ组明显降低(P<0.05);SOD及GSH活性较Aβ组明显升高(P<0.05)。我们的结果表明,阿托伐他汀可以明显提高AD大鼠模型脑组织中SOD及GSH的活性,降低MDA的活性,在清除自由基、减轻自由基对机体的损害方面具有一定的作用。
凋亡是AD发病机制中一重要机制,其存在2种主要的相互关联途径:细胞表面死亡受体途径(外源性途径)和线粒体途径(内源性途径),Caspase-3和Bcl-2在细胞凋亡中起重要作用。正常状态下,无活性的Caspase-3以酶原形式存在于脑细胞中,可经以上2条途径被激活。活化的Caspase-3可以切割许多蛋白质底物,包括细胞骨架蛋白,参与调节细胞骨架的蛋白、参与DNA修复的酶及抗凋亡蛋白Bcl-2等,最终引起细胞死亡,完成其“瀑布式”级联反应[12]。Bcl-2是Bcl-2家族中重要的抗细胞凋亡基因,主要在细胞凋亡内源性途径中发挥作用。它可通过阻断细胞色素C的释放,抑制下游Caspase-3的激活,从而抑制凋亡的发生;同时,Bcl-2又是Caspase-3的作用底物,可被 Caspase-3水解[13]。在我们的研究中发现与空白对照组相比Aβ组脑组织中Bcl-2的表达下降(P<0.05),Caspase-3的表达上调(P<0.05),Aβ+阿托伐他汀治疗组与 Aβ组相比Bcl-2的表达上调(P<0.05),Caspase-3的表达下降(P<0.05)。研究结果表明阿托伐他汀可以调控Bcl-2及Caspase-3的表达,从而起到抗凋亡的作用。
通过以上的研究结果显示,阿托伐他汀对AD大鼠模型有一定的神经保护作用,具体作用机制可能与抑制氧化应激和抑制细胞凋亡相关。
[1]Crews L,Masliah E.Molecular mechanisms of neurodegeneration in Alzheimer's disease[J].Hum Mol Genet,2010,19(R1):R12-20.
[2]卓烨烨,张汉霆,徐江平,等 .氧化应激与阿尔茨海默病[J].中国药理学通报,2010,26(4):435-437.
[3]Sparks DL,Sabbagh MN,Connor DJ,et a1.Atorvastatin for the treatment 0fmild to moderate AIzlleimer disease:preliminary results[J].Arch Neural,2005,62(5):753-757.
[4]张博爱,马兴荣,贾延劼,等 .尼美舒利对Alzheimer大鼠的脑保护作用[J].郑州大学学报(医学版),2006,41(3):483-486.
[5]Scow D,Cauthier S.Pharmaeotherapy of Alzheimer,s disease[J].Can J Psychiatry,2007,52(10):620-629.
[6]Haag MD,Hofman A,Koudstaal PJ,et al.Statins are associated with a reduced risk of Alzheimer disease regardless of lipophilicity.The Rotterdam Study[J].J Neurosrg Psychiatry,2009,80(1):13-17
[7]Ostrowski SM,Wilkinson BL,Golde TE,et al.Statins reduce amyloid-βproduction through inhibition of protein isoprenylation[J].J Biol Chem,2007,282(37):26 832-26 844.
[8]Gackowski D,Rozalski R,Siomek A,et a1.OX’ldative stress and oxidative DNA damage is characteristic for mixed Alzheimer disease/vascular dementia[J].J Neurol Sci,2008,266(1-2):57.
[9]Del Rio D,Stewart AJ,Pellegrini N.A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J].Nutr Metab Cardiovasc Dis,2005,15(4):316-328.
[10]Zou X,Feng Z,Li Y,et al.Stimulation of GSH synthesis to prevent oxidative stress-induced apoptosis by hydroxytyrosol in human retinal pigment epithelial cells:activation of Nrf2 and JNK-p62/SQSTM1pathways[J].J Nutr Biochem,2012,23(8):994-1 006.
[11]Paamoni-Keren O,Silberstein T,Burg A,et al.Oxidative stress as determined by glutathione(GSH)concentrations in venous cord blood in elective cesarean delivery versus uncomplicated vaginal delivery[J].Arch Gynecol Obstet,2007,276(1):43-46.
[12]王旭刚,高政 .预防性应用阿托伐他汀对SD大鼠局部脑缺血再灌注脑组织Caspase-3表达的影响[J].中国实用神经疾病杂志,2011,14(16):20-22.
[13]Zheng-Yuan Su,Yen-Chen Tung.Blazeispirol A from Agaricus blazei Fermentation Product Induces Cell Death in Human Hepatoma Hep 3BCells through Caspase-Dependent and Caspase-lndependent Pathways[J].Journal of Agricultural and Food Chemistry,2011,59(9):5 109-5 116.
