核糖核酸酶Onconase的稀释复性条件优化研究
2013-08-14徐殿胜王庆诚
郭 红,徐殿胜,王庆诚
(1.华东理工大学 生物反应器工程国家重点实验室,上海200237;2.上海南方模式生物研究中心,上海201210)
核糖核酸酶是一类广泛存在于动植物体内的、具有水解作用的一类酶。它通过剪切转录核糖核酸及对核糖核酸进行修饰和降解来达到抑制肿瘤细胞生长的目的[1]。
Onconase(豹蛙酶)是一种从北极豹蛙卵母细胞和早期胚胎中提取的核糖核酸酶,对人肺腺癌细胞、慢性粒细胞白血病细胞、黑色素瘤细胞及人体肺腺癌上皮细胞等都有细胞毒性作用[2,3],是一种具有很大开发潜力的蛋白质。
目前,国内多通过毕赤酵母和大肠杆菌发酵来制备Onconase。作者在此先提纯大肠杆菌发酵获得的包涵体,再使包涵体复性得到有活力的Onconase蛋白。由于氧化型谷胱甘肽(GSSG)对蛋白质中二硫键的重新形成起到很重要的作用,尿素对蛋白质的复性也有意想不到的效果,因此,在复性缓冲溶液[4]中加入一定量的GSSG和尿素,并考察了复性温度、尿素浓度、GSSG加入时间对复性效果的影响,以确定最优稀释复性条件,并与传统的醋酸沉淀复性法进行了对比。拟为Onconase生产工业化、提高Onconase产量提供帮助。
1 实验
1.1 试剂与仪器
牛血清白蛋白(BSA)、二硫苏糖醇(DTT)、尿素(Genebase)、RNase A、Tween-20、盐酸胍(BIO BASIC INC),Triton X-100、GSSG(Amresco)等。
TES 缓 冲 溶 液:50mmol·L-1Tris-HCl,20 mmol·L-1EDTA,100mmol·L-1NaCl,pH 值8.0。
DIBB缓冲溶液:20mmol·L-1Tris-HCl,6mol·L-1Guanidine-HCl,65mmol·L-1DTT(现加),10 mmol·L-1EDTA,pH 值8.0。
RB缓冲溶液:100mmol·L-1Tris-AcOH,100 mmol·L-1NaCl,3.0mmol·L-1还原型谷胱甘肽,0.6mmol·L-1氧化型谷胱甘肽,pH值8.0。
DB缓冲溶液:20mmol·L-1乙酸。
多功能酶标仪(BIOTEK),AKTA Purifier(GE)。
1.2 方法
1.2.1 菌体破碎及包涵体的洗涤
在内含Onconase包涵体的大肠杆菌发酵液中加入溶菌酶,匀浆破碎,于6000r·min-1离心1h;加入TES缓冲溶液及25%Triton X-100,匀浆后再于6000 r·min-1离心1h,重复操作1次;再加入TES缓冲溶液,匀浆,于6000r·min-1离心1h,重复操作直至上清液澄清,得到包涵体。
1.2.2 包涵体蛋白的溶解和稀释复性
将包涵体溶解于一定体积的DIBB缓冲溶液中,室温振荡过夜。测定蛋白含量后,用DIBB缓冲溶液将蛋白质浓度稀释到10mg·mL-1。
将包涵体裂解液缓慢滴加至配制好的包涵体复性缓冲溶液中,设定合适的转速进行搅拌,保证蛋白质的终浓度为0.1mg·mL-1,置于4℃层析柜中复性72h。然后于6000r·min-1离心1h,去除因聚集产生的蛋白质沉淀。
1.2.3 传统的醋酸沉淀复性
将1mL包涵体溶液迅速用50mL DB稀释,于4℃、12 000r·min-1离心30min,去沉淀,透析,去除变性剂。向溶液中加入20BV RB,并调节pH值为8.0,于4℃、12 000r·min-1离心30min,去沉淀。在复性缓冲溶液RB中4℃复性36~48h,于4℃、12 000r·min-1离心20min,去除复性过程产生的蛋白沉淀。
1.3 测定方法
1.3.1 蛋白含量的测定
采用Brandford法测定蛋白含量。
1.3.2 蛋白相对活力的测定
由于目的蛋白是核糖核酸酶,所以采用RNA荧光底物法测定目的蛋白活力,即目的蛋白Onconase和带有荧光标记的底物RNA进行反应,通过检测吸光度值得到蛋白相对活力(由于不需要各组实验间的对比,为简化实验,直接利用每个时刻得到的活力曲线的斜率作为纵坐标,比较各组条件下得到的蛋白相对活力)。
2 结果与讨论
2.1 醋酸沉淀法的复性效果(图1)
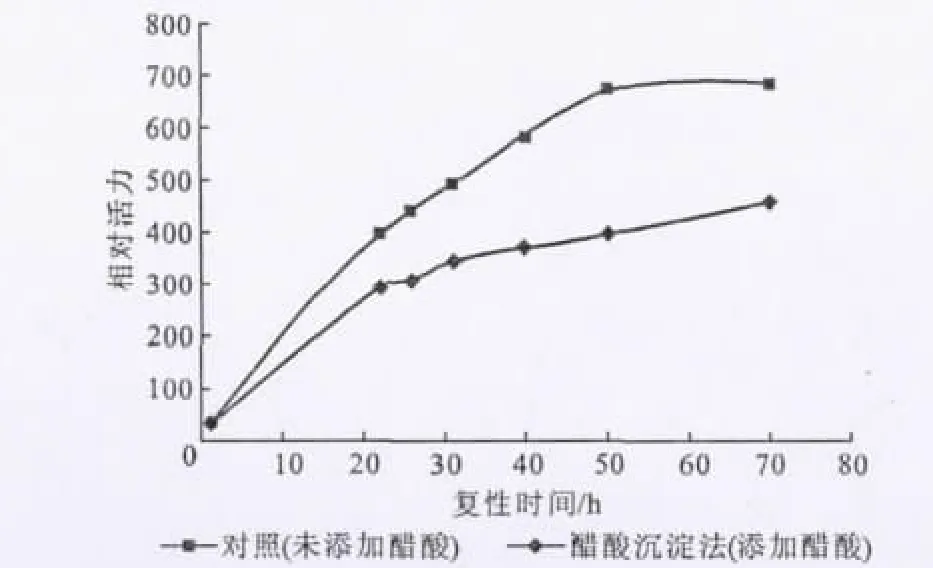
图1 醋酸沉淀法的复性效果Fig.1 The renaturation efficiency of acetic acid sinking method
由于醋酸沉淀法无需加入辅助复性的物质,节省了工艺成本,所以不失为一种可供选择的方法。
2.2 稀释复性条件的优化
2.2.1 复性温度的影响
复性缓冲溶液pH值为8.0、尿素浓度为2mol·L-1、GSSG先于包涵体加入复性缓冲溶液中、复性缓冲溶液体积为50mL、蛋白质终浓度控制在0.1mg·mL-1,考察复性温度对复性效果(复性缓冲溶液中总蛋白相对活力)的影响,结果见图2。
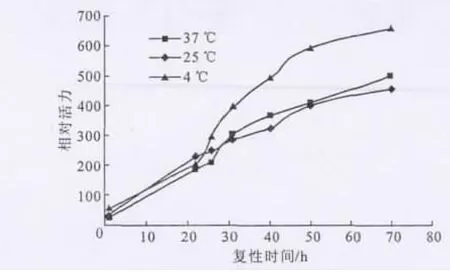
图2 复性温度对复性效果的影响Fig.2 The effect of renaturation temperature on renaturation efficiency
从图2可知,4℃下复性缓冲溶液中总蛋白相对活力最高。蛋白活力应该随着温度升高而增大,且到达某一临界温度后不会再继续上升。但包涵体复性过程需要经过中间状态——熔球态,25℃时的复性效果没有4℃好,这可能是因为25℃时包涵体进入熔球态的速度较快,容易出现错误折叠的情况,进而影响到总蛋白的相对活力。
2.2.2 尿素浓度的影响
复性缓冲溶液pH值为8.0、复性温度为4℃、复性缓冲溶液体积为50mL、蛋白质终浓度控制在0.1 mg·mL-1,考察尿素浓度对复性效果的影响,结果见图3。
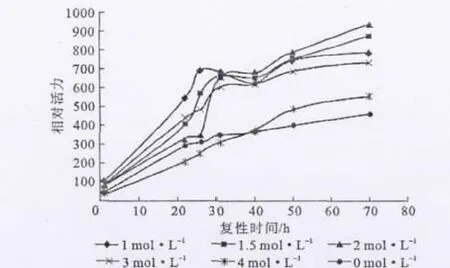
图3 尿素浓度对复性效果的影响Fig.3 The effect of urea concentration on renaturation efficiency
从图3可知,尿素浓度为2mol·L-1时,复性缓冲溶液中的总蛋白相对活力最高,这可能是因为,浓度小于2mol·L-1时,尿素的主要作用是屏蔽蛋白质所带电荷,防止蛋白质聚集沉淀的损失;而浓度大于2 mol·L-1时,尿素夺取蛋白质氢键的作用要强于屏蔽蛋白质电荷的作用,从而促进了蛋白质变性的发生。
2.2.3 GSSG加入时间的影响
复性缓冲溶液pH值为8.0、复性温度为4℃、复性缓冲溶液体积为50mL、蛋白质终浓度控制在0.1 mg·mL-1、复性缓冲溶液中尿素浓度分别为2mol·L-1和1.5mol·L-1,考察 GSSG加入时间对复性效果的影响,结果见图4。
从图4可知,当尿素浓度为2mol·L-1时,GSSG先于包涵体加入复性缓冲溶液中效果稍好,但差别不明显;当尿素浓度为1.5mol·L-1时,GSSG后于包涵体加入复性缓冲溶液中效果较好。
2.3 不同复性体系比较
基于以上实验结果,分别取350mL3种缓冲溶液:加有GSSG的含2mol·L-1尿素的稀释复性缓冲溶液、含1.5mol·L-1尿素的稀释复性缓冲溶液、醋酸沉淀复性缓冲溶液,采用稀释复性方法[5],缓慢滴加包涵体裂解液,搅拌(5min后,在含1.5mol·L-1尿素的稀释复性缓冲溶液中加入等量的GSSG),放入4℃层析柜中复性72h。然后于6000r·min-1、4℃离心1h,去除沉淀,用阳离子交换柱South15s进一步纯化。测定Onconase含量,并计算回收率,结果见表1。
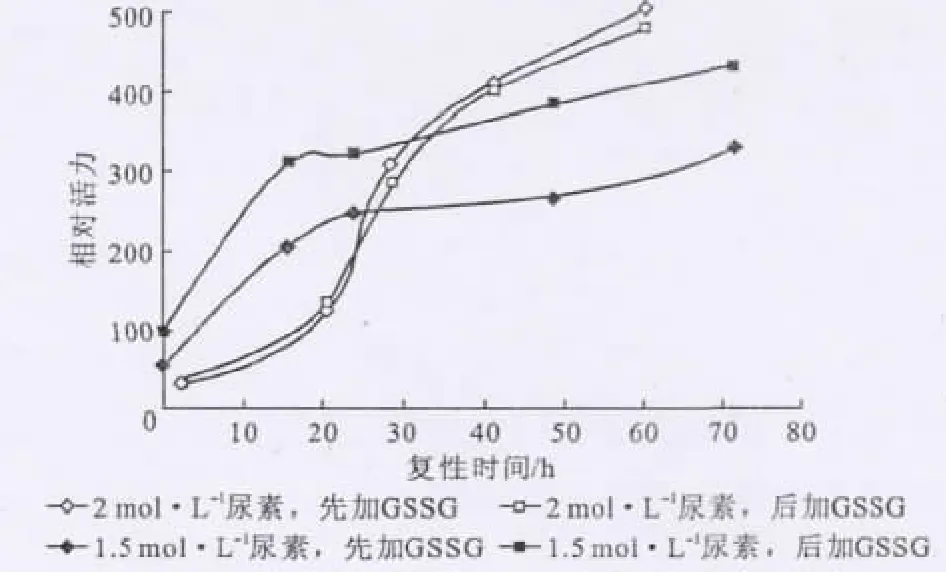
图4 GSSG加入时间对复性效果的影响Fig.4 The effect of addition time of GSSG on renaturation efficiency

表1 复性并纯化后的Onconase蛋白含量及回收率Tab.1 The content and recovery of Onconase after renaturation and purification
由表1可知,先加GSSG的含2mol·L-1尿素的稀释复性缓冲溶液的复性效果最好,Onconase含量和回收率均高于其它两种复性体系。
2.3 讨论
(1)由于Onconase的等电点较高,为9.7左右,故选用阳离子交换柱层析进行纯化。
(2)常用的蛋白质变性剂为6mol·L-1尿素或4 mol·L-1盐酸胍。这是由于高浓度的尿素或盐酸胍可以破坏蛋白质的氢键,即蛋白质的二级结构,从而使蛋白质不能形成活性所必需的高级结构,起到变性作用。然而近年来研究发现,低浓度的尿素具有降低非正确折叠和蛋白的活性状态、提高解折叠状态和折叠中间体的稳定性的作用[6,7]。这可能是因为尿素的溶解作用一方面会夺取蛋白质的氢键,另一方面却可以防止蛋白质的聚集(可能是由于尿素屏蔽了蛋白质之间的电荷作用)。为此,本研究选择尿素作为变性剂,并考察了尿素浓度对复性效果的影响。
(3)研究发现,待复性的蛋白质本身含有二硫键时,应该在复性过程中加入诸如GSH(还原型谷胱甘肽)/GSSG、DTT/GSSG等具有氧化还原作用的体系。氧化还原体系通过促进不正确形成的二硫键快速交换反应,提高了正确配对的二硫键的产率。Onconase本身只有104个氨基酸,却含有4个二硫键,其二硫键能否正确折叠对蛋白活力影响很大。因此,实验选择DTT/GSSG氧化还原体系,以确保Onconase的正确折叠。
以往的实验中曾选择在过夜裂解包涵体时加入DTT、在配制复性缓冲溶液时加入GSSG的方式,并取得了良好的效果。后有报道称将GSSG后于包涵体加入到复性缓冲溶液中效果更好[6]。考虑到在蛋白质折叠过程中,从伸展态到中间态的速度只需要几毫秒,因此将GSSG和包涵体加入到复性缓冲溶液中的时间间隔设为5min,对GSSG先于、后于包涵体加入到复性缓冲溶液中的效果进行比较,但由于时间所限,并没有进行时间梯度上的探讨。
然而,对于1.5mol·L-1尿素体系和2mol·L-1尿素体系所得出的结论为何相反的问题,由于因素复杂,有待进一步深入探讨。
(4)对蛋白HPLC级别的纯度分析需要进一步研究。
3 结论
采用稀释复性方法从包涵体中复性得到有活力的Onconase蛋白,并与传统的醋酸沉淀复性方法进行了比较,考察了复性温度、尿素浓度、GSSG加入时间对复性效果的影响。结果表明,在最佳复性温度为4℃、采用最佳复性体系(先加GSSG的含2mol·L-1尿素的稀释复性缓冲溶液)时,复性纯化后Onconase含量和回收率明显高于醋酸沉淀复性法。
[1]钱敏,李关荣,鲁成.核糖核酸酶研究进展[J].蚕业科学,2004,30(2):185-190.
[2]秦孙星,李晓波.抗肿瘤核糖核酸酶Onconase研究进展[J].中国生化药物杂志,2005,26(5):309-311.
[3]田雪,王庆诚,沈如凌,等.Onconase研究与开发的最新进展[J].中国细胞生物学学报,2010,32(6):927-934.
[4]车婧,韩金祥,王世立.促进包涵体蛋白复性的几种有效添加剂[J].医学分子生物学杂志,2004,1(2):122-125.
[5]黄强,陈利弘,曾令宇,等.大肠杆菌表达的人源性抗CTLA4单链抗体三种复性方法比较[J].生物医学工程学杂志,2006,23(2):388-391.
[6]Chen J,Liu Y D,Li X N,et al.Cooperative effects of urea and L-arginineon protein refolding[J].Protein Expr Purifi,2009,66(1):82-90.
[7]Matsubara M,Nohara D,Kurimoto E,et al."Loose folding"and"delayed oxidation"procedures successfully applied for refolding of fully reduced hen egg white lysozyme[J].Chemical & Pharmaceutical Bulletin,1993,41(7):1207-1210.
