人皮肤鳞状细胞癌体外三维模型的建立及高侵袭性鳞癌细胞的生物学评价*
2013-08-14杨晓鲲杨亚东杨桂红唐书谦伍津津
杨晓鲲,杨亚东,杨桂红,唐书谦,伍津津
(第三军医大学大坪医院野战外科研究所皮肤科,重庆 400042)
人皮肤鳞状细胞癌(the human shin squamous-celled carcinoma,SCC),是皮肤肿瘤中侵袭性、致死性较强的一类,对其研究一直都是热点。以往研究者借助普通的二维细胞培养和鳞癌动物模型进行研究,本试验中,通过建立SCC三维培养模型,并进一步筛选出具有更高侵袭性的SCC细胞亚群,并比较两种细胞亚群之间的生物学特性,为临床治疗SCC提供重要的理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 1~3个月雄性裸鼠40只,由第三军医大学大坪医院动物实验所提供。
1.1.2 细胞和试剂 人表皮鳞癌细胞株A-431细胞株(TCHu188,上海细胞生物研究所),人源角质形成细胞(KC细胞)和成纤维细胞(FB细胞)为本实验室常规冻存备用,鼠尾胶原按本科方法制备[1];肉桂醛(Sigma公司);注射用重组人干扰素α1b(IFNα1b)(赛若金,每支1mL∶30μg,国药准字S10960059,深圳科兴生物工程有限公司);层粘连蛋白,普通和高糖DMEM 培养基(Hyclone公司);胎牛血清(Hyclone公司);四甲基偶氮唑盐(MTT粉)、表皮生长因子、壳多糖、硫酸软骨素C、透明质酸(均为SIGMA产品),HEPES(美国KAI生物医学科学公司),胶原酶D(德国宝灵曼公司);胰蛋白酶(中国科学院新疆化学研究所)。
1.1.3 主要仪器设备 超净工作台(苏净集团苏州安泰空气技术有限公司),二氧化碳孵箱TC2323型(SHEL LAB公司),HY-4调速多用振荡器(江苏金坛市中大仪器厂);酶标仪(Biotek ELx800,USA);细胞计数仪(HK97CASY-TT)。
1.2 方法
1.2.1 A431细胞及相关细胞的培养和传代 向A431细胞的培养瓶中加入2mL 0.01mol/L的磷酸盐缓冲液(PBS),清洗2次,倒掉培养基,加入0.25%胰酶4℃冷消化30min,后轻轻拍打培养瓶壁,加入1mL胎牛血清终止消化后按1∶2~1∶4传代扩增,以此获得的A431细胞记为Ⅰ组。KC细胞和FB细胞从临床健康成人包皮标本获取,并常规培养、传代。
1.2.2 建立A431鳞癌细胞三维培养模型 参照以往研究[1]在6孔培养板上制作组织工程凝胶,将FB 1.5×105个细胞/孔混入凝胶中,待凝胶凝固后,再按照A4310.5×105个细胞/孔、KC 2×105个细胞/孔的比例加入凝胶中,进行A431三维培养模型的建立,分为 A、B、C、D组(分别对应5、7、10、14d),各重复2组(一组观察鳞癌细胞浸润情况,另一组消化提取细胞)。为改善培养环境,利用振荡器进行振荡培养;并在5、7、10、14d取出标本,甲醛液固定,常规HE染色,镜下观察A431细胞浸润情况。之后将D组表皮层中细胞去除,加入2%胶原酶D消化,获得浸入真皮层的A431细胞,培养传代后,再次按前述各细胞数量接种于组织工程凝胶中,并分为a、b、c、d组,可再次重复2组,以获取侵袭特性更强的鳞癌细胞,并将此A431细胞记为Ⅱ组(普通培养A431细胞为Ⅰ组)。
1.2.3 肉桂醛溶液、IFNα1b溶液及0.5%MTT液的配制肉桂醛溶液配制以0.2%二甲基亚砜溶液作为溶剂,将肉桂醛溶液和高糖无血清DMEM培养基经过避光振荡5min,0.22μm 滤膜过滤,分别配制成100μL的100、200、400μmol/L 3种 浓度,于 4℃ 保存备用。IFNα1b溶 液 配制:30μg/mL IFNα1b用无血清DMEM作为稀释剂,分别稀释成3、2、1μg/mL浓度并置于4℃保存备用。0.5%MTT液配制:将50mg MTT混合于10mL的0.01M磷酸盐缓冲液中,振摇、溶解,0.22μm滤膜过滤,并于4℃保存备用。
1.2.4 MTT法测定A431细胞增殖 取对数期生长的A431细胞,无菌PBS洗涤3次后0.25%胰酶消化,观察细胞收缩变圆后终止消化。1200r/min离心5min,弃上清液,加入完全培养基重悬,细胞计数仪计数,按2×104个细胞/100微升接种于96孔板,每孔100μL,置入37℃,5%CO2孵箱培养。待细胞贴壁后分别加入肉桂醛0、100、200、400μmol/L(对应配制好的肉桂醛溶液加入量分别为0.0、12.5、25.0、50.0μL)。每组5复孔(n=5),置入孵箱继续培养。分别在培养24、48和72h后每孔加入5g/L的MTT溶液20μL,继续培养4h,每孔加入二甲基亚砜150μL,避光振荡10min,酶标仪490nm处测量光密度值。
1.2.5 裸鼠成瘤模型的建立及不同侵袭性A431细胞成瘤活性的比较 按接种A431细胞的不同分为Ⅰ、Ⅱ组,并按照接种后裸鼠生长时间分为3、4、5、6周组,每组5只,胰蛋白酶消化后制成细胞悬液,用无血清培养液洗涤3次,3000r/min离心3min,弃上清液。加PBS液稀释,制成单细胞悬液用于细胞计数,调整细胞浓度为2×106/mL,裸鼠背部皮肤用75%乙醇进行消毒,以1mL注射器吸取0.1mL细胞悬液,数量为2×106个,注射入裸鼠背部皮下组织,注射完毕后观察裸鼠,无异样反应,继续放于无菌饲养房内饲养,并观察肿瘤生长情况,并在一定时间内脱颈法处死裸鼠,留取肿瘤标本,后用体积公式:V=0.5×a×b2,(a为长径,b为短径)计算肿瘤体积。
1.3 统计学处理 采用SPSS13.0统计软件进行统计分析,计量资料用表示,细胞增殖抑制率等采用χ2检验,组间比较采用t检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 A431鳞癌细胞三维培养模型的建立 由图1可观察到,作者建立的组织工程皮肤表真皮分化明显,形成较之普通传统培养形式不同的三维立体结构,以标志性的基底膜为界,上为组织工程皮肤表皮部分,而下为组织工程的真皮凝胶部分,并且从三维培养的第5天开始,组织工程皮肤真皮凝胶层中可见到核异型性明显的肿瘤细胞浸润,并且随着时间的延长,浸润入真皮层内的细胞数量明显增加,同时肿瘤浸润的广度和深度都有所增加,到第14天时达到高峰。结果提示鳞癌细胞三维培养模型建立成功。
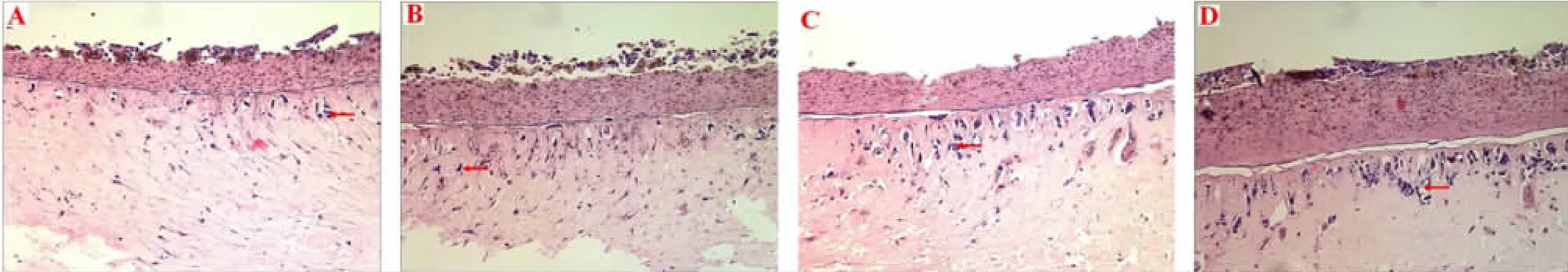
图1 各组A431鳞癌细胞组织学观察(HE×10)
表1 不同浓度肉桂醛对Ⅰ组、Ⅱ组A431细胞增殖的抑制率(%,,n=20)
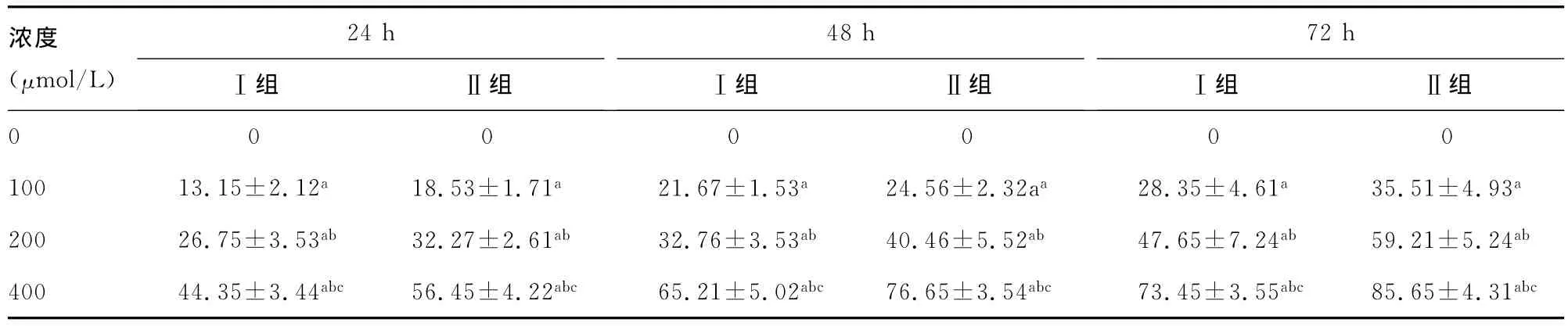
表1 不同浓度肉桂醛对Ⅰ组、Ⅱ组A431细胞增殖的抑制率(%,,n=20)
aP<0.01,与无药物对照组比较;b:P<0.01,与100μmol/L比较;c:P<0.01,与200μmol/L比较。
浓度(μmol/L)24hⅠ组 Ⅱ组48hⅠ组 Ⅱ组72hⅠ组 Ⅱ组0000000100 13.15±2.12a 18.53±1.71a 21.67±1.53a 24.56±2.32aa 28.35±4.61a 35.51±4.93a 200 26.75±3.53ab 32.27±2.61ab 32.76±3.53ab 40.46±5.52ab 47.65±7.24ab 59.21±5.24ab 400 44.35±3.44abc 56.45±4.22abc 65.21±5.02abc 76.65±3.54abc 73.45±3.55abc 85.65±4.31abc
表2 不同浓度IFNα1b对Ⅰ组、Ⅱ组A431细胞增殖的抑制率(%,,n=20)

表2 不同浓度IFNα1b对Ⅰ组、Ⅱ组A431细胞增殖的抑制率(%,,n=20)
a:P<0.01,与无药物对照组比较;b:P<0.01,与100μmol/L比较;c:P<0.01,与200μmol/L比较。
浓度(μmol/L)24hⅠ组 Ⅱ组48hⅠ组 Ⅱ组72hⅠ组 Ⅱ组0000000100 19.75±3.16a 26.50±2.30a 23.65±7.12a 29.94±6.24a 31.65±3.23a 37.33±4.49a 200 23.46±2.17ab 31.46±3.27ab 28.45±3.52ab 34.65±3.38ab 36.45±4.26ab 40.38±3.99ab 400 27.76±3.24abc 38.34±4.25abc 37.86±2.15abc 45.25±4.65abc 45.35±6.26abc 51.65±2.37abc
2.2 肉桂醛和IFNα1b对不同侵袭性的A431细胞增殖活性的影响 随着肉桂醛、IFNα1b浓度的增加,鳞癌细胞被抑制率也随之增高,且Ⅰ组、Ⅱ组间对比,差异有统计学意义(P<0.01),见表1。随着药物浓度的增加,鳞癌细胞被抑制率也随之增高,且Ⅰ组、Ⅱ组间对比,差异有统计学意义(P<0.01),见表2。接种后,Ⅱ组裸鼠形成的肿瘤较Ⅰ组体积更大,质量更重,差异有统计学意义(P<0.01),见表3。
表3 两组A431细胞成瘤活性的比较(,n=20)
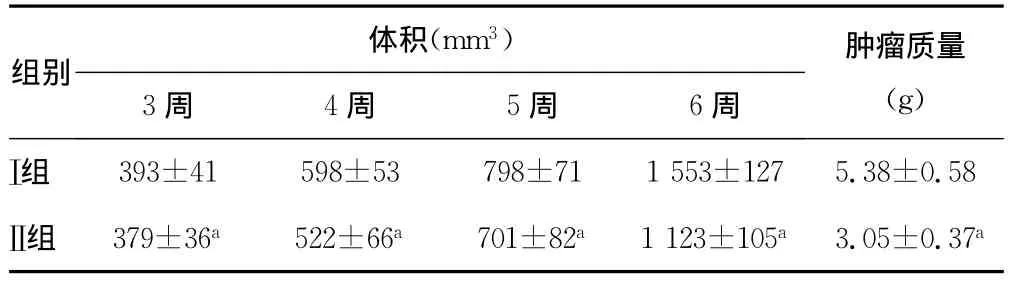
表3 两组A431细胞成瘤活性的比较(,n=20)
a:P<0.01,与Ⅰ组比较。
体积(mm3)组别3周 4周 5周 6周肿瘤质量(g)Ⅰ组393±41 598±53 798±711553±1275.38±0.58Ⅱ组 379±36a 522±66a 701±82a1123±105a3.05±0.37a
3 讨 论
SCC在皮肤肿瘤中发生率较高,对于它的治疗方法和基础研究很多,本实验中,运用SCC A431细胞建立了SCC体外三维培养模型,并筛选出侵袭性更强的A431细胞亚群,并将这两类细胞的生物学特性做了比较,证明了鳞癌细胞三维培养模型的有效性,为今后SCC的临床治疗和科研研究提供良好的体外培养模型。
众所周知,目前肿瘤研究的主要手段集中于肿瘤细胞的二维培养、动物荷瘤模型和自发性动物肿瘤模型等方面,都存在着明显的局限性,与临床肿瘤诊治往往存在偏差[2-3]。而三维培养,有利于种植细胞固有的生物学特性的维持[4],可以较为真实地再现体环境中细胞与细胞、细胞与细胞外基质相互间的作用。目前,已经在肿瘤形态发生、侵袭性生长及化疗药物的药理毒理的研究中提供了比较有价值的研究手段[5-6]。例如,有学者将乳腺癌(SUM1315、MDA-MB-231)、前列腺癌(LNCaP)细胞株种植于聚已酸内酯磷盐三钙(mPCL-TCP)、聚甲基丙稀酸-2-羟乙酯(polyHEMA)、Matrigel等支架材料中,并在三维培养条件下形成肿瘤团块[7-8],并维持了恶性肿瘤的生物学特性[9-10]。
在本次实验中,利用复方壳多糖真皮基质凝胶这一三维培养支架为基础,本研究成功地建立了SCC体外三维培养模型,这与目前肿瘤侵袭性研究采用的细胞侵袭测定装置系统如CytoSelect系统[11]、聚碳酸酯滤器穿壁系统[12]相比,具有明显的优势,可以真实反映在体情况下肿瘤突破表皮层而进入真皮层的失衡过程,同时能够获得这一类鳞癌细胞亚群。经过肉桂醛和IFNα1b对皮肤鳞癌细胞的增殖抑制实验发现,随着药物浓度的增加,鳞癌细胞被抑制率也随之增高,差异有统计学意义(P<0.01),其中肉桂醛在浓度为400μmol/L、作用时间为72h时,对两组细胞的抑制率分别达到(85.65±4.31)%和(73.45±3.55)%。而IFNα1b在浓度为400μmol/L、作用时间为72h时,对两组细胞的抑制率则分别达到了(51.65±2.37)%和(45.35±6.26)%,同时这两组实验分组细胞之间比较,相同浓度药物和相同药物作用时间对肿瘤细胞的增殖抑制差异有统计学意义(P<0.01)。另外,两种不同侵袭特性的细胞亚群的成瘤特性差异有统计学意义(P<0.01)。
综上所述,本研究体外构建鳞癌细胞三维培养模型是成功的,通过此模型,也能够筛选出侵袭性更强的鳞癌细胞,这对构建其他皮肤恶性肿瘤的三维培养模型、治疗药物筛选与评价都有重要的理论和实验指导价值。至于如何维持此种肿瘤三维培养模型的稳定性,以及本次研究中的皮肤鳞癌细胞侵入真皮层的具体机制,需要在今后的实验工作中继续探讨。
[1]鲁元刚,伍津津,雷霞,等.培养基钙浓度对复方壳多糖组织工程皮肤基底膜构建的形态学研究[J].中国修复重建外科杂志,2007,21(3):298-301.
[2]Eager RM,Cunningham CC,Senzer NN,et al.Phase Ⅱassessment of talabostat and cisplatin in second-line stageⅣ melanoma[J].BMC Cancer,2009,9(7):263-278.
[3]Hutmacher DW,Loessner D,Rizzi S,et al.Can tissue engineering concepts advance tumor biology research?[J].Trends Biotechnol,2010,28(3):125-133.
[4]Yamada KM,Cukierman E.Modeling tissue morphogenesis and cancer in 3D[J].Cell,2007,130(4):601-610.
[5]Furth ME,Atala A,Van Dyke ME.Smart biomaterials design for tissue engineering and regenerative medicine[J].Biomaterials,2007,28(34):5068-5073.
[6]Dutta RC,Dutta AK.Cell-interactive 3D-scaffold;advances and applications[J].Biotechnol Adv,2009,27(4):334-339.
[7]Fischbach C,Kong HJ,Hsiong SX,et al.Cancer cell angiogenic capability is regulated by 3Dculture and integrin engagement[J].Proc Natl Acad Sci U S A,2009,106(2):399-404.
[8]Wang R,Xu J,Juliette L,et al.Three-dimensional co-culture models to study prostate Cancer growth,progression,and metastasis to bone[J].Semin Cancer Biol,2005,15(5):353-364.
[9]Ingber DE.Can Cancer be reversed by engineering the tumor microenvironment?[J].Semin Cancer Biol,2008,18(5):356-364.
[10]Hutmacher DW,Singh H.Computational fluid dynamics for improved bioreactor design and 3Dculture[J].Trends Biotechnol,2008,26(4):166-172.
[11]Cabello CM,Bair WB,Lamore SD,et al.The cinnamonderived Michael acceptor cinnamic aldehyde impairs melanoma cell proliferation,invasiveness,and tumor growth[J].Free Radic Biol Med,2009,46(2):220-231.
[12]Kim A,Son M,Kim KI,et al.Elevation of intracellular cyclic AMP inhibits NF-κB-mediated thymosinβ4expression in melanoma cells[J].Exp Cell Res,2009,15(19):3325-3335.
