PTEN/mTOR信号通路对大鼠神经干细胞分化成熟作用的研究
2013-08-11沈华超李文磊黄素素徐德友沈丽华丁新生
沈华超, 李文磊, 黄素素, 朱 金, 徐德友, 沈丽华, 丁新生
缺血性脑血管病以其高发病率和高致残率成为当前严重威胁人类健康的一大类重要疾病,但有效的治疗方法非常有限。神经干细胞(neural stem cells,NSCs)具有自我更新能力,能够分化为神经元和胶质细胞。神经干细胞移植可以直接或间接替代已经坏死的神经细胞或组织,重建神经网络,部分恢复已丧失的功能,被认为是最有潜力的治疗脑缺血的方法[1]。然而干细胞移植治疗最大的难题是移植的神经干细胞存活、轴突生长及和正常组织建立突触连接困难。PTEN(phosphatase and tensinhomology deleted on chromosome ten)是近年来新发现的同时具有脂质和蛋白质双重磷酸酶活性的肿瘤抑制基因,负性调节mTOR通路。研究发现PTEN/mTOR信号通路在神经系统广泛表达,是神经发生和再生的一个重要的内在控制分子[2~5]。本研究通过体外分离培养大鼠海马NSCs,观察其诱导分化过程中PTEN和反映mTOR蛋白活性的P-S6R的表达变化,以期了解PTEN/mTOR信号通路在神经干细胞分化成熟中的作用,探究神经干细胞分化成熟至一定阶段后生长及再生能力下降的原因,为促进神经干细胞移植治疗提供一定的实验基础。
1 材料与方法
1.1 实验动物 健康新生1d的Sprague-Dawley(SD)乳大鼠,体重3~5g(南京医科大学实验动物中心提供,常规条件饲养)。
1.2 主要试剂及仪器 DMEM/F12(1∶1)培养基(Gibco);ACCUTASE(Gibco);青链霉素(Hyclone);胎牛血清(FBS)(Hyclone);B27(Gibco);碱性成纤维细胞生长因子bFGF(Peprotech);表皮细胞生长因子EGF(Peprotech);兔抗大鼠PTEN多克隆抗体(cell signaling technology);兔抗大鼠P-S6R多克隆抗体(cell signaling technology);兔抗大鼠Nestin多克隆抗体(Santa Cruz Biotechnology);FITC标记羊抗兔IgG二抗、R标记驴抗兔IgG二抗(Santa Cruz Biotechnology)。CO2培养箱(日本三洋公司),荧光倒置相差显微镜(尼康仪器有限公司),凝胶成像系统(美国UVP公司)。
1.3 大鼠NSCs的分离培养 取新生1d SD乳大鼠,于无菌条件下分离出大脑半球,剔除脑膜,分离出海马,立即置入预冷的DMEM/F12中,将海马机械剪碎后用枪头吹打至单细胞悬液,1000r/min离心5min,弃上清,沉淀物用完全培养基重悬(含有20ng/ml bFGF,20ng/ml EGF,2%B27,1% 双抗的DMEM/F12),200目的筛网过滤,血细胞计数器计数后,以5×105cells/ml的浓度接种于25cm2培养瓶中,置于37℃、5%CO2细胞培养箱培养。24h后换液一次,以后每隔3~4d换液一次。待原代培养的神经球直径达到200μm左右(大约6~7d)时进行传代培养,收集神经球,1000r/min离心5min,弃培养基,加入1ml ACCUTASE,37℃消化5min,用枪头机械吹打神经球为单个细胞,1000r/min离心5min,弃上清,用完全培养基重悬细胞,调整细胞浓度为5×105cells/ml,接种到25cm2培养瓶中,置于37℃、5%CO2细胞培养箱继续培养。大约6~7d传代一次,取第3代细胞进行实验。
1.4 实验分组及NSCs的诱导分化 收集第三代NSCs,以1000r/min离心5min,弃上清,用诱导分化培养液(含有1%FBS和2%B27的DMEM/F12培养基)重悬细胞,用机械吹打的方法将神经球分散成单个细胞,细胞计数后以5×105cells/ml的浓度接种到PDL包被的培养皿中,随机分为0d组、1d组、3d组和7d组,置于37℃、5%CO2细胞培养箱中分别诱导分化1d、3d和7d。0d组不做诱导分化处理,直接用于实验
1.5 免疫荧光检测 取第3代NSCs接种在内置玻片的6孔板中,待细胞贴壁后,取出玻片,用PBS冲洗3次,每次5min;4%的多聚甲醛室温原位固定15min,细胞面朝上,PBS洗 3 次,每次 5min;0.3%Triton作用10min,PBS洗3次,每次5min;胎牛血清37℃封闭1h后加入Nestin一抗(1∶200),放入湿盒内4℃过夜,同时用PBS代替一抗作阴性对照。弃一抗,PBS洗3次,避光环境下加入荧光二抗(1∶200),37℃孵育1h。PBS洗3次,封片,然后立即在荧光显微镜下观察,摄片。取诱导分化后的神经干细胞,分别用PTEN和P-S6R一抗(稀释度1∶200和1∶100)检测PTEN和P-S6R蛋白的表达,具体步骤同上。
1.6 Western blotting检测 收集各组细胞,加裂解液,冰上裂解30min,4℃超声破碎,12000r/min离心15min,取上清测定蛋白浓度,-80℃保存待用。调整样品蛋白浓度一致后以等体积上样,行10%SDS聚丙烯酰胺凝胶电泳(PAGE)分离蛋白,浓缩胶和分离胶分别以恒压100V、150V均电泳lh,分离后的蛋白转移至硝酸纤维素(nitrocellulose,NC)膜上,用含5%脱脂奶粉封闭1h后,加入PTEN(1∶1000)和P-S6R(1∶2000)一抗,4℃摇床过夜,用TBST缓冲液漂洗10min×3次后加入辣根过氧化物酶标记的羊抗兔二抗,室温摇床孵育1h,TBST缓冲液漂洗10min×3次,采用化学发光法在凝胶成像系统内曝光显色,以β-actin作为内参,用待检测蛋白与β-actin灰度值的比值进行比较。
1.7 统计学分析 采用SPSS17.0软件进行统计学处理,所得数据用均数±标准差()表示,两组均数比较采用t检验,多组均数间的比较采用单因素方差分析,P﹤0.05为差异有统计学意义。
2 结果
2.1 NSCs的培养、观察及鉴定 原代培养的NSCs:刚分离出来的细胞呈圆形,折光性较强,培养2d后可见到单细胞出现分离增殖现象,形成大量的4~5个细胞组成的细胞团,6~7d后可见增殖形成的神经球,大小不一,直径约200μm左右。收集NSCs机械吹散成单细胞,置于相同条件下继续培养,可观察到悬浮的单个细胞分裂、聚集,呈圆球形,大小不一,具有较强的折光性,培养5d后,培养液中可见单细胞增殖再次形成神经球,细胞形态不变。原代和传代培养的神经球接种到6孔培养板内涂有PDL的盖玻片上继续培养4h后进行细胞免疫荧光检测,经神经干细胞特征性标记神经巢蛋白(Nestin)染色均为阳性(见图1)。
2.2 NSCs诱导分化过程中神经细胞的形态变化 NSCs接种到培养皿中,未诱导分化时呈球状悬浮生长,大小不一;诱导分化1d时可见大量神经样细胞,胞体呈梭性或椭圆形,并伸出突起;随着NSCs诱导分化时间的延长,神经样细胞渐趋成熟。诱导分化至7d时神经样细胞胞体体积增大,细胞形态各异,NSCs初步分化成熟(见图2)。
2.3 NSCs诱导分化后PTEN和P-S6R的细胞免疫荧光染色 NSCs诱导分化后细胞免疫荧光显示:PTEN和P-S6R的细胞免疫荧光染色均呈阳性。PTEN在胞浆和胞核中均有表达,而P-S6R主要表达在胞浆中(见图3)。
2.4 NSCs分化成熟过程中PTEN蛋白的表达变化 在NSCs诱导分化过程中,PTEN的表达随着分化时间的延长有明显的增高。与分化0d组相比,3d组和7d组PTEN表达明显增高(均P﹤0.01);与1d组相比,3d组和7d组PTEN表达亦明显增高(P﹤0.01和P﹤0.05);与0d组相比,1d组虽有升高,但差异无统计学意义(P>0.05);与3d组相比,7d组虽有下降,但差异无统计学意义(P>0.05)。以上结果表明,随着 NSCs的逐渐分化成熟,PTEN的表达呈明显增加的趋势,分化3d时其表达明显增加,到7d时,仍然高水平表达。随着NSCs的诱导分化时间的延长,P-S6R的表达呈下降趋势。与诱导分化0d组相比,3d组和7d组P-S6R表达均明显下降(均P﹤0.01);与分化1d组相比,3d组和7d组 P-S6R表达亦明显下降(均 P﹤0.01);与0d组相比,1d组虽有下降趋势,但差异无统计学意义(P>0.05);与3d组相比,7d组虽有增高,但差异无统计学意义(P>0.05)。以上表明随着NSCs的逐渐分化成熟,P-S6R的表达呈明显下降的趋势,分化至3d时,P-S6R明显降低,当分化至7d时,表达水平仍然较低。

图1 免疫荧光染色鉴定NSCs(400×)
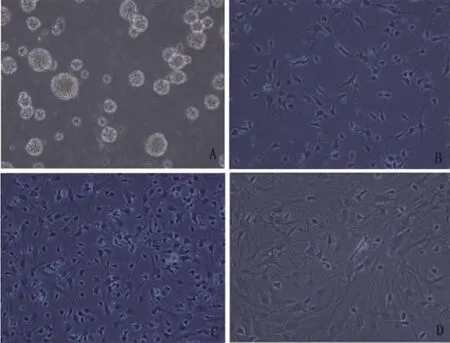
图2 NSCs诱导分化后的细胞形态特征(200×)
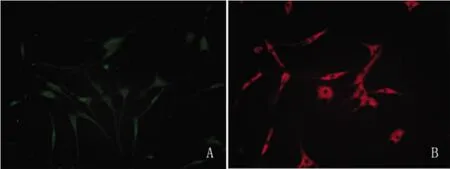
图3 NSCs诱导分化后PTEN和P-S6R细胞荧光染色(200×)
3 讨论
NSCs是一类具有高度自我更新能力并能分化为神经元、星形胶质细胞和少突胶质细胞的神经前体细胞,广泛分布于发育和成年哺乳动物中枢神经系统中,研究证实这类细胞可以在体外分离培养并长期传代克隆,原代和传代培养的NSCs在适宜的条件下具有多向分化的潜能,这就为缺血性脑血管病提供了一种潜在的治疗方法,即外源性NSCs的移植治疗。然而脑缺血后移植的NSCs分化成熟至一定阶段后轴突内在生长能力和再生能力下降,使得脑缺血后神经功能的恢复有限。PTEN作为一种肿瘤抑制基因被发现在神经系统的表达也较为广泛,Perandones等[6]在鼠的大脑皮质、小脑、海马及嗅球等部位的神经元发现均有PTEN表达。本研究发现NSCs诱导分化后PTEN和P-S6R细胞免疫荧光染色为阳性,证实了NSCs分化成熟过程中PTEN和P-S6R均有表达,其中PTEN在胞浆和胞核中均有表达,而P-S6R主要表达在胞浆中。PTEN主要通过其脂质磷酸酶活性作用于下游PI3K的下游靶分子PIP3,从而使PIP3脱磷酸化生成PIP2阻断AKT 及其下游激酶的活性[7,8]。PI3K/Akt/mTOR信号通路是参与细胞增殖﹑分化﹑凋亡和代谢的重要信号通路,mTOR是PI3K/Akt信号通路下游的一个效应分子,mTOR激活后,可激活下游靶蛋白PS6R。P-S6R活化后促进核糖体蛋白和翻译调节蛋白的合成,从而对蛋白合成进行调节。已经证实,Akt/mTOR/P-S6R通路可通过调节cap-依赖性蛋白翻译的起始来调控蛋白质合成,控制细胞的生长和大小,支持细胞的生长和存活[9]。因此,PTEN可通过负性调节P-S6R的活性,抑制相关蛋白的生成和细胞的生长,从而限制细胞和组织的过度增殖。本研究显示,与分化0d和1d相比,NSCs分化至第3天时,PTEN表达明显增高(均P﹤0.01),而P-S6R明显下降(均P﹤0.01);分化至第7天时,PTEN的表达仍然较高(P﹤0.01和P﹤0.05),P-S6R表达较低(均P﹤0.01)。这说明NSCs分化成熟过程中PTEN表达逐渐增高,而P-S6R的表达逐渐下降。据此,我们推测在 NSCs分化成熟过程中PTEN/mTOR信号通路很可能是通过PTEN抑制mTOR的活性,下调了P-S6R的表达,从而参与抑制NSCs分化成熟后细胞增殖和轴突的生长能力。类似的研究发现PTEN在未分化的神经元和PC12细胞中表达很低,而在用神经营养素诱导分化后的神经元内表达上调[10]。
PTEN在体内神经系统发育成熟过程中也有相似的改变。Lachyankar等[11]研究发现,PTEN在小鼠脑发育晚期约在出生0d开始表达,成年时达高峰。在神经元的发育过程中,树突中的PTEN的表达进行性增加,成年时到达高峰,从而下调蛋白合成,限制树突的生长和突触的可塑性。这些研究结果提示在中枢神经系统发育成熟过程中PI3K/Akt/mTOR一方面促进神经细胞的增殖分化成熟;另一方面又通过上调PTEN抑制PI3K/AKT/mTOR通路,从而抑制神经细胞及其轴突的过度分化生长,动态地调节神经系统的平衡,维持神经系统的正常生理功能。然而成熟神经系统PTEN的高表达抑制了神经细胞及其轴突的生长能力,不利于脑卒中后缺血灶周围神经的再生修复,从而影响患者的功能恢复。已有研究发现PTEN基因敲除的成年小鼠,室管膜下区的内源性神经干细胞具有明显增强的持续增殖能力及向神经元分化的能力[12,13]。
总之,本研究提示PTEN/mTOR信号通路是调控NSCs增殖分化成熟的重要分子机制,PTEN/mTOR的时空表达变化控制着NSCs的增殖分化和轴突生长能力。NSCs分化成熟过程中PTEN表达增高可能是导致神经干细胞分化成熟至一定阶段后增殖分化能力和轴突生长、再生能力下降、不能建立有效的突触联系的重要原因。本研究结果为提高神经干细胞移植治疗的效率提供了新思路,对探索脑缺血的有效治疗途径有重要意义。进一步的研究可在体外进行神经干细胞PTEN抑制实验,以观察NSCs的增殖分化能力和轴突生长、再生能力,再进行神经干细胞移植治疗脑缺血,以期能够更明显地促进脑缺血后的功能恢复。
[1]Miljan EA,Sinden JD.Stem cell treatment of ischemic brain injury[J].Curr Opin Mol Ther,2009,11(4):394-403.
[2]Park KK,Liu K,Hu Y,et al.Promoting axon regeneration in the adult CNS by modulation of the PTEN/mTOR pathway[J].Science,2008,322(5903):963-966.
[3]Liu K,Lu Y,Lee,J K,et al.PTEN deletion enhances the regenerative ability of adult corticospinal neurons[J].Nat Neurosci,2010,13(9):1075-1081.
[4]Park KK,Liu K,Hu Y,et al.PTEN/mTOR and axon regeneration[J].Exp Neurol,2010,223(1):45-50.
[5]Christie KJ,Webber CA,Martinez JA,et al.PTEN inhibition to facilitate intrinsic regenerative outgrowth of adult peripheral axons[J].J Neurosci,2010,30(27):9306-9315.
[6]Perandones C,Costanzo RV,Kowaljow V,et al.Correlation between synaptogenesis and the PTEN phosphatase expression in dendrites during postnatal brain development[J].Brain Res Mol Brain Res,2004,128(1):8-19.
[7]Gary DS,Mattson MP.PTEN regulates Akt kinase activity in hippocampal neurons and increases their sensitivity to glutamate and apoptosis[J].Neuromolecular Med,2002,2(3):261-269.
[8]Yamada KM,Araki M.Tumor suppressor PTEN:modulator of cell signaling,growth,migration and apoptosis[J].J Cell Sci,2001,114(13):2375-2382.
[9]Memmott RM,Dennis PA.Akt-dependent and-independent mechanisms of mTOR regulation in cancer[J].Cell Signal,2009,21(5):656-664.
[10]Musatov S,Roberts J,Brooks AI,et al.Inhibition of neuronal phenotype by PTEN in PC12 cells[J].Proc Natl Acad Sci U S A,2004,101(10):3627-3631.
[11]Lachyankar MB,Sultana N,Schonhoff CM,et al.A role for nuclear PTEN in neuronal differentiation[J].J Neurosci,2000,20(4):1404-1413.
[12]Gregorian C,Nakashima J,Le Belle J,et al.Pten deletion in adult neural stem/progenitor cells enhances constitutive neurogenesis[J].J Neurosci,2009,29(6):1874-1886.
[13]Groszer M,Erickson R,Scripture-Adams DD,et al.PTEN negatively regulates neural stem cell self-renewal by modulating G0-G1 cell cycle entry[J].Proc Natl Acad Sci U S A,2006,103(1):111-116.
