心肌缺血对左回旋支冠状动脉内和心外膜心肌起搏阈值的影响
2013-08-10侯倩崔炜谢瑞芹王欢刘静呼海娟
侯倩 崔炜 谢瑞芹 王欢 刘静 呼海娟
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)中,若发生有症状的药物治疗无效的缓慢性心律失常,需行心脏临时起搏[1]。对于接受复杂PCI 的高龄患者,该事件的发生率甚至超过50%[2-3]。对此,临床尚缺乏有效的预测方法,相关处理措施亦有待进一步完善[4-6]。1984 年Meier[7]首次应用冠状动脉内临时起搏,该方法启动迅速、成功率高且不影响PCI 操作,已被越来越多的学者考虑用于纠正该种心律失常[4-6,8],但相关研究多限于临床实践,少有动物实验及深入的机制论证。本研究旨在观察心肌缺血180 min 内对兔左回旋支(LCX)冠状动脉内和心外膜心肌起搏阈值的影响,并探讨可能机制,为PCI 中冠状动脉内起搏的临床可行性提供理论依据。
资料与方法
1. 实验动物及分组:健康雄性家兔4 ~6 月龄20 只,平均体重为(2.7 ±0.3)kg,由河北医科大学实验动物中心提供,被随机分入A 组(10 只,经LCX冠状动脉内起搏)、B 组(10 只,经心外膜心肌起搏)。术前1 h 饲喂美托洛尔片4 mg/kg 控制心室率。
2. 动物模型制备:称重后以3%戊巴比妥钠30 mg/kg 经耳缘静脉麻醉。气管插管,呼吸机辅助呼吸;右颈总动脉插管持续检测血压、心率;监测Ⅱ导联心电图。于胸骨左侧第3 ~5 根肋骨处开胸,小心剪开心包。于LCX 中点以远3 ~5 mm 处钩置临时起搏导丝(FEP13 ETHICON 公司),既往研究证实该处为心肌梗死的中心区域[9];导丝深度,A 组至LCX内,B 组至LCX 下1 ~2 mm 的肌层。测量基础起搏阈值,然后以0 号外科线结扎LCX 中点。结扎点以远心肌颜色变为灰白,周边出现暗红色充血带。心电图出现明显T 波高尖、ST 段抬高,说明兔心肌梗死模型制备成功。
3. 起搏阈值的测定:将起搏器(型号:5318,Medtronic 公司)连线端鼠尾夹分别连于导丝末端(-)及兔胸部皮肤(+)。分别测量结扎前及结扎后10、20、30、40、50、60、75、90、105、120、140、160、180 min 起搏阈值。测量模式为:固定脉宽0.5 ms,以高于自身心率20 次/min、1 V 发放电脉冲,逐渐升高电压,直至发生心室夺获[7],该电压即为起搏阈电压。鉴于频繁电刺激可能对起搏阈值造成影响,故同一时间点仅行两次测量,取其均数;若同一时间点阈值变化率大于10%,则须再次测量,取数值相近两者的均数。实验期间若兔心率超过起搏器的频率范围(>180 次/min),则于电刺激前静脉给予利多卡因2.0 mg/kg;若推注利多卡因后心率控制不理想,则终止实验。
4. 测量区域正确性检测:实验完毕后采用夹闭大血管法迅速处死家兔,取出心脏,用生理盐水冲洗,-20℃冷冻30 min。于钩置导丝处垂直于心脏长轴切片,厚度约2 mm,浸入37℃氯化三苯基四氮唑(TTC)液中恒温水浴20 min 染色。钩置导丝处心肌呈灰白色,证明导丝位置正确。
5. 统计学分析:采用SPSS 16.0 软件进行数据分析,计量资料以 珋x ±s 表示。时间效应与组间效应采用重复测量方差分析,同一时间点两组比较采用t检验。以P <0.05 为差异有统计学意义。
结 果
1. 实验数据剔除情况:A 组心室率控制不良1只,导丝脱出2 只,顽固心室颤动致死亡1 只;B 组心率控制不良1 只,导丝脱出1 只,数据明显离群1只。最终家兔有效例数:A 组6 只,B 组7 只。结扎第30、50 分钟时,数据方差不齐,予以剔除。
2. 基线情况比较:A、B 两组基础心率[(165.4±5.2)次/min 比(167.7 ±4.8)次/min,P >0.05]、基础起搏阈值[(0.82 ±0.12)V 比(0.80 ±0.12)V,P >0.05]与起搏心电图比较(图1,2),差异均无统计学意义。
3. 结扎LCX 后起搏阈值的比较:与基础起搏阈值相比,A、B 两组结扎后各时间点起搏阈值均明显增高(P <0.05)。结扎前20 min,两组起搏阈值变化趋势相似;结扎10 min 均急剧增高[(4.37 ±0.59)V 比(3.97 ±0.96)V,P >0.05],约为基础起搏阈值的5 倍;结扎20 min 均明显回落[(2.13 ±0.59)V 比(1.89 ±0.75)V,P >0.05],约为基础起搏阈值的2 倍。自此至结扎3 h,A 组起搏阈值保持该水平不变[(1.60 ±0.62)V 比(2.13 ±0.59)V,P>0.05],B 组则逐渐增高,与A 组相比,差异有统计学意义[(6.86 ±1.65)V 比(1.60 ±0.62)V,P <0.05](表1、图3)。
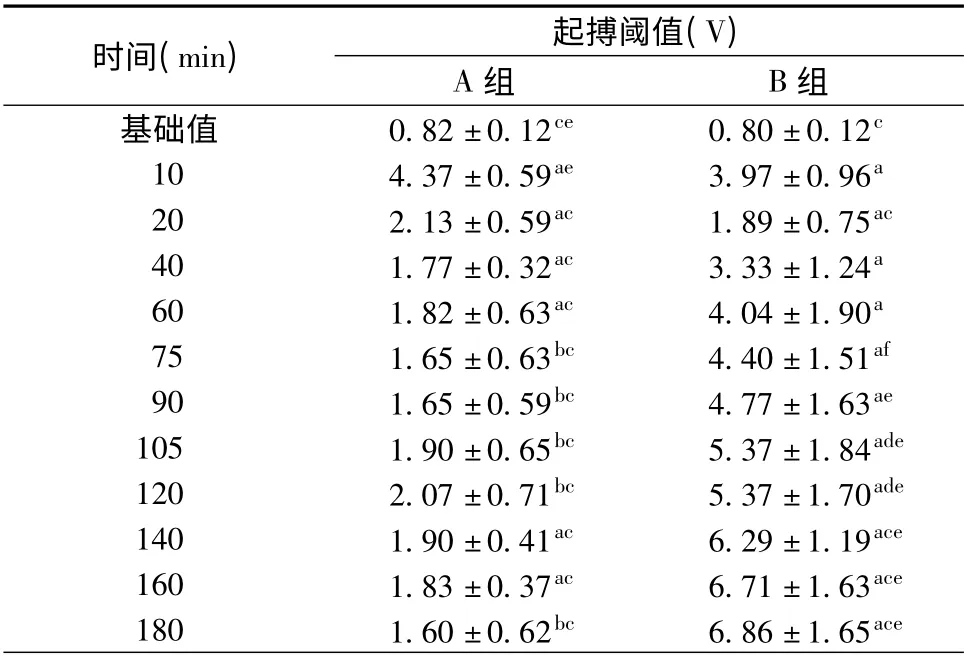
表1 结扎左回旋支对兔心室起搏阈值的短期影响(珋x±s)
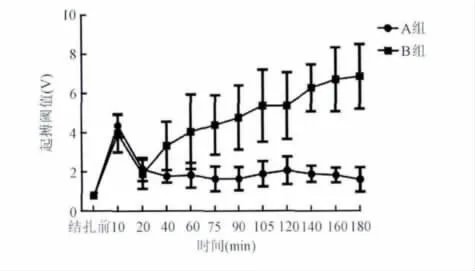
图3 结扎兔左回旋支后冠状动脉内和心外膜心肌起搏阈值的变化
讨 论
本研究结果显示,结扎LCX 20 min 内,两组起搏阈值骤升后均呈现骤降的变化趋势,这可能与缺血心肌组织失代偿后逐步代偿有关。以往的研究证实,结扎LCX 后,灌注停止区心肌即刻形成侧支循环,但侧支循环代偿能力自结扎4 min 左右便逐渐减弱,且兔心肌侧支循环较少,代偿能力有限,故其梗死心肌起搏阈值最佳回落效果仍为基础水平的2~3 倍。
结扎20 min 后,梗死处心外膜心肌起搏阈值再次升高,这可能为多种因素共同作用的结果。诸多研究证实,心肌缺血可造成多种离子通道活性的下降,致使心肌电生理活性减低甚至丧失。黄冬等[10]认为,导丝周围心肌的水肿及炎症因子的大量释放和聚集,可产生反应层和慢局部传导层,导致起搏阈值增高。Matsunari 等[11]发现,与心肌相比,心脏神经组织因耐受缺血能力较弱,易产生更早、更广泛的损害。朱俊等[12]报道,“血痂”黏附导丝后可显著增大阻抗,提高起搏阈值。但与心外膜心肌起搏阈值的变化趋势不同,结扎20 min 后LCX 冠状动脉内起搏阈值则相对平稳的保持在较低水平(约为基础阈值的2 倍),均在可起搏范围内,原因可能与心肌缺血较晚累及心外膜、动脉周围有神经伴行及动脉壁和心外膜有一定导电性有关。
由此推测,结扎20 min 后两组起搏阈值变化趋势产生明显差异的原因可能为电刺激传导路径不同:当导丝钩置于冠状动脉内时,电刺激较易穿透薄层血管壁,通过耐受缺血能力较强且含有神经纤维的心外膜传导至正常心肌,进而扩布至整个心室产生夺获;当导丝钩置于心外膜心肌内时,损伤或坏死导致心肌阻抗增大,传递电刺激能力降低,电刺激须达较高强度才能通过受损心肌传递至正常心肌。另外,B 组1 只家兔起搏阈值在140 min 出现骤降,大小与同时间点A 组水平相近,可能原因即为与导丝接触的心肌坏死断裂,致使电刺激传导路径改变。
本研究结果提示,心肌缺血后兔冠状动脉内起搏阈值仅短暂波动后即平稳维持在相对较低水平,3 h 内均可安全行冠状动脉内起搏。临床上,越来越多的学者倾向于即刻应用冠状动脉内原有导丝行冠状动脉内起搏处理PCI 中并发的药物治疗无效的缓慢性心律失常。相较于目前推崇的“静脉穿刺+经右心室临时起搏”,该操作十分简捷,仅需将冠状动脉内原有导丝作为阴极,粘贴皮肤电极作为阳极,后连接临时起搏器起搏,从而避免了血流动力学不稳定条件下的额外静脉穿刺,不影响原有PCI 操作,减少并发症和手术成本。一系列的研究证实,多种常用指引导丝均可成功完成冠状动脉内起搏,且效果与经右心室起搏相当;另外,应用有绝缘涂层的导丝,并于后胸壁安置皮肤电极,或应用被扩张球囊绝缘的导丝可使操作成功率达100%[4-6]。最近的研究发现,Visionwire 导丝的效果优于其他标准导丝,无需球囊的隔离,其起搏夺获成功率也达100%[6]。也有研究显示,冠状动脉内起搏30 min 内安全有效,除增加骨骼肌收缩电位外,尚未发现其存在严重并发症;但持续数小时的冠状动脉内起搏则可能导致血栓形成,故持续的缓慢性心律失常最终仍需采取经典的经冠状静脉或右心室起搏,但即使在此种情况下,也应首先进行冠状动脉内起搏,以便快速稳定血流动力学,为下一步抢救提供充足时间[4-5]。
目前,虽然冠状动脉内起搏的方法尚不完善,但有望成为处理PCI 术中突发缓慢性心律失常的新型临时起搏手段。另外,本研究样本量尚不充足,心肌缺血对冠状动脉内起搏阈值的影响情况仍需进一步的研究验证。
[1] O'Gara PT,Kushner FG,Ascheim DD,et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction:executive summary:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation,2013,127:529-555.
[2] Mixon TA,Cross DS,Lawrence ME,et al. Temporary coronary guidewire pacing during percutaneous coronary intervention.Catheter Cardiovasc Interv,2004,61:494-500.
[3] Mixon TA,Dehmer GJ,Santos RA,et al. Guidewire pacing safely and effectively treats bradyarrhythmias induced by rheolytic thrombectomy and precludes the need for transvenous pacing:the Scott & White experience. J Invasive Cardiol,2008,20:5A-8A.
[4] Heinroth KM,Carter JM,Buerke M,et al. Optimizing of transcoronary pacing in a porcine model. J Invasive Cardiol,2009,21:634-638.
[5] Heinroth KM,Stabenow I,Moldenhauer I,et al. Temporary trans-coronary pacing by coated guidewires:a safe and reliable method during percutaneous coronary intervention. Clin Res Cardiol,2006,95:206-211.
[6] Heinroth KM,Unverzagt S,Buerke M,et al. Transcoronary pacing in a porcine model--impact of guidewire insulation. J Invasive Cardiol,2011,23:108-114.
[7] Meier B. Coronary pacing for bradycardia during balloon angioplasty. N Engl J Med,1984,311:800.
[8] Parakh N,Asotra S,Singh S,et al. Transcoronary pacing:are the modern wires effective. Indian Heart J,2009,61:160-162.
[9] 侯倩,崔炜,谢瑞芹,等. 起搏阈值测量用兔心肌梗死模型的制备. 河北医科大学学报,2011,32:1244-1247.
[10] 黄冬,李京波,刘铭雅,等. 起搏器术后急性期起搏阈值异常增高一例. 中国心脏起搏与心电生理杂志,2009,23:182.
[11] Matsunari I,Schricke U,Bengel FM,et al. Extent of cardiac sympathetic neuronal damage is determined by the area of ischemia in patients with acute coronary syndromes. Circulation,2000,101:2579-2585.
[12] 朱峻,刘世玉,周兴文,等. 起搏导线与起搏器连接处血痂致起搏阈值增高一例. 中国心脏起搏与心电生理杂志,1999,13:169.
