Mo-SCN--亮绿光度法测定豆类食品中的钼
2013-08-07刘英红马卫兴
刘英红,刘 娟,马卫兴,沙 鸥
(淮海工学院化学工程学院,江苏 连云港 222005)
钼是人体必需的一种微量元素,在众多的生理活动中起重要作用,它在机体内含量的多少将直接影响人类的健康。钼缺乏可以导致龋齿、肾结石、心肌坏死、动脉硬化、免疫功能降低等症状或疾病,甚至可以导致多种癌症发生率增高。而过量的钼又可以导致骨关节病变和心脑血管疾病等[1]。钼主要通过食物链的迁移进入人体。一般而言,植物性食物以豆类及其制品含量最丰富,动物性食物以海产品中含量最高,其次是动物的肝脏和肾脏[2]。目前,对钼的测定方法主要有原子吸收分光光度法[3-6]、原子发射光谱法[7-8]、分光光度法[9-13]、荧光光谱法[14-16]和电化学分析法[17-18]等。由于分光光度法具有仪器简单、操作方便和准确度高等优点,本实验选择分光光度法对食品中的微量钼进行测定。近年来,利用钼与硫氰酸盐形成络阴离子,再与阳离子染料形成离子缔合物的分光光度法测定钼引起了人们的注意,该方法具有较好的灵敏度和选择性[13]。在硫酸介质中,钼(Ⅵ)在被盐酸羟胺还原为钼(Ⅴ)后,与SCN-和亮绿SF(淡黄)(以下简称亮绿)形成三元离子缔合物,通过测定该离子缔合物间接测定钼。将实验方法用于豆类食品中微量钼的测定,结果表明,方法准确、灵敏,且选择性较好。
1 材料与方法
1.1 材料、试剂与仪器
豆类样品(红豆、黄豆和绿豆) 市购。
所用试剂均为分析纯,实验用水为二次蒸馏水。
钼(Ⅵ)标准储备溶液(1g/L):准确称取钼酸铵[(NH4)2MoO4]0.1841g于250mL烧杯中,溶解后转移并定容于100mL容量瓶中,使用时稀释为10μg/mL的标准工作溶液;亮绿溶液(0.5g/L);硫氰酸钾溶液(20g/L);聚乙烯醇溶液(10g/L);盐酸羟胺溶液(10g/L);硫酸溶液(1+1);盐酸溶液(1+1)。
WFZ UV-2000型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;TAS-990AFG型原子吸收分光光度计北京普析通用仪器有限公司。
1.2 方法
1.2.1 样品的预处理方法
将适量红豆、黄豆和绿豆样品分别捣碎,置于110℃的烘箱内烘干,研成粉末。称取5.0g粉末于干燥的瓷坩埚中,在电炉上炭化至浓烟挥发尽(若有黑色颗粒,则加入几滴HNO3(1+1)于电炉上赶去HNO3,再移入马弗炉中灰化至完全)。将炭化后的样品移入马弗炉中于700℃灰化3h,用4mL(1+1)的盐酸溶解后过滤,再以氢氧化钠溶液调节至pH值为7,将其定量转移至50mL容量瓶,用水稀释至刻度线,摇匀,作为样品溶液待用。
1.2.2 测定方法
准确移取适量样品溶液于25mL比色管中,依次加入7.0mL硫氰酸钾溶液、5.0mL盐酸羟胺溶液、1.0mL聚乙烯醇溶液、1.0mL硫酸溶液和1.5mL亮绿溶液,用水定容,室温下反应60min,同时配制相应的不含钼的试剂空白溶液。在488nm处,以试剂空白为参比,测定溶液的吸光度A。按照标准曲线的回归方程计算钼的质量浓度。
2 结果与分析
2.1 吸收曲线
配制0.8μg/mL含钼标准溶液和相应试剂空白溶液,以水为参比,在380~510nm范围内分别对试样溶液和试剂空白溶液进行波长扫描,绘制吸收曲线,结果如图1所示。由图1可见,钼、硫氰酸盐和亮绿由于形成离子缔合物而发生了明显的显色反应,吸光度变化值在488nm波长处达到最大,即缔合物的最大吸收波长位于488nm,所以选定488nm作为测定波长。
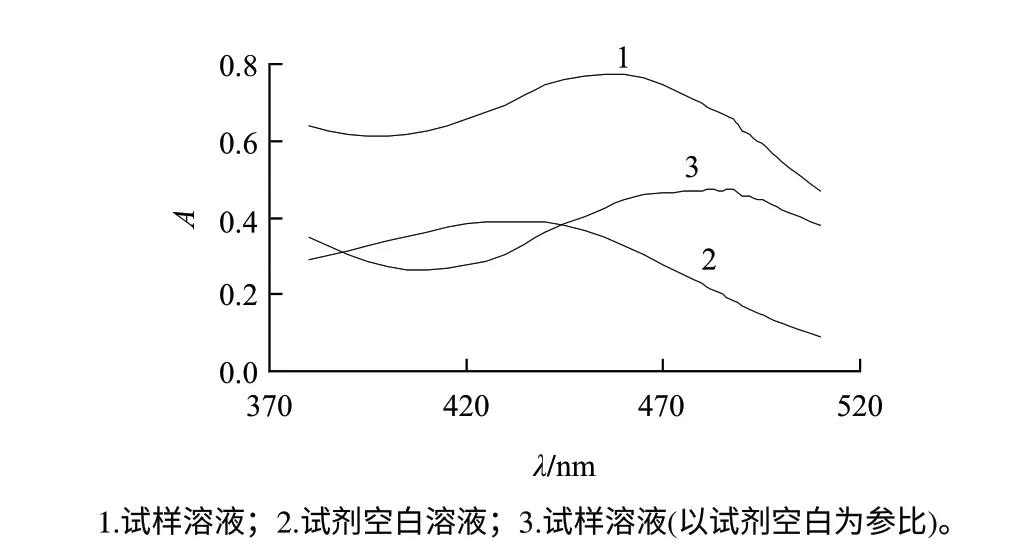
图 1 吸收光谱Fig.1 Absorption spectra
2.2 反应介质及其用量的选择
分别以不同的缓冲溶液作为反应介质,考察反应介质对吸光度的影响,结果见表1。以硫酸(1+1)为反应介质时体系吸光度最大,所以后续实验选择硫酸(1+1)作为反应介质。硫酸用量对体系吸光度的影响见图2。硫酸用量在1.0~2.0mL之间时,吸光度最大且稳定,本实验选择1.0mL作为最佳用量。
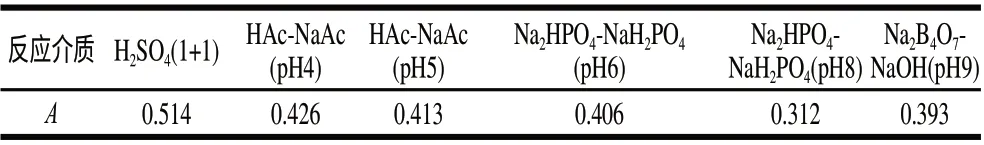
表 1 反应介质的影响Table 1 Effect of reaction media on the absorbance of the reaction system
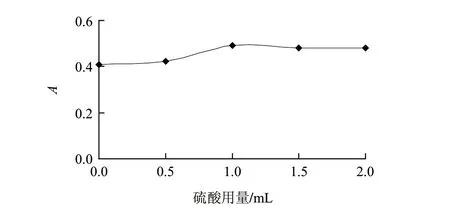
图 2 硫酸用量的影响Fig.2 Effect of sulfate solution volume on the absorbance of the reaction system
2.3 反应时间的影响和体系的稳定性
分别在不同的反应时间测定体系的吸光度,以确定反应完全所需要的时间以及体系能够稳定存在的时间,结果如图3所示。结果表明,三元缔合物完全反应所需要的时间为60min,该三元缔合物体系至少可以稳定存在90min。本实验选择在室温条件下反应60min后进行测定。

图 3 反应时间的影响Fig.3 Effect of reaction time on the absorbance of the reaction system
2.4 亮绿用量的影响
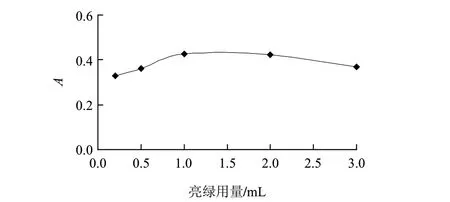
图 4 亮绿用量的影响Fig.4 Effect of light green volume on the absorbance of the reaction system
由图4可见,亮绿用量在1.0~2.0mL范围内,体系的吸光度最大且稳定。后续实验中选择亮绿的用量为1.5mL。
2.5 硫氰酸钾用量的影响

图 5 硫氰酸盐用量的影响Fig.5 Effect of potassium thiocyanate volume on the absorbance of the reaction system
图5表明,硫氰酸钾用量在7.0~8.0mL时体系的吸光度最大且稳定,后续实验中选择7.0mL。
2.6 盐酸羟胺用量的影响
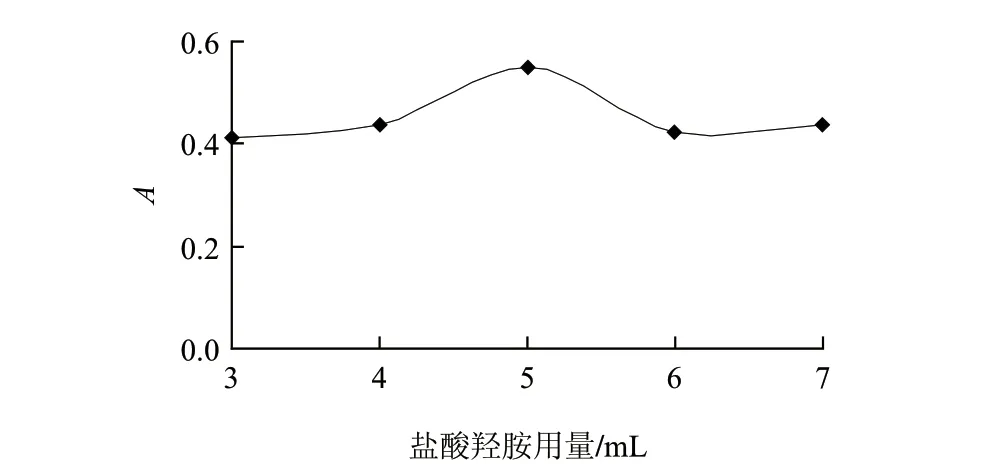
图 6 盐酸羟胺用量的影响Fig.6 Effect of hydroxylamine hydrochloride volume on the absorbance of the reaction system
钼的硫氰酸盐光度法中常加入还原剂,使钼(Ⅵ)还原为钼(Ⅴ)后才能与SCN-配位。本实验选择盐酸羟胺作为还原剂,盐酸羟胺溶液的用量为5.0mL时,体系的吸光度最大(图6)。选用5.0mL作为最佳用量。
2.7 聚乙烯醇用量的影响
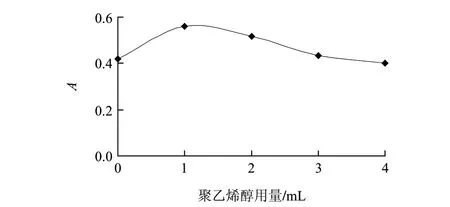
图 7 聚乙烯醇用量的影响Fig.7 Effect of polyvinyl alcohol volume on the absorbance of the reaction system
聚乙烯醇对体系具有增敏作用,且当聚乙烯醇用量为1.0mL时增敏效果最佳(图7)。本实验选择1.0mL聚乙烯醇作为增敏试剂。
2.8 共存离子的影响
当钼的质量浓度为0.4μg/mL时,考察干扰离子对体系的影响。结果表明,在±5%误差范围内,干扰离子的允许共存量为(以倍数计):Na+、K+(1000),Mg2+、Al3+、
Ca2+(500),Fe3+、Ni2+、Mn2+、Hg2+、Cd2+(100);NO3-、SO42-、Cl-(200);Zn2+(100,2mL、5g/L的邻二氮菲)。
2.9 标准曲线和检出限
按实验方法配制不同质量浓度(μg/mL)的钼标准溶液,并分别测定各溶液的吸光度,绘制标准曲线。结果表明,钼的质量浓度在0.04~1.60μg/mL范围内符合比尔定律,曲线的线性回归方程为A=0.4002C+0.1289,线性相关系数r=0.9994,表观摩尔吸光系数ε=3.8×104L/(mol·cm)。对试剂空白进行11次平行测定,利用3S/K(S为对试剂空白进行11次测定的标准偏差,K为标准曲线的斜率)求得方法的检出限为0.011μg/mL。
2.10 样品分析
分别移取适量红豆、黄豆和绿豆样品溶液,按实验方法分别测定吸光度,根据工作曲线的回归方程计算样品中钼的质量浓度,将测定结果与原子吸收分光光度法进行比较。同时向适量豆类样品中加入适量的钼标准溶液,按样品的预处理方法处理后按照实验方法测定,计算回收率,以验证方法的准确度,结果如表2所示。
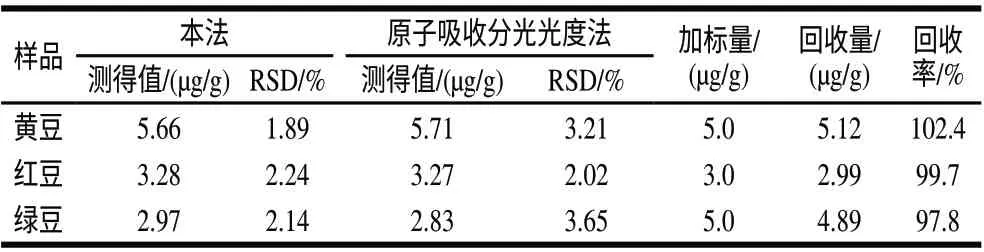
表 2 样品测定结果与回收率(n=7)Table 2 Analytical results of samples and recovery (n=7)
3 结 论
本实验采用钼-硫氰酸盐-亮绿三元离子缔合物体系利用分光光度法对豆类食品中的钼进行了分析测定。方法采用的仪器和试剂均廉价、易得,结果准确、可靠。所以是测定食品中钼的一种较好的分析方法。
[1] 韦友欢, 黄秋蝉. 钼对人体健康的生理效应及其机制研究[J]. 广西民族师范学院学报, 2010, 27(5): 10-12.
[2] 郑艺梅, 胡承孝. 食物中的钼与人体健康[J]. 广东微量元素科学,2005, 12(8): 1-4.
[3] LIANG Pei, LI Qian, LIU Rui. Determination of trace molybdenum in biological and water samples by graphite furnace atomic absorption spectrometry after separation and preconcentration on immobilized titanium dioxide nanoparticles[J]. Microchimica Acta, 2009, 164(1/2):119-124.
[4] BERMEJO-BARRERA P, PITA-CALVO C, BERMEJO-BARRERA A, et al. Chemical modifiers in the determination of molybdenum in human serum by electrothermal atomic absorption spectrometry[J].Fresenius J Anal Chem, 1991, 340(4): 265-268.
[5] 聂莉, 李敏, 张晓炜, 等. 食品中钼含量的石墨炉原子吸收测定方法[J]. 中国卫生检验杂志, 2009, 19(4): 791-793.
[6] 商博, 东杨君, 吴颖虹, 等. 石墨炉原子吸收光谱法测定蔬菜中钼[J].中国卫生检验杂志, 2011, 21(6): 1365-1366.
[7] FERREIRA S L C, DOS SANTOS H C, DE JESUS D S. Molybdenum determination in iron matrices by ICP-AES after separation and preconcentration using polyurethane foam[J]. Fresenius J Anal Chem,2001, 369(2): 187-190.
[8] 王金云, 唐永伦, 黄勤, 等. 盐酸提取-电感耦合等离子体原子发射光谱测定土壤中的有效钼[J]. 安徽地质, 2011, 21(3): 211-213.
[9] ZAKI M T M, EL-SAYED A Y. Use of quercetin in an improved method for molybdenum determination in waste water, silicate rocks and diverse alloys[J]. Microchimica Acta, 1992, 106(3/6): 153-161.
[10] DIMITROV A N, LEKOVA V D GAVAZOV K B, et al. Ternary complex of molybdenum (Ⅵ) with 4-nitrocatechol and tetrazolium blue chloride and its application to extraction-spectrophotometric analysis of ferrous metallurgy products[J]. J Anal Chem, 2007, 62(2): 122-125.
[11] 邹晓莉, 黎源倩. CCD-二极管阵列检测流动注射分光光度法分析食品中的钼[J]. 分析测试学报, 2005, 24(4): 98; 100.
[12] 范旭, 李在均. 新型离子液体作为溶剂萃取光度法测定环境水中超痕量钼[J]. 分析试验室, 2008, 27(3): 17-20.
[13] 万益群, 许益敏, 万承波. 钼-硫氰酸盐-结晶紫-聚乙烯醇显色反应研究及应用[J]. 南昌大学学报: 理科版, 2001, 25(1): 87-89.
[14] 乔善宝, 王庆东, 焦昌梅. 异丙肾上腺素荧光分光光度法测定豆样中痕量钼[J]. 理化检验: 化学分册, 2009, 45(9): 1051-1052; 1055.
[15] 尚虹. 荧光光度法测定自来水及尿样中痕量钼[J]. 中国卫生检验杂志, 2009(19): 1505-1506.
[16] 王丽红, 张辉, 李德玲. 催化荧光光度法测定痕量钼(Ⅵ)[J]. 理化检验: 化学分册, 2009, 45(9): 1072-1074.
[17] ROBERT P, EWA N, BEATA P B. The determination of molybdenum in selected mushrooms by stripping voltammetry[J]. Central Eur J Chem, 2011, 9(2): 352-356.
[18] 周连君, 尤进茂, 徐富清, 等. 吸附溶出伏安法测定钼(Ⅵ)[J]. 分析化学, 1996, 24(6): 735.
