响应面设计法优化川贝母茎和叶中总生物碱的提取工艺
2013-08-07张剑光吕露阳张志锋
张剑光,徐 彦,刘 圆,吕露阳,曾 锐,张志锋*
(西南民族大学少数民族药物研究所,四川 成都 610041)
川贝母为百合科贝母属多种植物的干燥鳞茎,其中包括川贝母(卷叶贝母)、暗紫贝母、甘肃贝母或梭砂贝母等[1-2]。川贝母是食疗佳品,可单独研粉服用或者与梨蒸服,有清热润肺、化痰止咳的功效,与冰糖同食,其化痰止咳、润肺养阴的效果更加明显[3]。川贝母中含有多种类型化学成分,包括多糖、生物碱、核苷等。现代研究认为,总生物碱是其主要有效成分[4-6],其药理活性广泛,包括镇咳、祛痰、平喘、抗菌、镇静、镇痛、心血管活性等。近年来有关川贝母鳞茎中生物碱含量的研究已有较多报道[7-12],有关地上部分的研究较少,吴启秀等[13]对川贝母地下和地上部分的HPLC指纹图谱进行了比较,发现其含有一些相似的化学成分,但未进行含量测定。由于川贝母的大多来自野生资源,需求逐渐加大,导致野生资源日趋匮乏,因而其地上部分的食疗价值也逐渐受到关注。
鉴此,本实验对川贝母的资源品种之一卷叶贝母的茎、叶中的总生物碱进行研究,运用响应面设计试验优化其总生物碱的提取工艺,并定量比较了人工种植和野生卷叶贝母茎、叶中的总生物碱含量差异,以期为川贝母植物的综合利用及扩大药源方面的研究提供依据。
1 材料与方法
1.1 材料与试剂
野生卷叶贝母的茎和叶采于四川省康定县折多山(海拔3800m);人工种植卷叶贝母茎和叶采于四川省康定县新都桥(海拔3400m)。
贝母素乙对照品(批号:110751-200709) 中国食品药品检定研究院;溴麝香草酚蓝 新中化学厂;邻苯二甲酸氢钾 成都化学试剂厂;浓氨水 成都化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
Unicam UV-500紫外分光光度计 美国热电公司;Mettler AE240电子分析天平 瑞士梅特勒-托利多仪器公司;W201B恒温水浴锅 上海申顺生物科技有限公司;多功能粉碎机 广州雷迈公司。
1.3 方法
1.3.1 川贝母茎叶中总生物碱的提取
取川贝母茎、叶粉末0.5g,精密称定置于50mL圆底烧瓶中,加入适量浓氨试液浸泡一段时间,加入氯仿-甲醇混合溶剂,水浴加热回流提取,按照单因素考察、响应面设计表设定的条件进行提取,放冷过滤,挥干溶剂,用甲醇定容至25mL,静置。
1.3.2 标准曲线的绘制
精密称取干燥至质量恒定的贝母素乙对照品0.0125g,用甲醇溶解定容于25mL的容量瓶中,然后再精密吸取1、1.5、2、2.5、3、3.5、4、5mL分别定容于10mL容量瓶中。分别吸取1mL标准品,置分液漏斗中,加氯仿14mL,邻苯二甲酸氢钾缓冲液缓冲液(pH5.0)5mL,溴麝香草酚蓝溶液2mL,充分振摇,静置30min使充分分层,取下层氯仿液,用干燥滤纸滤过,取续滤液,在415nm处测定其吸光度[8]。以贝母素乙标准溶液质量浓度做横坐标、吸光度做纵坐标,其回归方程为Y=4.799X-0.1353,R2=0.9993,表明贝母素乙标准品质量浓度在0.050~0.25mg/mL范围内与吸光度呈良好线性关系。
1.3.3 贝母总生物碱的含量计算
精密吸取样品溶液1mL,按1.3.2节中的测定方法测定其吸光度,重复3次,取其平均值为最终吸光度,再依据线性方程计算1mL样品溶液中所含贝母总生物碱的量(mg),即样品溶液贝母总生物碱的质量浓度(mg/mL),根据以下公式计算贝母总生物碱的含量。

式中:C为贝母总生物碱的质量浓度/(mg/mL);V为提取液定容体积/mL;m为贝母粉末质量/g。
1.3.4 单因素试验
称取0.5g川贝母茎粉末分别加入4倍体积的氨水浸泡4h后,加入20倍体积混合溶剂(氯仿:甲醇=4:1),70℃水浴回流4h,以吸光度为指标评价提取效果,固定其他条件,分别考察氨水浸泡时间(1~8h)、液料比(10:1:1~50:1)、提取温度(30~90℃)、提取时间(2~10h)对吸光度的影响。
1.3.5 响应面设计试验
根据单因素的试验结果和Box-Behnken试验设计原理[14],选取影响贝母茎总生物碱提取效果的主要因素氨水浸泡时间、提取时间、液料比、提取温度,对这4个因素均设定3水平进行响应面设计试验。
2 结果与分析
2.1 单因素试验
2.1.1 氨水浸泡时间

图 1 氨水浸泡时间对总生物碱提取的影响Fig.1 Effect of ammonia soaking time on the extraction effi ciency of total alkaloids
从图1可以看出,氨水浸泡时间对总生物碱的提取效果影响很大,提取效果随氨浸泡时间的延长先增大后减小,浸泡时间为4h时达到最佳,随后随时间的延长而迅速减小。
2.1.2 液料比

图 2 液料比对总生物碱提取效果的影响Fig.2 Effect of ratio of liquid to solid material on the extraction effi ciency of total alkaloids
从图2 可以看出,开始时贝母总生物碱的提取效果随液料比的增加而增大,增幅较明显,说明此因素对提取效果的影响较大。当液料比达到3 0:1时,贝母总生物碱提取效果最好,继续增大液料比时,总生物碱的溶出不再增加,故选择30:1为最宜液料比。
2.1.3 提取温度

图 3 提取温度对总生物碱提取效果的影响Fig.3 Effect of extraction temperature on the extraction effi ciency of total alkaloids
从图3可以看出,提取温度对茎的总生物碱提取效果影响较大,提取效果随温度呈先上升后下降的趋势,70℃时提取效果最好。这是因为温度的升高,液体黏度下降,分子运动加快,加快溶质的扩散和溶剂的渗透,有利于生物碱的溶出,但随着温度的升高,部分热稳定性小的生物碱也会随之分解而影响贝母总生物碱的提取率。
2.1.4 提取时间
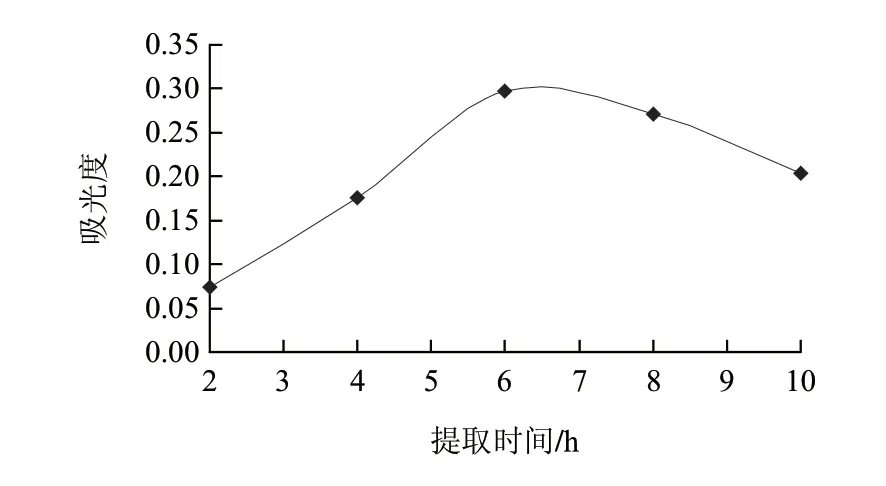
图 4 提取时间对总生物碱提取效果的影响Fig.4 Effect of extraction time on the extraction effi ciency of total alkaloids
从图4可以看出,提取时间对总生物碱提取效果的影响也很大,提取效果随提取时间的延长而先增大后减小,这可能是因为延长提取时间有利于药材粉末和提取溶剂的充分接触,利于贝母碱的溶出。但随时间的延长也有可能会导致部分生物碱的分解而使提取效果下降。故茎的最宜提取时间为6h。
2.2 响应面试验结果分析
2.2.1 模型的建立及显著性试验

表1 茎响应面分析方案及试验结果Table 1 Response surface design matrix with experimental and predicted values of total alkaloid content of F. cirrhosa D. Don leaves
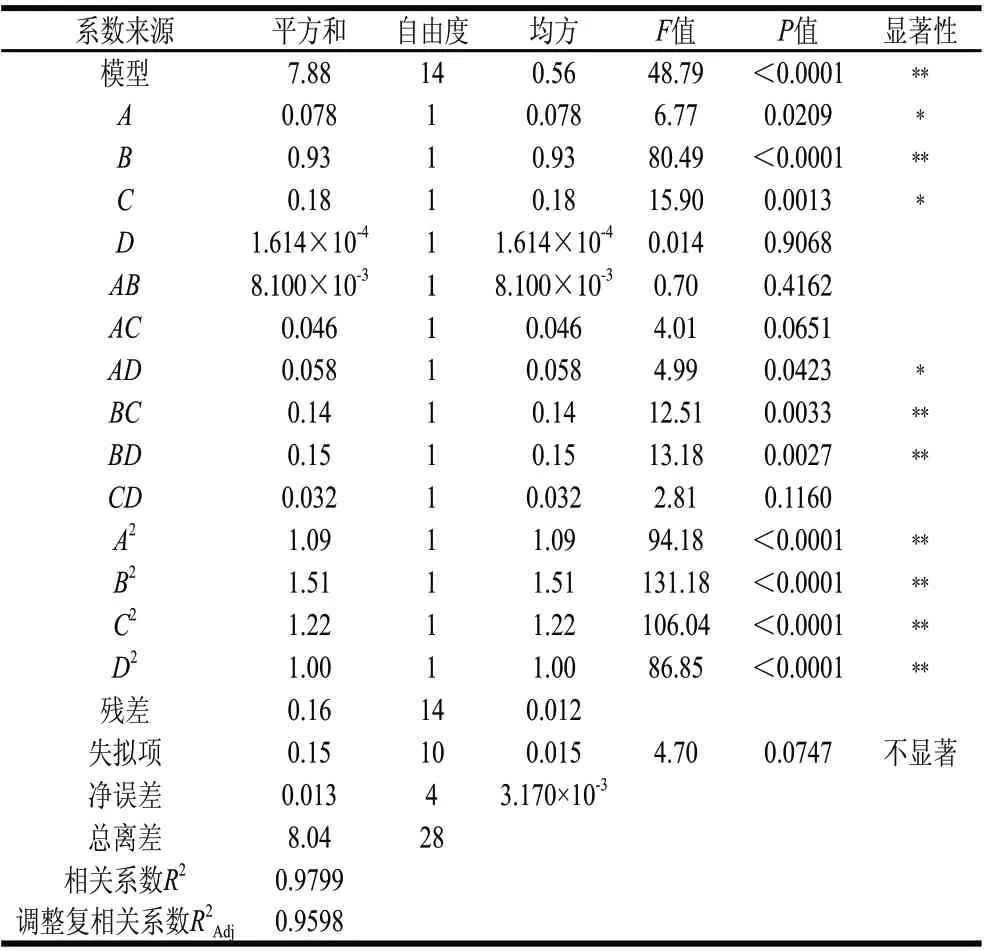
表2 回归统计分析表Table 2 ANOVA for the response surface regression model
根据表1的结果,运用Design-Exper 7.0软件对表2中的试验数据进行多元拟合回归,得回归方程:Y=1.54+0.29A-1.54B+0.45C+0.013D+0.045AB+0.11AC-0.12AD+0.19BC-0.20BD-0.090CD-0.41A2-0.48B2-0.43C2-0.39D2。模型系数显著性结果和方差分析结果见表2。
表2的数据可知,该模型极显著(P<0.0001),模型的R2=0.9799,调整复相关系数R2Adj=0.9188,模型失拟项P=0.0747>0.05,不显著,说明该模型显著,本试验所得的二次回归方程能很好地对响应值进行预测,拟合度好。
从表2可看出,一次项B,交互项BC、BD,二次项A2、B2、C2、D2表现为极显著;一次项A、C,交互项AD表现为显著;一次项D、交互项AB、AC、CD表现为不显著。比较各因素的F值,可得出各因素多实验结果的影响的大小顺序B>C>A>D,即提取时间>液料比>浸泡时间>提取温度。
2.2.2 响应面图分析
利用Design-Exper 7.0软件对表2数据进行二次回归多元拟合,所得到的二次回归方程的响应面图见图5。
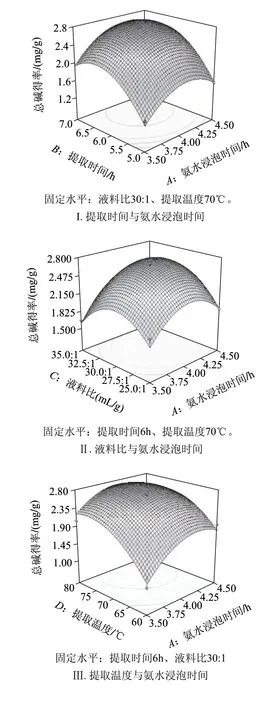

图 5 两因素交互作用对贝母茎总生物碱得率影响的响应面图Fig.5 Response surface plots for the effects of process parameters on the extraction effi ciency of total alkaloids from F. cirrhosa D. Don stems
该图形直观地给出了各因素交互作用响应面的3D图,从响应面的最高点可以看出,在所选范围内存在极值。从响应面曲面坡度的陡峭程度和等高线图可以看出因素间交互作用的强弱和因素对响应值的影响程度。图5表明提取时间和液料比的交互作用、提取时间和提取温度的交互作用、氨水浸泡时间和提取温度的交互作用较显著。以图5Ⅰ为例说明,在液料比30:1、提取温度70℃的条件下,总生物碱含量随提取时间的延长先增加后减小,亦随氨水浸泡时间的延长先增加后减小。其他各图依此分析,其分析结果与单因素试验结果基本一致。
2.2.3 最佳提取工艺的优化
由Design-Exper 7.0软件分析得到川贝母茎中总生物碱最佳提取工艺条件。茎的最佳工艺条件为氨水浸泡时间4.12h、提取时间6.37h、液料比30.74:1、提取温度73.69℃,在此条件下提取总生物碱,含量可达2.8577mg/g。进行验证实验,将茎的最佳提取条件修正为氨水浸泡时间4h、提取时间6.5h、液料比31:1、提取温度74℃,此条件下,人工种植川贝母茎中总碱的含量为2.7851mg/g,与理论预测值非常接近,因此,该方程能较真实地反映各因素对总碱提取效果的影响情况。
2.3 人工种植和野生川贝母茎、叶中总碱的含量比较
依据优化后的总生物碱提取工艺条件,对人工种植和野生川贝母的茎、叶进行总生物碱的提取,测定其含量,其结果见图6。
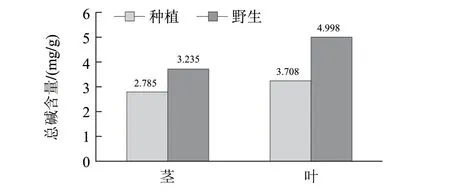
图 6 川贝母茎和叶中总碱含量结果Fig.6 Total alkaloid content of stems and leaves of wild and cultivated F. cirrhosa
3 结 论
综合单因素和响应面设计试验的结果,得出川贝母茎中总生物碱的最佳提取工艺为药材粉碎粒度60目、4倍体积氨水浸泡、氨水浸泡时间4h、混合溶剂氯仿-甲醇(1:1)、液料比31:1、提取时间6.5h、水浴温度74℃,此条件下,提取人工种植和野生川贝母茎、叶的总生物碱,得人工种植川贝母茎总生物碱含量为2.785mg/g,叶为3.708mg/g。野生茎总生物碱含量为3.235mg/g,叶为4.998mg/g。结果表明茎的总生物碱含量低于叶中的,同时人工种植的也低于野生的。
川贝母传统的用药部位是地下鳞茎,但川贝母茎、叶中含有较高的生物碱类成分,具体的成分还有待进一步的研究分析。本研究前期已经对地下鳞茎中总生物碱的最佳工艺进行了研究,表明地上部分总生物碱的含量高于地下部分,因此,川贝母的地上部分是否也可以作为食疗佳品使用,其功能特点值得进一步的研究。
[1] 谢志民, 王敏春, 吕润霞. 贝母类中药品种的本草考证[J]. 中药材, 2000, 23(7): 423-427.
[2] 阎博华, 丰芬, 邵明义, 等. 川贝母基源本草考证[J]. 中医研究, 2010, 23(3): 69-71.
[3] 罗运兴, 杨胜玉. 川贝母的临床应用概况[J]. 亚太传统医药, 2010, 6(4): 158-159.
[4] YEUM H S, EE Y C, KIM S H, et al. Fritillaria cirrhosa, Anemarrhena asphodeloides, Lee-Mo-Tang and cyclosporine a inhibit ovalbumin-induced eosinophil accumulation and Th2-mediated bronchial hyperresponsiveness in a murine model of asthma[J]. Basic Clin Pharmacol Toxicol, 2007, 100(3): 205-213.
[5] LI Huijun, JIANG Yan, LI Ping. Characterizing distribution of steroidal alkaloids in Fritillaria spp. and related compound formulas by lliquid chromatography-mass spectrometry combined with hierarchial cluster aanalysis[J]. J Chromatogr A, 2009, 1216(11): 2142-2149.
[6] ZHOU Jianliang, XIN Guizhong, SHI Ziqi, et al. Characterization and identifi cation of steroidal alkaloids in Fritillaria species using liquid chromatography coupled with electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. J Chromatogr A, 2010, 1217(45): 7109-7122.
[7] LI S L, CHAN S W, LI P, et al. Pre-column derivatization and gas chromatographic determination of alkaloids in bulbs of Fritillaria[J]. J Chromatogr A, 1999, 859(2): 183-192.
[8] 余华, 姜艳, 李萍, 等. 中药川贝母定量分析方法研究[J]. 中国中药杂志, 2005, 30(8): 572-575.
[9] 高光伟, 张建业, 冯向东. HPLC-ELSD法测定复方川贝母片中贝母素甲的含量[J]. 中国药师, 2010, 13(6): 833-835.
[10] 蓝日盛, 辛宁, 樊泽华. 不同采收期及加工方法的川贝母有效成分含量测定[J]. 广西中医学院学报, 2000, 17(3): 93-94.
[11] 邝翠仪, 钟诗龙, 黎曙霞, 等. 3种不同加工川贝母有效成分的比较[J]. 中草药, 2000, 31(8): 590-591.
[12] 黎开强, 吴卫, 郑有良, 等. 不同光强对川贝母生长发育和总生物碱的影响[J]. 中草药, 2009, 40(9): 1475-1478.
[13] 吴启秀, 王曙, 严晓梁, 等. 栽培川贝母的地上部分与鳞茎中总生物碱的比较[J]. 华西药学杂志, 2008, 23(6): 712-713.
[14] 王成恩, 黄章俊. 基于高斯函数和信赖域更新策略的Kriging响应面法[J]. 计算机集成制造系统, 2011, 17(4): 740-746.
