脐橙腐烂过程中挥发性有机硫(VOSCs)的质量浓度和组成变化特征分析
2013-08-07王新明
吴 婷,王新明*
(1.中国科学院广州地球化学研究所 有机地球化学国家重点实验室,广东 广州 510640;2.安徽师范大学环境科学与工程学院,安徽 芜湖 241003)
脐橙因其果色鲜艳、营养丰富和芳香宜人而成为了最受欢迎的水果之一,同时因其含糖量和含水率高在加工和储运过程中容易腐烂产生酸腐的气味。这种刺激性气味主要由于脐橙腐烂过程中产生了大量的碳氢化物、含氧化合物、含硫化合物等挥发性有机物[1]。其中,挥发性有机硫(VOSCs)具有极低的嗅阈值[2],虽然在质量浓度低时对水果的特有的香味具有重要贡献,但是当其质量浓度升高到一定程度就会形成令人不愉快的刺激性气味,从而导致水果变味变质[1,3]。
由于脐橙中VOSCs的质量浓度非常低,一般仪器达不到其检测限,因此经常没法检测到或被忽略[4-5]。目前只有国外有少量文献报道了新鲜橙汁和加工橙汁中VOSCs成分。例如,早期研究在橙汁的顶空气体中检测到痕量的硫化氢、甲硫醇、二甲基硫醚、二甲基三硫醚、羰基硫和二氧化硫[6-9]。近年研究在新鲜橙汁[10]和加工橙汁[11]中检测到了3-甲硫基丙醛、2-甲基-3-呋喃硫醇和1-对孟烯-8-硫醇3种香味活性VOSCs。此外,Perez-Cacho等[12]在由浓缩橙汁兑制的罐头中检测到了甲硫醇、二甲基硫醚、3-巯基-2-丁酮、2-甲基-3-呋喃硫醇、3-甲硫基丙醛、4-巯基-4-甲基-2-戊酮、二甲基三硫醚和1-对孟烯-8-硫醇8种异味VOSCs。但是,有关脐橙及其他柑橘类水果腐烂过程中VOSCs的变化规律目前尚未见文献报道。国内虽然有一些关于橙汁挥发性成分的报道[13-15],但是均未检测出VOSCs。本研究选取脐橙为研究对象进行模拟腐烂实验,定期采集脐橙腐烂过程中释放出来的气体,采用预浓缩系统(preconcentration)富集、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)分析气体中VOSCs的化学成分、质量浓度和组成特征。
1 材料与方法
1.1 材料与试剂
纽荷尔脐橙,采自江西赣南果园,封装于保鲜袋后冷藏运回实验室。为了加速脐橙腐烂,用干净的不锈钢刀把橙子切成宽约0.5cm长约1cm的小块。取部分脐橙小块置于烘箱中,60℃烘干,测其干质量。二甲基硫醚(DMS)、二硫化碳(CS2)和二甲基二硫醚(DMDS)标样(均为分析纯) 美国Sigma-Aldrich公司。
1.2 仪器与设备
Entech Model 7100预浓缩仪 美国Entech公司;GC6890-MS5973N型气相色谱-质谱联用仪(GC-MS) 美国Agilent公司;2L Tedlar气体采样袋 美国SKC公司。
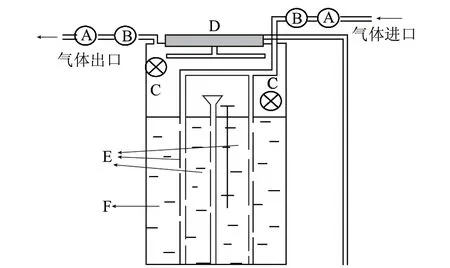
图 1 脐橙腐烂培养箱示意图 Fig.1 Schematic diagram of the lab-scale incubator used to simulate natural decay of navel oranges
模拟腐烂实验装置,自制,详见图1。此装置是圆柱形的玻璃容器,总体积约为11L(直径20cm,高35cm)。每套装置设有进气系统和出气系统,用于样品采集时供气和采气;装置内安装有两个小风扇,用于充分混匀箱内气体。装置所有的内表面都用特氟龙薄膜贴上,所有连接管均为特氟龙管,以免内表面吸附和污染,影响实验结果。
1.3 方法
1.3.1 样品制备与采集
取2kg新鲜脐橙小块置于模拟腐烂实验装置中,在(25±0.5)℃的室温下进行腐烂实验,设3个平行样。实验开始后,装置盖子敞开,让脐橙暴露在空气里自然腐烂,分别在第0、2、4、6、8、10、12、16、20、25、30天采集气体分析。采样时,先把盖子盖好密封,再往装置中以0.5L/min的流速通入润湿后的去除了VOSCs的干空气2h,以保证装置原有的空气全部被替换,然后用Tedlar气体采样袋于气体出口采集气体2L,用于分析。
1.3.2 预浓缩系统条件
第一级冷阱捕集温度-160℃,解析温度10℃,解析之后冷阱烘烤温度150℃,烘烤时间为5min,氦气流速10mL/min;第二级冷阱捕集温度为-40℃,解析温度180℃,解析之后冷阱烘烤温度190℃;第三级冷阱富集温度为-150℃,解析温度180℃,样品注入色谱柱时间为2min。
1.3.3 GC-MS分析条件
GC条件:HP-1毛细管柱(60m×0.32mm,1μm);升温程序:起始温度-50℃,保留2min,5℃/min升温至100℃,随后10℃/min升温至250℃,保留10min;载气高纯氦(99.999%),流速1.2mL/min。
MS条件:离子源温度250℃;电离方式为电子电离(electron ionization,EI);电离能70eV;电子倍增管电压1800V;采用全扫模式(Scan)检测,扫描质量数范围为29~350u。
化合物的定性和定量分析:根据样品与标样的色谱保留时间和质谱图进行定性,采用外标法建立标准曲线根据色谱峰面积进行定量。所有标样先用高纯N2稀释获得质量浓度约为1000ng/L初始混合标样,再采用动态稀释法利用高纯N2逐级稀释初始混合标样得到质量浓度分别为0(高纯N2)、20、100、500、1000ng/L系列混合标样,然后进行仪器分析。DMS、CS2和DMDS这3种VOSCs在0~1000ng/L质量浓度范围内线性良好(R>0.99);当进样量为250mL时,3种VOSCs的方法检测限分别为65、48、80ng/m3;连续检测质量浓度为20ng/L的3种VOSCs标样10次,3种VOSCs的相对标准偏差(RSDs)分别为3%、5%和2%;样品加标量为20ng/L时,3种VOSCs的加标回收率分别为95%、108%和102%。
2 结果与分析
2.1 新鲜脐橙VOSCs组成

图 2 新鲜橙子(A)与好氧腐烂16d后(B)橙子释放VOSCs的总离子流图Fig 2 Typical chromatograms of VOSCs from navel oranges stored for 0 and 16 days
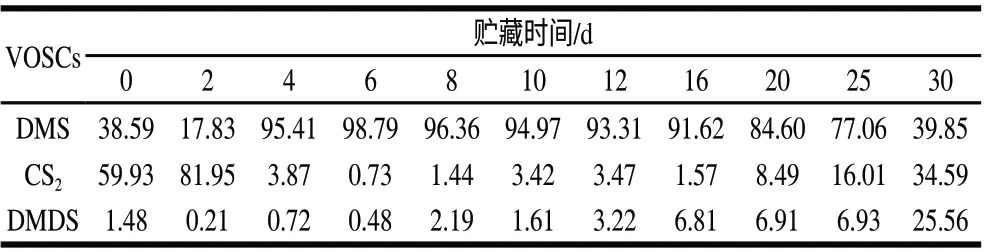
表 1 脐橙腐烂过程中VOSCs组成变化Table 1 Changes in VOSCs concentrations during storage of navel oranges%
由图2A和表1可知,新鲜脐橙释放出来的VOSCs鉴定出了3种,即DMS、CS2和DMDS。其中,CS2为最主要的VOSCs,其次为DMS,DMDS最低。结果表明,新鲜脐橙本身含有DMS、CS2和DMDS这3种VOSCs。这些化合物主要来源水果成熟过程中本身含硫蛋白质和氨基酸代谢的产物[3,16]。事实上,这些化合物在脐橙和其他橘类水果的新鲜果汁和加工果汁的顶空气体中经常被检测到,是脐橙等橘类水果的重要风味物质。例如,Shaw等[8]在新鲜马叙葡萄柚汁、加利福尼亚脐橙汁和巴伦西亚橘汁的顶空气体中均检测出了DMS,还检测到了羰基硫(COS)、甲硫醇(MeSH)、甲基乙基硫醚和乙硫醚。Shaw等[9]在新鲜哈姆林、凤梨橙、脐橙、巴伦西亚橘汁和坦坡橙的顶空气体中均检测出了DMS和DMDS,还检测到了MeSH。值得注意的是,虽然MeSH是橘类水果的重要风味物质,普遍存在各种橘类水果中[8-9],但本研究新鲜脐橙释放出来的VOSCs中并没有检测到。这有可能与橘类水果的种类和产地有关,还可能与MeSH本身的性质有关,在空气中MeSH很容易被氧化,转化生成DMDS[17]。
2.2 脐橙腐烂过程中VOSCs质量浓度变化

图 3 脐橙腐烂过程中VOSCs质量浓度随时间的变化Fig.3 Changes in the concentration of DMS, CS2, DMDS and total VOSCs during storage of navel oranges
由图3可知,脐橙腐烂过程中3种VOSCs质量浓度随时间变化趋势相似但又有区别。脐橙新鲜时(第0天),DMS、CS2和DMDS这3种VOSCs质量浓度都很低,分别为2.7、4.2ng/L和0.1ng/L;随后3种VOSCs质量浓度随腐烂时间不断增高,分别在第6、2、16天达到最大,最大质量浓度分别为199.6、49.4ng/L和9.6ng/L,分别为脐橙腐烂前质量浓度的74.0倍、11.9倍和92.4倍;然后DMS和DMDS质量浓度随腐烂时间逐渐降至非常低且于第25天后趋于稳定,CS2质量浓度随腐烂时间迅速降至非常低且于第4天后趋于稳定。对于TVOSCs,其质量浓度在脐橙腐烂前也很低为7.0ng/L,然后随腐烂时间不断增高在第6天达到最大质量浓度202.0ng/L,为腐烂前的28.9倍。结果表明,脐橙腐烂前期产生大量的DMS、CS2和DMDS。这期间VOSCs可能主要来源于微生物降解脐橙底物产生的二次产物。据文献[18]报道,食品发酵过程中含硫氨基酸和蛋白质在微生物作用下可降解生成DMS、CS2和DMDS等VOSCs。许多微生物,如芽孢杆菌和假单胞菌都参与食品的发酵腐烂过程并产生VOSCs[19-20]。事实上,DMS可作为食品微生物腐败的诊断标志[21]。事实上,在橙汁罐头[12]和其他一些发酵食品[22-23]中检测到较高质量浓度的这些VOSCs。
2.3 脐橙腐烂过程中VOSCs组成变化
由表1可知,脐橙新鲜时(第0天),CS2占TVOSCs的比例最大(59.93%),其次是DMS(38.59%),DMDS最小(1.48%)。脐橙腐烂过程中,DMS的比例在前2d迅速下降,然后随腐烂时间快速升高在第6天达到最大值(98.79%),第6天后到实验结束都是随时间逐渐降低;CS2的比例在前2d快速升高达到最大值(81.95%),然后随时间急剧降低在第6天达到最小值(0.73%),从第6天到实验结束都是随时间逐渐升高;DMDS在前2d降低至最小值(0.21%),然后随时间逐渐升高在第30天达到最大值(25.56%)。值得注意的是,脐橙腐烂前2d CS2占TVOSCs的比例最大,脐橙腐烂第2天后DMS占TVOSCs的比例最大,而DMDS在整个腐烂实验过程中所占比例最小。结果表明,脐橙腐烂过程中3种VOSCs的比例变化明显,特别是腐烂2d后DMS的比例急剧升高而CS2的比例急剧降低。同样,Shaw等[9]研究发现橙汁、柚汁和橘汁在密封罐中贮存1h,DMS的比例随贮存时间快速升高。由于脐橙特殊水果香味是由挥发性有机硫、挥发性含氧化合物、萜烯化合物等按一定比例混合的结果[1],脐橙腐烂过程中3种VOSCs比例的改变可使脐橙失去其本来的芳香味从而导致变味变质。
3 结 论
本研究在实验室模拟脐橙的腐烂过程,采用预浓缩系统与GC-MS技术检测到脐橙腐烂过程中共释放出3种VOSCs,即DMS、CS2和DMDS。脐橙腐烂过程中释放出来的TVOSCs和3种VOSCs质量浓度随时间不断增高达到最大,然后随时间降至非常低且趋于稳定。TVOSCs和DMS质量浓度均在脐橙腐烂的第6天达到最大,分别是新鲜脐橙的28.9倍和74.0倍。新鲜脐橙VOSCs以CS2为主,腐烂过程中以DMS为主。脐橙腐烂过程中3种VOSCs的比例变化明显,前2d以CS2为主,CS2比例迅速升高;2d后以DMS为主,DMS比例迅速升高。由于脐橙经常被切开后没立即吃完放置在空气中以及大部分脐橙被切开用于榨取果汁,因此本研究脐橙切开后暴露在空气中腐烂释放VOSCs特别是DMS和CS2的质量浓度和组成的变化可示踪脐橙自然腐烂。研究结果可为脐橙品质的鉴定提供基础数据,有助于脐橙的生产加工业提供科学依据。脐橙腐烂过程中VOSCs质量浓度和组成与脐橙品质参数同步测定有利于更深入了解VOSCs与脐橙腐烂的关系,需进一步研究。
[1] PEREZ-CACHO P R, ROUSEFF R. Processing and storage effects on orange juice aroma: a review[J]. Journal of Agricultural & Food Chemistry, 2008, 56(21): 9785-9796.
[2] DEVOS M, PATTE F, ROUAULT J, et al. Standardized Human olfactory thresholds[M]. New York: Oxford University Press, 1990.
[3] MUSSINAN C J, KEELAN M E. Sulfur compounds in foods[M]. Washington: American Chemical Society, 1994: 1-6.
[4] BLANK I. Sensory relevance of volatile organic sulfur compounds in food[M]. Washington: American Chemical Society, 2002: 25-53.
[5] ROUSEFF R L. Analytical methods to determine volatile sulfur compounds in foods and beverages[M]. Washington: American Chemical Society, 2002: 10-32.
[6] KIRCHNER J G, MILLER J M. Canning and storage effects: volatile water-soluble and oil constituents of valencia orange juice[J]. Journal of Agricultural & Food Chemistry, 1957, 5(4): 283-291.
[7] KIRCHNER J G, RICE R G, MILLER J M, et al. The presence of hydrogen sulfide in citrus juices[J]. Archives of Biochemistry, 1950, 25(1): 231-232.
[8] SHAW P E, AMMONS J M, BRAMAN R S. Volatile sulfur compounds in fresh orange and grapefruit juices: identification, quantitation, and possible importance to juice flavor[J]. Journal of Agricultural & Food Chemistry, 1980, 28(4): 778-781.
[9] SHAW P E, WILSON C W. Volatile sulfides in headspace gases of fresh and processed citrus juices[J]. Journal of Agricultural & Food Chemistry, 1982, 30(4): 685-688.
[10] BUETTNER A, SCHIEBERLE P. Evaluation of aroma differences between hand-squeezed juices from valencia late and navel oranges by quantitation of key odorants and flavor reconstitution experiments[J]. Journal of Agricultural & Food Chemistry, 2001, 49(5): 2387-2394.
[11] BEZMAN Y, ROUSEFF R, NAIM M. 2-Methyl-3-furanthiol and methional are possible off-flavors in stored orange juice: Aromasimilarity, NIF/SNIF GC-O, and GC analyses[J]. Journal of Agricultural & Food Chemistry, 2001, 49(11): 5425-5432.
[12] PEREZ-CACHO P R, MAHATTANATAWEE K, SMOOT J M, et al. Identification of sulfur volatiles in canned orange juices lacking orange flavor[J]. Journal of Agricultural & Food Chemistry, 2007, 55(14): 5761-5767.
[13] 牛丽影, 吴继红, 胡小松, 等. 橙汁中挥发性风味成分分析的研究进展[J]. 饮料工业, 2006, 9(9): 8-11.
[14] 牛丽影, 吴继红, 廖小军, 等. 不同类型橙汁挥发性风味成分的测定与比较[J]. 中国食品学报, 2008, 8(1): 119-124.
[15] 朱群英, 张国文, 江勇, 等. SPME-GC/MS法分析南丰蜜桔中的挥发性成分[J]. 南昌大学学报: 理科版, 2010, 34(4):361-368.
[16] MOTTRAM D S, NOBREGA, I C C. Formation of sulfur aroma compounds in reaction mixtures containing cysteine and three different forms of ribose[J]. Journal of Agricultural & Food Chemistry, 2002, 50(14): 4080-4086.
[17] WILBER C, MURRAY C. Odor source evaluation[J]. Biocycle, 1990, 31(3): 68-72.
[18] LANDAUD S, HELINCK S, BONNARME P. Formation of volatile sulfur compounds and metabolism of methionine and other sulfur compounds in fermented food[J]. Applied Microbiology and Biotechnology, 2008, 77(6): 1191-1205.
[19] KADOTA J, ISHIDA Y. Production of volatile sulfur compounds by microorganisms[J]. Annual Review of Microbiology, 1972, 26: 127-143.
[20] SREEKUMAR R, AL-ATTABI Z, DEETH H C, et al. Volatile sulfur compounds produced by probiotic bacteria in the presence of cysteine or methionine[J]. Letters in Applied Microbiology, 2009, 48(6): 777-782.
[21] MAYR D, MARGESIN R, KLINGSBICHEL E, et al. Rapid detection of meat spoilage by measuring volatile organic compounds by using proton transfer reaction mass spectrometry[J]. Applied and Environmental Microbiology, 2003, 69(8): 4697-4705.
[22] FEDRIZZI B, MAGNO F, FINATO F, et al. Variation of some fermentative sulfur compounds in Italian “Millesimè” classic sparkling wines during aging and storage on lees[J]. Journal of Agricultural & Food Chemistry, 2010, 58(17): 9716-9722.
[23] MESTRES M, BUSTO O, GUASCH J. Analysis of organic sulfur compounds in wine aroma[J]. Journal of Chromatography A, 2000, 881(1/2): 569-581.
