利用Caco-2细胞模型评价乳源ACE抑制肽小肠吸收机制的研究进展
2013-08-07郭宇星潘道东
祝 倩,郭宇星,*,潘道东,2
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.宁波大学海洋学院,浙江 宁波 315211)
近年来,随着人们生活水平的提高,高血压的发病率呈上升趋势,全世界大约20%的人受此威胁。高血压会引起患者心、脑、肾等器官损坏,并会引起糖脂代谢紊乱和糖尿病,严重时则会危及生命,因此,抗高血压药物的研究引起国内外学者越来越多的重视[1]。
目前,治疗高血压的降压药物有多种,如利尿降压剂、中枢神经和交感神经抑制剂、肾上腺素能受体组滞剂、酶抑制剂、钙离子拮抗剂和血管扩张剂。血管紧张素转化酶(angiotensin-Ⅰ converting enzyme,ACE,EC3.4.15.1)抑制剂大多是化学合成的,如卡托普利(Captopril)、依那普利(Enalapril)、赖诺普利(Listinopril)等药物。这类药物作用时间短,停药后血压易反弹,而且人工合成药物吸收排泄速度快,会引起咳嗽、味觉丧失、肾脏损伤及血管神经性水肿等副作用[1]。如何通过非药物疗法达到治病、防病的目的,已为越来越多的人所接受。乳源血管紧张素转化酶(ACE)抑制肽是从乳蛋白水解物或发酵乳制品中提取的ACE抑制肽类物质,作为天然的ACE抑制肽,无副作用,如果长期食用的话,可以起到缓解、防止高血压的作用,当前讲究药食同源,其越来越受到人们的广泛关注。但是ACE抑制肽进入肠道后,由于肠道黏膜的低通透性、消化道酶系的降解作用等原因在一定程度上阻碍了肽的吸收[2],造成了肽的生物利用度低下,所以研究ACE抑制肽在小肠中的吸收机制非常必要。
Caco-2细胞来源于人类结、直肠癌细胞,此细胞生物膜因在结构和生物学性质上与人小肠吸收细胞相似而广泛用于肠道药物、肽类等营养物质的吸收机制研究。本文概述乳源ACE抑制肽的研究进展,综述利用Caco-2细胞模型研究乳源ACE抑制肽在小肠中的转运机制的概况,旨在为肽类的营养吸收研究提供一定的参考。
1 ACE抑制肽研究进展及活性评价方法
1.1 ACE抑制肽研究进展
血管紧张素转化酶Ⅰ是一种羧二肽酶,普遍存在于哺乳动物组织中。它能使血管紧张素Ⅰ转变为有血管收缩调节活性的血管紧张素Ⅱ;同时,它还能使缓激肽失去活性,转变为没有活性的缓释肽,从而使血管平滑肌收缩,使得血压升高。ACE抑制肽是经过蛋白质分解酶的作用产生的一类具有能抑制ACE活性的多肽物质,它通过抑制ACE的活性而起到降低血压的作用[3]。
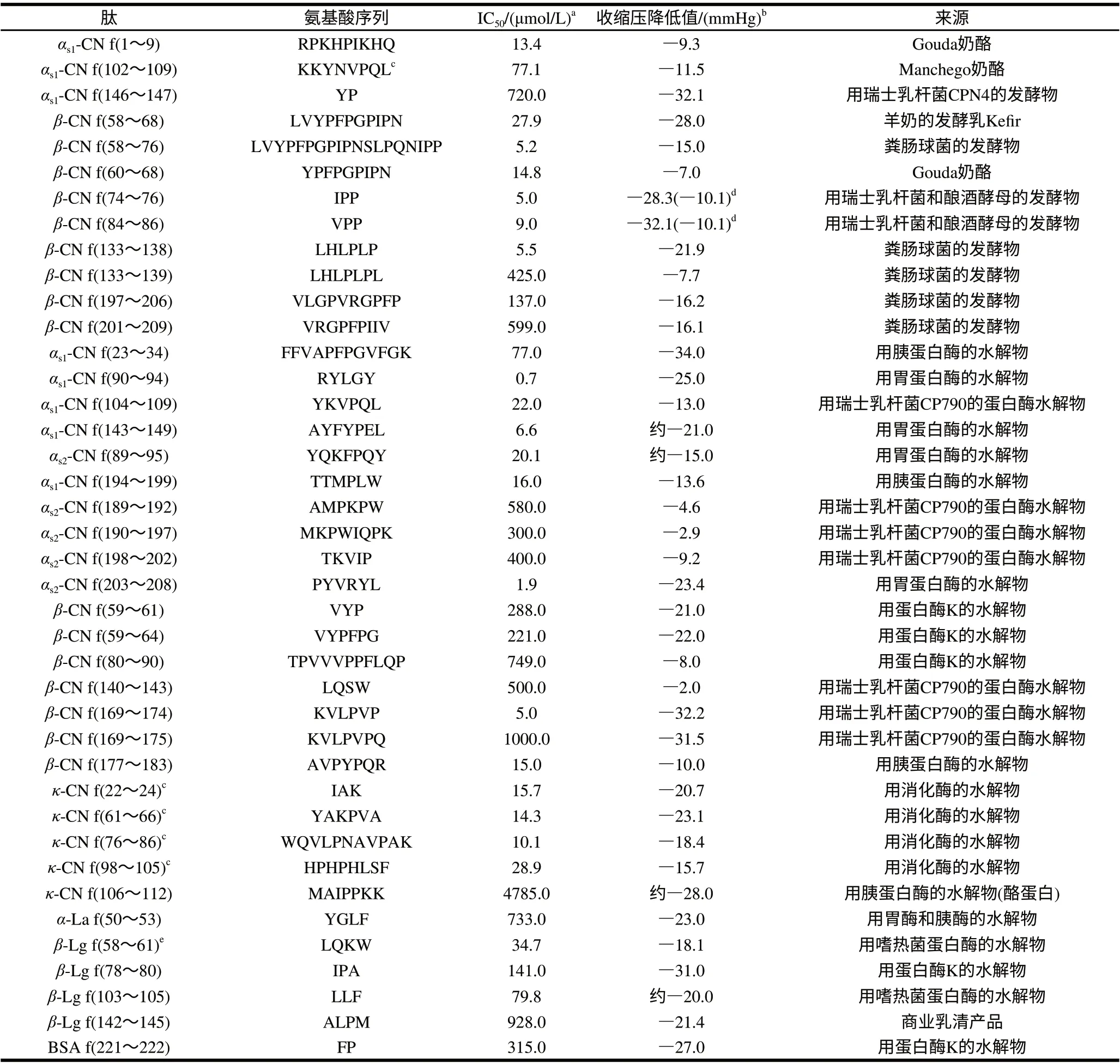
表1 酪蛋白多肽和乳清蛋白多肽的ACE抑制活性及其抗高血压活性Table 1 ACE-inhibitory and antihypertensive activity of peptides derived from caseins and whey proteins
Ferreira[4]于1965年首次在南美茅头蝮蛇(Bothrops jararaca)毒液中发现了ACE抑制肽之后,多种ACE抑制肽应运而生。Oshima等[5]最早报道了由食品蛋白质得到的ACE抑制肽,通过对明胶进行酶解获得了活性较强的ACE抑制肽。近年来,人们发现了乳源ACE抑制肽,表1是已报导的乳源ACE抑制肽[6]。如Nakamura[7]、Yamamoto[8-9]等从发酵乳中提取出2种活性短肽——VPP和IPP,并证明其在体外的ACE抑制活性和降低自发性高血压大鼠血压的能力。Lapointe等[10]从β-乳球蛋白酶解物中分离到β-Lg(142~148),其氨基酸序列是Ala-Leu-Pro-Met-His-Ile-Arg。Maruyama等[11]从牛乳酪蛋白的胰蛋白酶水解物中分离出一种能抑制ACE活性的12肽。这些乳源ACE抑制肽对一些血压正常的动物或人没有降压作用,具有安全性高、无毒副作用的特点[12]。
1.2 评价ACE抑制肽活性的方法
目前评价ACE抑制肽的方法主要为体内法(动物实验)和体外法。体内法是以原发性高血压大鼠为实验对象,通过口服或静脉注射不同剂量的ACE抑制剂,测定动脉收缩压的大小,并与对照组进行比较。体外法主要采用两种方法:一是可见光光度法,即将ACE作用的底物由带有蓝色的FAPGG代替含有马尿酸的三肽,根据ACE作用后光吸收减弱的原理,通过减弱的程度来评价ACE抑制肽活性;二是色谱法,通过检测产物中的马尿酸含量来确定其是否具有ACE抑制活性[13]。
但严格来说,ACE抑制肽并不完全等同于降压肽。降压肽指的是经过体内或临床实验证明确实具有降血压功能的肽段,而ACE抑制肽则是指体外检测具有抑制ACE活性的小肽,并不能完全保证其在动物体内能发挥降压作用。实际上,有些肽的体外ACE抑制活性与体内降压效果不一致,可能会出现体外检测抑制活性低的肽却在体内显示出强抗高血压作用,这些肽可能是被体内消化酶水解后生成了强活性的肽而发挥了降血压的作用[14]。如Miguel等[15]发现多肽经胃蛋白酶、胰酶或者小肠刷状缘膜肽酶水解后ACE抑制活性下降,但仍然有抗高血压活性。然而,还有些肽在体外检测中有较高的ACE抑制活性,但体内检测却没有抗高血压活性,如Anusha等[16]发现太平洋鳕鱼鱼蛋白水解物经过胃肠道消化后的ACE抑制活性没有改变,利用Caco-2细胞作为小肠吸收模型进行鱼蛋白水解物的小肠吸收实验,发现鱼蛋白水解物在经过Caco-2细胞后没有任何的ACE抑制活性,推测这种现象的原因可能是ACE抑制肽没有被肠道吸收;ACE抑制肽被小肠刷状缘膜上的肽酶水解后活性完全丧失。因此,研究ACE抑制肽由小肠上皮细胞转运至血液的机制很有必要。
2 利用Caco-2细胞模型研究乳源ACE抑制肽小肠吸收机制的进展
2.1 Caco-2细胞模型
Caco-2细胞系来源于人类结、直肠癌细胞,在普通的培养条件下就可以在有孔的多聚碳酸酯膜上自发的分化为肠上皮细胞单层,因此可以模拟体内小肠上皮细胞层[17]。Caco-2细胞接种到碳酸聚酯多孔膜等基质上,在适当的培养条件下自发形成有极性的具微绒毛以及紧密连接等类似于小肠上皮细胞分化特征的单细胞层。因此,此细胞可以用来模拟小肠上皮细胞,广泛用于营养物质及药物吸收过程中物理和生化屏障的研究。Per等[18]报道了利用Caco-2细胞模型预测不同药物的跨肠上皮细胞膜的转运途径,并得出结论,Caco-2细胞模型可用于鉴定药物吸收状况。Kim等[19]通过对比Caco-2细胞体外细胞培养模型和小鼠原位灌注回肠模型研究了肽的吸收特性,观察到Caco-2细胞体外细胞培养模型和小鼠原位灌注模型的实验结果有很好的相关性,表明Caco-2细胞模型是研究多肽跨小肠细胞膜转运很好的实验系统。
2.2 乳源ACE抑制肽小肠吸收机制的研究进展
2.2.1 利用Caco-2细胞模型研究乳源ACE抑制肽小肠摄入机制
2.2.1.1 营养物质经小肠转运途径的类型
小肠是机体内吸收物质的主要部位,物质主要在小肠绒毛上的吸收细胞上进行。小肠单层柱状上皮细胞面向黏膜侧的膜为顶侧膜,也称为刷状缘膜,面向血液侧的膜为侧底膜,也称基底膜。肽转运系统位于小肠上皮细胞的刷状缘膜,上皮细胞之间通过紧密连接、间隙连接以及桥粒等方式相互连接。营养物质口服后可通过以下途径从肠腔进入血液循环:1)通过细胞之间连接的转运;2)被动的穿越细胞胞质的转运;3)主动的载体介导的转运及药物外流;4)胞饮路径,如图1[20]所示。
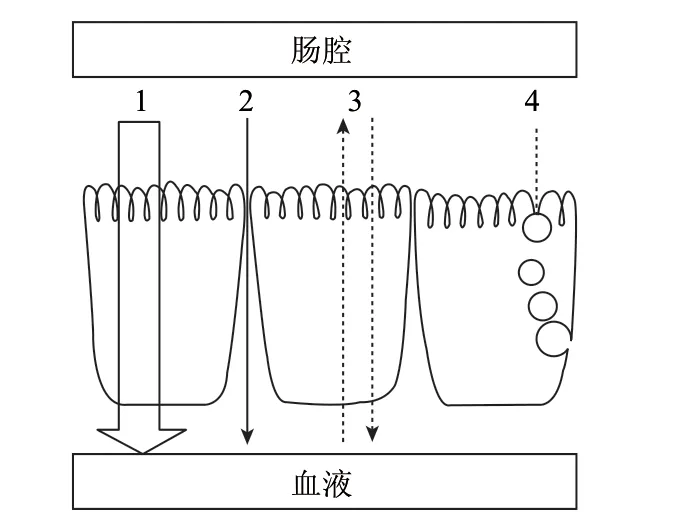
图 1 小肠上皮细胞转运途径示意图[20]Fig.1 Schematic diagram of transportation in intestinal epithelial cells[20]
不同营养物质进入小肠有不同途径,主要和营养物质的类型、结构、亲水性等有关,利用Caco-2细胞模型可以研究不同营养物质的摄入途径。如Caco-2细胞模型可用于载体介导主动转运的研究,Caco-2细胞有3种主动转运载体包括二肽载体、P-糖蛋白和寡肽载体。这些载体主要转运营养物质(氨基酸、葡萄糖、胆酸等)及与营养物质结构类似的化合物。但对于脂溶性较好的营养物质,油水分布系数大,易分布于上皮细胞脂质膜,有报道[21]是通过被动转运的。
2.2.1.2 乳源ACE抑制肽小肠转运机制
乳源ACE抑制肽经人体口服摄入后,必须要克服一系列障碍,以活性形式由小肠上皮细胞转运至血液,进入人体体液循环,才能达到降低血压的功效。目前,对于乳源ACE抑制肽在小肠中的转运方式已有一些报道,已发现的乳源ACE抑制肽的转运途径有3种,即主动转运、细胞旁路途径转运及胞饮作用转运,多肽转运途径与多肽链长度有密切的关系。
有报道[22]认为,二肽和三肽主要是通过人和哺乳动物小肠上皮细胞刷状缘膜的寡肽转运蛋白PepT1由主动转运而吸收的。PepT1的成功克隆,揭示了哺乳动物的肠腔内存在二肽和三肽的特殊转运系统,这种转运系统可以介导二肽和三肽的吸收。然而,VPP是发现最早的乳源ACE抑制肽,Satake等[23]利用Caco-2细胞模型研究了其转运过程,发现VPP虽然是三肽,但并不是通过刷状缘膜的二肽和三肽转运载体PepT1转运至细胞中,而是通过细胞旁路途径转运的。因为肽转运载体竞争性抑制剂Gly-Pro、奥代美宁A(Arphamenine A)和细胞内吞抑制剂氧化苯胂对VPP的转运没有显著的抑制作用,所以胞旁转运是VPP转运的主要机制。Tamura等[24]发现Val-Val-Val跨上皮的转运途径是通过旁路途径的被动扩散。
对于大于三肽的寡肽,刘冬等[25]研究了降血压肽Val-Leu-Pro-Val-Pro(VLPVP)在Caco-2细胞模型中的吸收机制,确定VLPVP主要是通过细胞旁路转运穿过小肠上皮细胞的。Pappenheimer等[26]已经证明八肽很可能是通过旁路转运吸收通过肠道上皮细胞。Adson等[27]得出结论,D-Phe-Gly主要是通过旁路转运的。另外,疏水九肽的跨上皮转运可能包括胞吞转运作用,四肽的主要转运途径应该是旁路途径[28]。Quirós等[29]报导了来源于β-酪蛋白的ACE抑制肽LHLPLP的小肠转运机制,LHLPLP在胞质中被肽酶降解成HLPLP,再通过旁路途径转运出细胞。Cakir-Kiefer等[30]对五肽HLPLP的跨膜实验表明,旁路被动扩散可能是其跨Caco-2细胞单层转运的主要机制,同时还指出αs1-酪蛋白(αs1-CN 91~97)的小肠转运途径也可能是旁路扩散。β-酪蛋白(β-CN (193~209)),是一个有17个氨基酸残基组成的疏水性、免疫调节活性长肽,Regazzo等[31]使用选择性抑制剂来评估β-CN (193~209)转运途径,发现其是通过胞饮作用转运的,但也不能排除通过紧密连接的旁路转运。
从以上研究可发现,大多数多肽在小肠中转运是通过旁路转运的被动扩散,被动扩散能否顺利进行还与多肽所带电荷、氢键键能、疏水性有关。Pauletti等[32]研究了肽的大小和带电特性对跨Caco-2细胞膜旁路转运时被动扩散的影响,发现肽带正电荷会增强旁路跨膜的渗透性,但随着肽链长度增加,净电荷的影响就会减少。Robert等[33]发现肽被动吸收的一个重要的障碍是要打破水和肽之间的氢键,来溶解肽使之进入细胞膜。Chua等[34]观察3种血管紧张素肽des-Asp-angiotensinⅠ(DAAⅠ)、Angiotensins Ⅲ和Angiotensins Ⅳ跨Caco-2细胞膜的特性,建立了结构和转运的相关性,得出DAAⅠ是通过被动扩散转运的,而Angiotensins Ⅲ、Ⅳ是通过一种需能的、主动载体介质转运,在这3种肽中,DAAⅠ是最疏水的,有最高的氢键键能。
2.2.2 利用Caco-2细胞模型研究乳源ACE抑制肽在小肠细胞中的滞留代谢
Caco-2细胞具有与小肠上皮细胞相同的细胞极性和紧密连接,存在于小肠细胞刷状缘的酶,如氨肽酶、碱性磷酸酶、蔗糖酶及γ-谷氨酰转肽酶也同样存在于Caco-2细胞中[35]。由于其含有各种代谢酶,因此更接近肽在人体内吸收的实际环境,可用于肽在细胞中的滞留代谢研究。
乳源ACE抑制肽如果要以完整形式由小肠上皮细胞转运至血液中,还必须抵御小肠肠道刷状缘膜上的肽酶和胞质肽酶的水解。目前研究发现,乳源ACE抑制肽能否被肽酶水解,与其肽链长度和氨基酸组成有关。经报道[36],刷状缘膜上的肽酶能够将寡肽水解成氨基酸、二肽或三肽。对于四肽或以上的肽在刷状缘膜超过90%被水解,三肽10%~60%,而二肽是10%。如Quirós等[29]报导了来源于β-酪蛋白的ACE抑制肽LHLPLP的小肠转运机制,LHLPLP在胞质中被肽酶降解成HLPLP。但 Vermeirssen等[37]通过Caco-2细胞研究Ala-Leu-Pro-Met-His-Ile-Arg转运机制,是在投药后10min内发生吸收的,这个七肽是完整转运的。β-酪蛋白(β-CN (193~209))是一个有17个氨基酸残基组成的长肽,Regazzo等[31]研究发现β-CN(193~209)能抵制小肠刷状缘膜肽酶的作用。据此推测,肽酶特异性水解不仅与肽链长度有关,与多肽的氨基酸组成也有一定关系,Satake等[23]报导X-Pro-Pro、X-Lys-Pro和X-Lys-Trp结构的多肽可以抵御肠道内肽酶的水解。Quirós等[38]发现LHLPLP和LVYPFPGPIPNSLPQNIPP同时具有体外ACE抑制活性和体内的抗血压能力。研究发现N末端倒数第2位为亮氨酸时可提高ACE抑制活性,C末端位置为精氨酸时可同时提高ACE抑制肽活性和体内抗血压能力。Zhu Xiaolin等[39]研究了Ala-Phe、Phe-Ile和Ile-Phe转运后的ACE抑制活性,发现Ala-Phe和Ile-Phe吸收后仍具有ACE抑制活性,但是Phe-Ile吸收后没有ACE抑制活性,Ile-Phe和其他二肽相比,穿透小肠膜能力最强。
2.2.3 利用Caco-2细胞模型研究乳源ACE抑制肽的外排机制
以往研究肽的小肠吸收主要考虑从肠腔一侧(AP侧) 摄入。实际上,肽从肠道到达血液,包括AP侧摄入和肠壁一侧(BL侧)外排两个过程。Caco-2细胞模型也可用于肽外排机制的研究,P-糖蛋白(P-GP)和多药耐药蛋白(MRP)是Caco-2细胞中2种主要的转运蛋白。两者均为能量依赖性膜蛋白,发挥外排泵作用,可将胞内化合物逆浓度梯度运至胞外,这与体内小肠上皮的外排系统一致。这些外排系统是造成低生物利用度的原因之一[40]。郑慧娜等[41]采用Caco-2单层细胞模型体外模拟马氏珠母贝高F值寡肽(PHFP)小肠吸收,得出PHFP溶液在Caco-2细胞中的转运存在外排泵的作用。刘冬等[25]研究了降血压肽Val-Leu-Pro-Val-Pro(VLPVP)的外排机制,通过加入P-GP、MRP抑制剂,观察VLPVP转运情况,说明VLPVP在吸收过程中的外排主要是MRP介导的。
3 结 语
Caco-2细胞模型是目前应用较广泛的体外吸收模型,Caco-2细胞模型的应用将人们对肽的吸收、生物转化和生物利用度等机制的认识提高到了细胞分子水平。用Caco-2细胞模型可以研究乳源ACE抑制肽在小肠中的摄入,细胞中滞留代谢及外排过程。通过利用Caco-2细胞模型研究乳源ACE抑制肽在小肠中的转运机制,可了解多肽结构(氨基酸组成、肽链长度、极性)与多肽生物利用度的关系,据此改善乳源ACE抑制肽口服后生物学效应低下的现象。
大多数乳源ACE抑制肽是亲水性的,跨小肠膜转运方式一般限制在旁路途径,被限制在这一途径的肽的生物利用度一般不高,增强多肽疏水性同时降低氢键键能的化学修饰是很有潜力的增加生物利用度的策略[42]。另外也可以对肽进行化学结构修饰,比如琥珀酰化、乙酰化、胍化可以提高其脂溶性[43],提高乳源ACE抑制肽的生物利用度。另外,还可以采用乳化、脂质体、微胶囊等技术用可生物降解的聚合体材料将肽包埋,在吸收目标区定点释放出肽,保护肽免遭肠道酶系的降解;使用蛋白酶抑制剂和吸收增强剂,增强肽在小肠黏膜的通透性,得以提高生物学效应[2]。因此,利用Caco-2细胞研究乳源ACE抑制肽在小肠中的转运机制(包括摄入与外排)和在人体小肠中的代谢稳定性有重大意义。
[1] 何海伦, 陈秀兰. 血管紧张素转化酶抑制肽的研究进展[J]. 中国生物工程杂志, 2004, 24(9): 7-11.
[2] 曹文红, 章超桦. 生物活性肽的吸收机制[J]. 药物生物技术, 2006, 13(5): 384-388.
[3] 郭慧青, 毛慧, 赵波, 等. 两种血管紧张素转化酶抑制肽作用于靶标的分子机理[J]. 食品科学, 2010, 31(23): 1-5.
[4] FERREIRA S H. A bradykinin-potentiating fact or (BPF) present in the venom of Bothrops jararaca[J]. Brit J Pharmacol, 1965, 24: 163-169.
[5] OSHIMA G, SHIMABUKURO H, NAGASAWA K. Peptide inhibitors of angiotensin-converting enzyme in digests of gelatin by bacterial collagenase[J]. Biochimicaet Biohysica Acta, 1979, 566: 128-137.
[6] BLANCA H L, MARÍA M C, ISIDRA R. Antihypertensive peptides: Production, bioavailability and incorporation into foods[J]. Advances in Colloid and Interface Science, 2011, 165: 23-35.
[7] NAKAMURA Y, YAMAMOTO N, SAKAI K, et al. Purifi cation and characterization of angiotensin-Ⅰconverting enzyme inhibitors from sour milk[J]. J Dairy Sci, 1995, 74(8): 777-783.
[8] YAMAMOTO N, TAKANO T. Antihypertensive peptides derived from milk proteins[J]. Molecular Nutrition and Food Research, 1999, 43(3): 159-164.
[9] YAMAMOTO N, AKINO A, TAKANO T. Purifi cation and specifi city of a cell-wall associated proteinase from Lactobacillus helveticus CP790[J]. Journal of Biochemistry, 1993, 114: 740-745.
[10] LAPOINTE J F, GAUTHIER S F, POULIOT Y, et al. Selective separation of cationic peptides from a tryptic hydrolysate of β-lactoglobulin by electrofiltration[DB/OL]. [2012-01-01]. www.interscience.wiley.com.
[11] MARUYAMA S, SUZUKI H. Apeptide inhibitor of angiotensinⅠconverting enzyme in the tryptic hydrolysate of casein[J]. Agric Biolchem, 1982, 46(5): 1393-1394.
[12] 季闽春, 王永铭, 陈斌艳. 血管紧张素转化酶抑制剂的皮肤不良反应[J]. 中国临床药理学杂志, 1996(2): 112-114.
[13] 许金光, 杨智超, 刘长江. 血管紧张素转化酶(ACE)抑制肽的研究进展[J]. 食品工业科技, 2011, 32(5): 425-427.
[14] 管骁, 彭剑秋, 金周筠, 等. 食源性血管紧张素转化酶抑制肽的研究[J]. 食品与发酵工业, 2011, 37(7): 135-141.
[15] MIGUEL M, ALEIXANDRE M S, RAMOS M, et al. Effect of simulated gastrointestinal digestion on the antihypertensive properties of ACE-inhibitory peptides derived from ovalbumin[J]. Agric Food Chem, 2006, 54: 726-731.
[16] ANUSHA G P. SAMARANAYAKA, KITTS D D, et al. Antioxidative and angiotensin-Ⅰ-converting enzyme inhibitory potential of a Pacifi c hake (Merluccius productus) fish protein hydrolysate subjected to simulated gastrointestinal digestion and Caco-2 cell permeation[J]. Agric Food Chem, 2010, 58: 1535-1542.
[17] SHAH P, JOGANI V, BAGCHI T, et al. Role of Caco-2 cell monolayers in prediction of intestinal drug absorption[J]. Biotechnol Prog, 2006, 22: 186-198.
[18] PER A, KATRIN P, KRISTINA L. Caco-2 monolayers in experimental and theoretical predictions of drug transport[J]. Advanced Drug Delivery Reviews, 1996, 22: 67.
[19] KIM D C, BURTON P S, BORCHARDT R T, et al. A correlation between the permeability characteristics of a series of peptides using an in vitro cell culture model(Caco-2) and those using an in situ perfused rat ileum model of the intestinal mucosa[J]. Pharmaceutical Research, 1993, 10(12): 1710-1714.
[20] ARTURSSON P, PALM K, LUTHMAN K. Caco-2 monolayers in experimental and theoretical predictions of drug transport[J] . Advanced Drug Delivery Reviews, 2001, 46(1/3): 27-43.
[21] 关溯, 综述, 陈孝. Caco-2细胞模型: 药物吸收研究的有效“工具”[J]. 中国药理学通报, 2004 , 20(6): 609-614.
[22] 孙勇兵, 孙进, 何仲贵. 小肠寡肽转运蛋白及其在提高药物口服吸收中的应用[J]. 中国新药与临床杂志, 2006, 25(10): 776-782.
[23] SATAKE M, ENJOH M, NAKAMURA Y, et al. Transepithelial transport of the bioactive tripeptide Val-Pro-Pro, in human intestinal Caco-2 cell monolayers[J]. Bioscience Biotechnology and Biochemistry, 2002, 66: 378-384.
[24] TAMURA K, LEE C P, SMITH P L, et al. Metabolism, uptake, and transepithelial transport of the stereoisomers of Val-Val-Val in the human intestinal cell line, Caco-2[J]. Pharmaceutical Research, 1996, 13(11): 1663-1667.
[25] 刘冬, 孙海燕, 雷林, 等. 降血压肽Val-Leu-Pro-Val-Pro在Caco-2细胞模型中的吸收机制[J]. 营养学报, 2008, 30(4): 354-362.
[26] PAPPENHEIMER J R, DAHL C E, KARNOVSKY M L, et al. Intestinal absorption and excretion of octapeptides composed of D-amino acids[J]. Proc Natl Acad Sci, 1994, 91: 1942-1945.
[27] ADSON A, RAUB T J, BURTON P S, et al. Quantitative approaches to delineate paracellular diffusion in cultured epithelial cell monolayers[J]. Pharm Sci, 1994, 83: 1529-1536.
[28] SHIMIZU M, TSUNOGAI M, ARAI S. Transepithelial transport of oligopeptides in the human intestinal Cell caco-2[J]. Peptides, 1997, 18: 681-687.
[29] QUIRÓS A, DÁVALOS A, LASUNCIÓN M A. et al. Bioavailability of the antihypertensive peptide LHLPLP: transepithelial flux of HLPLP[J]. International Dairy Journal, 2008, 18: 279-286.
[30] CAKIR-KIEFER C, MICLO L, BALANDRAS F, et al. Transport across Caco-2 cell monolayer and sensitivity to hydrolysis of two anxiolytic peptides from αs1-casein, α-casozepine, and αs1-casein-(f91~97): effect of bile salts[J]. Agric Food Chem, 2011, 59(22): 11956-11965.
[31] REGAZZO D, MOLLÉ D, GABAI G, et al. The (193~209) 17-residues peptide of bovine β-casein is transported through Caco-2 monolayer[J]. Molecular Nutrition & Food Research, 2010, 54(10): 1428-1435.
[32] PAULETTI G M, OKUMU F W. Effect of size and charge on the passive diffusion of peptide across Caco-2 cell monolayers via the paracellular pathway[J]. Pharmaceutical Research, 1997, 14(2): 164-168.
[33] ROBERT A, CONRADI, ALLEN R, et al. The influence of peptide structure on transport across Caco-2 cells[J]. Pharmaceutical Research , 1991, 18 (12): 1453-1460.
[34] CHUA H L, SEETHARAMA J, MENG-KWOON S, et al. Transport of angiotensin peptides across the Caco-2 monolayer[J]. Peptides, 2004, 25: 1327-1338.
[35] 廖晓慧, 孙海燕, 彭光华, 等. Caco-2细胞模型及其在食品营养物质吸收研究中的新进展[J]. 农产品加工: 学刊, 2007(2): 37-40.
[36] RIEKO A, YUKITAKA K, MOTOHIRO S, et al. Relationships between structure and high-throughput screening permeability of peptide derivatives and related compounds with artifi cial membranes: application to prediction of Caco-2 cell permeability[J]. Bioorganic & Medicinal Chemistry, 2004, 12: 257-264.
[37] VERMEIRSSEN V, DEPLANCKE B, TAPPENDEN K A, et al. Intestinal transport of the lactokinin Ala-Leu-Pro-Met-His-Ile-Arg through a Caco-2 BBE monolayer[J]. Journal of Peptide Science, 2002, 8(3): 95-100.
[38] QUIRÓS A, MARÍA C, RAMOS M, et al. Stability to gastrointestinal enzymes and structure-activity relationship of β-casein-peptides with antihypertensive properties[J]. Peptides, 2009, 30(10): 1848-1853.
[39] ZHU Xiaolin, KEISUKE W, SHIRAISHI K, et al. Identification of ACE-inhibitory peptides in salt-free soysauce that are transportable across Caco-2 cell monolayers[J]. Peptides, 2008, 29: 338-344.
[40] 卢智玲, 冯怡, 徐德生, 等. Caco-2细胞模型在中药口服吸收及机制研究中的应用[J]. 中草药, 2006, 37(4): 616-619.
[41] 郑慧娜, 章超桦, 吉宏武. 马氏珠母贝高F值寡肽在Caco-2细胞中吸收的初步研究[J]. 食品与生物技术学报, 2011, 30(4): 613-617.
[42] GIOVANNI M, PAULETT I, SANJEEV G, et al. Improvement of oral peptide bioavailability: peptidomimetics and prodrug strategies[J]. Advanced Drug Delivery Reviews, 1997, 27(2/3): 235-256.
[43] 杨超, 尹宗宁. 提高酶和多肽类药物口服吸收方法及机制的研究进展[J]. 中国新药杂志, 2006, 15(12): 945-948.
