血管紧张素转化酶2(ACE2)在糖尿病大鼠肾损伤中的作用及机制分析
2013-08-07王珊珊王艳霞张源淑
王珊珊,马 畅,张 伟,王艳霞,张源淑*
(南京农业大学 农业部动物生理生化重点开放实验室,江苏 南京 210095)
肾素-血管紧张素系统(rennin-angiotensin system,RAS)是心血管和肾脏功能调节的中心环节,通过其经典的血管紧张素转化酶(angiotensin converting enzyme Ⅰ,ACE)-血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)-血管紧张素Ⅱ受体1亚型(Ang Ⅱ type 1 receptor,AT1)通路在调节水盐代谢、维持血容量与血管张力以及调控心脏、肾脏功能等方面功效显著。2 0 0 0 年血管紧张素转化 酶2(angiotensin converting enzyme Ⅱ,ACE2)的发现[1],极大地丰富了经典RAS。ACE2与ACE是一对相互拮抗、生理功能相反的酶[2]。其主要生物学效应是水解Ang Ⅱ生成具有舒张血管、拮抗细胞增殖和抗炎症作用的血管紧张素1-7(angiotensin 1-7,Ang 1-7)[3]。现已证明RAS存在着两条在生理作用上相互拮抗的通路:一条为ACEAngⅡ-AT1通路,能引起血管收缩,血压升高;另一条为ACE2-Ang-(1-7)-Mas通路,通过抗衡前一条通路引起血管舒张血压下降等生理作用[4]。两条通路失衡将导致糖尿病、心功能紊乱、高血压等疾病的发生发展[5]。
近年研究发现除经典RAS(循环RAS)外,局部组织如肾脏、心脏、血管壁、脑等组织还具有独立的RAS,主要对局部组织的生长分化和病理生理进行调节[6]。肾脏中存在高水平的RAS中各种成分,如:肾素、Ang Ⅰ、Ang Ⅱ、ACE、ACE2等。肾脏局部RAS的过度激活是导致糖尿病、糖尿病肾病等多种肾脏疾病的主要原因[7]。
本实验室已有的研究提示ACE2在糖尿病肾脏损伤的发生发展过程中起着关键的作用并具有一定的抗损伤和保护肾脏的作用[8-9],但在糖尿病引起的肾损伤过程中ACE2是如何抗衡ACE水解产生Ang Ⅱ及Mas和AT1受体的表达水平的变化还有待研究。因此,本实验通过链脲佐菌素(streptozotocin,STZ)致大鼠不同程度肾损伤,拟通过观察ACE2、ACE和其相应下游受体mRNA表达的变化,并结合肾脏局部组织中其上游肾素活性和AngⅠ及下游AngⅡ含量变化,进一步探讨ACE2及其通路在肾损伤中的作用及其分子机制。
1 材料与方法
1.1 材料、试剂与仪器
PCR引物由上海英俊生物技术有限公司合成。
STZ 美国Sigma公司;TRNzol试剂盒 南京天为生物科技有限公司;M-MLV反转录酶、RNA抑制剂、随机引物 南京生兴生物技术有限公司;肾素、AngⅠ和AngⅡ放射免疫试剂盒(灵敏度:10pg/mL,精密度:批内变异系数:<10%,批间变异系数:<15%) 北京北方生物技术研究所。
PT1200CL手持式电动匀浆机 瑞士Polytron公司;GMBh8 CO.KG Miklro-22R高速低温离心机 德国Andreas Hettich公司;BS210S电子分析天平 北京赛多利斯天平有限公司;核酸浓度测量仪 德国Eppndorf 公司;Q5PCR仪 美国Bio-Rad公司;FMQ-9013C放射免疫γ计数器 上海原子核研究所日环仪器一厂。
1.2 实验动物
S D 雄性大鼠,体质量2 0 0 ~2 2 0 g(东南大学实验动物中心提供,实验动物使用许可证(号码:SYXK(苏)2001-0017)和实验动物生产许可证(号码:SCXK(苏)2001-0005)。实验鼠用颗粒饲料 江苏省协同医药生物工程有限公司。
1.3 方法
1.3.1 STZ致不同程度大鼠糖尿病肾损伤模型的建立
参照沈亚非等[10]的方法。健康成年SD大鼠40只,1周适应期后,随机取16只作为正常对照组,其余大鼠按60mg/kg(以体质量计)剂量一次性腹腔内注射STZ(0.1mmol/L,pH4.2柠檬酸缓冲液溶解,新鲜配制),正常对照组按0.1mL/kg(以体质量计)剂量腹腔注射柠檬酸缓冲液。分别于注射后24、72h后,剪尾法采集血样,用血糖仪测定所有实验大鼠的空腹(禁食8h)血糖水平。以空腹条件下2次血糖值≥11.1mmol/L为糖尿病造模成功大鼠[11-13]。
1.3.2 实验分组与样品采集
给药后大鼠自由采食与饮水,于15d随机选取8只模型大鼠(模型1组)和8只正常对照大鼠(对照1组),禁食12h后断头处死并静脉采血,分离血清,-20℃保存备用;取左肾,液氮速冻后转到-80℃冰箱保存;其余16 只(模型2组和对照2组各8只)大鼠继续观察15d后,断头处死,同上取样并处理。
1.3.3 ACE、ACE2、AT1、Mas在糖尿病大鼠肾脏中mRNA水平分析
1.3.3.1 肾脏组织中总RNA的提取
取约100mg的肾组织,采用TRIzol一步抽提法提取肾脏组织的总RNA。紫外比色法(OD260nm和OD280nm)测定总RNA 的浓度和纯度。
1.3.3.2 反转录
各样品取RNA 2μg,在25μL体系进行反转录成cDNA。反转录产物于-20℃保存备用。
1.3.3.3 目的基因引物设计
目的基因和β-actin内标引物序列是根据GenBank上序列,采用Primer 5.0软件设计,由上海英俊技术有限公司合成,引物序列及参数见表1。

表1 ACE2, ACE, AT1, Mas和β-actin引物参数Table 1 Parameters of primer pairs for ACE2, ACE, AT1, Mas and β-actin genes
以β-actin作为内参,对ACE2、ACE、AT1、Mas基因进行实时荧光定量分析。实时荧光定量PCR采用SYBR Green染料,三步法检测目的基因的相对表达,反应条件为:95℃预变性3min;95℃变性20s,58~62℃退火30s,72℃延伸30s,共40个循环,利用相对定量ΔΔCt法进行数据统计。
1.3.4 肾脏组织中肾素活性和AngⅠ、Ang Ⅱ含量测定
放射免疫分析法(radioimmunoassay,RIA)测定肾脏组织中肾素活性和AngⅠ、AngⅡ含量。具体操作均按试剂盒说明书进行。
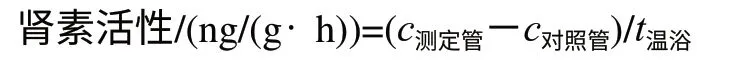
式中:c测定管为测定管肾素含量/(ng/g);c对照管为对照管肾素含量/(ng/g);t温浴为温浴时间/h。
1.4 数据统计
2 结果与分析
2.1 ACE2、ACE、AT1和Mas在糖尿病大鼠肾脏组织中mRNA水平分析
2.1.1 ACE2、Mas在糖尿病大鼠肾脏组织中mRNA水平分析

图 1 ACE2、Mas在对照组和模型组大鼠肾脏中mRNA水平变化(n=8)Fig.1 Comparison of the renal exression levels of ACE2 and Mas mRNA between the control groups and the model groups (n=8)
由图1可知,与对照组相比,模型1组大鼠肾脏组织中ACE2和其Mas受体mRNA表达升高(对照组ACE2:1.63±0.30,模型组ACE2:1.81±0.74,P=0.07)和(对照组Mas:1.30±0.15,模型组Mas:1.51±0.19,P=0.085),但无显著性差异。模型2组大鼠肾脏组织中ACE2 mRNA表达显著低于对照组(对照组:1.25±0.24,模型组: 0.32±0.01,P=0.032),Mas受体mRNA表达无显著变化(对照组:1.24±0.30,模型组:1.49±0.08,P=0.083)。
2.1.2 ACE、AT1在糖尿病大鼠肾脏组织中mRNA水平分析
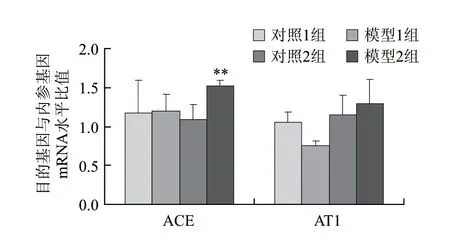
图 2 ACE、AT1在对照组和模型组大鼠肾脏中mRNA水平变化(n=8)Fig.2 Comparison of the renal expression levels of ACE and AT1 mRNA between the control groups and the model groups (n=8)
由图2可知,与对照1组相比,模型1组大鼠肾脏ACE mRNA表达升高,无显著性差异(模型组:1.17±0.42,对照组:1.20±0.21,P=0.92),AT1 mRNA表达下降 (对照组:1.05±0.13,模型组:0.76±0.05,P=0.15);模型2组大鼠肾脏组织中ACE mRNA的表达升高,差异显著 (对照组:1.09±0.19,模型组:1.52±0.07,P=0.008),AT1受体有同样升高趋势,无显著性差异(对照组:1.15±0.25,模型组:1.29±0.31,P=0.12)。
2.2 ACE mRNA/ACE2 mRNA比值分析
由表2可知,与对照组相比,模型1组大鼠肾脏组织中ACE mRNA/ACE2 mRNA降低,而模型2组中两者的比值与对照2组相比极显著升高(P<0.01),提示在糖尿病肾损伤15d(模型1组)时ACE2的表达占优势,而在30d(模型2组)时ACE mRNA表达占优势。

表2 对照组和模型组大鼠肾脏ACE/ACE2 mRNA的比较(n=8)Table 2 Comparison of ACE/ACE2 mRNA expression ratio between the control groups and the model groups (n=8)
2.3 肾脏组织中肾素活性和AngⅠ、AngⅡ含量测定结果分析
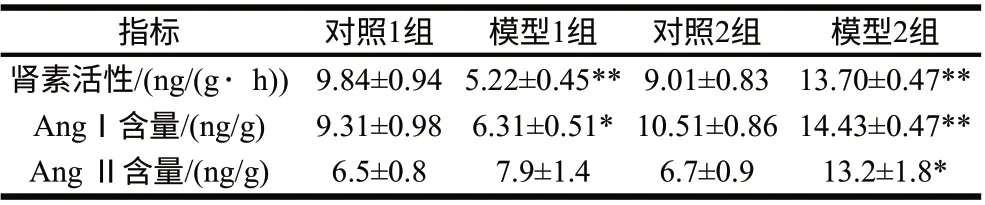
表3 对照组和模型组大鼠肾脏中肾素活性和AngⅠ、Ang Ⅱ含量比较(n=8)Table 3 Comparison of renin activity and the contents of AngⅠ and AngⅡ between the control groups and the model groups (n=8)
由表3可知,与对照组相比,模型1组肾脏组织中肾素活性极显著降低(P=0.0034),AngⅠ含量也降低(P=0.036),而AngⅡ含量稍有升高,但差异无统计学意义(P=0.35);模型2组肾脏组织肾素活性极显著高于对照2组肾素活性(P=0.0058),模型2组AngⅠ和AngⅡ含量高于对照2组两者的含量,且差异具有统计学意义(P=0.0025和P=0.03)。
3 讨 论
肾脏是产生RAS各组分的关键器官之一。ACE是RAS的核心酶,其酶解产物AngⅡ是RAS中最重要的效应因子。已有的研究认为AngⅡ对肾脏的生理及病理过程的调节具有重要作用[14]。过量的AngⅡ可使肾小球系膜细胞收缩改变滤过面积,刺激系膜细胞增殖,长期发展将导致肾小球损伤和肾功能丧失[15]。Crackower等[4]研究发现ACE2基因敲除小鼠表现为血压正常,血浆和局部组织中AngⅡ升高和严重的组织功能受损(如肾脏和心脏);但ACE和ACE2双重敲除的小鼠则不会出现此种状况,表现为血浆和局部组织AngⅡ水平正常,据此推测组织功能受损可能是由于高水平的AngⅡ引起的。本研究对STZ所致糖尿病肾损伤大鼠研究发现,在STZ所致的不同时期(15d和30d)的糖尿病肾损伤模型大鼠的肾脏局部组织中AngⅡ含量均升高,在糖尿病肾损伤15d时(模型1组)AngⅡ升高4.7%,而在糖尿病肾损伤30d(模型2组)时则升高28.7%,提示肾脏局部组织中高水平的Ang Ⅱ可能加重肾脏组织的损伤。
ACE2是新近发现的ACE的同系物但与ACE功能相反,在RAS中ACE2-Ang-(1-7)轴和ACE- Ang Ⅱ轴之间存在着平衡状态,ACE2-Ang-(1-7)轴在RAS中起对抗ACEAng Ⅱ轴的作用,ACE2/ACE之间的相对平衡决定着AngⅡ的生成量[7,14,16]。本研究对糖尿病肾损伤大鼠研究发现,不同时期糖尿病肾损伤大鼠肾脏中ACE2 和ACE mRNA水平有很大差异。与对照组相比,15d时(模型1组)ACE和ACE2的mRNA表达均升高,ACE/ACE2 mRNA比值降低;而在30d(模型2组)时ACE2 mRNA显著降低,ACE mRNA表达升高从而导致两者比值升高且差异具有统计学意义。在机体复杂的内环境系统中,影响和调节ACE/ACE2基因和蛋白表达的因素非常多,推测这是机体的一种代偿机制,在糖尿病肾脏损伤发生发展过程中,ACE/ACE2均被激活,损伤初期ACE/ACE2在一个较低水平达到平衡,控制过量AngⅡ生成,暂时减缓病程的发展;而在中后期时ACE/ACE2在一个较高水平上相互对抗,引发RAS失衡,使AngⅡ累积,最终加剧肾组织损伤。
Danser[17]在动物实验上证实,肾素可以通过其受体直接发挥血管紧张素的作用,肾素受体的过度表达可以使血压升高,血浆醛固酮升高,肾皮质的环氧化酶-2的表达增加。Brown等[18]的研究发现,高血糖可激活肾脏局部RAS使肾素活性明显增强,使得AngⅠ和AngⅡ含量增加。本研究表明,在糖尿病肾损伤30d(模型2组)大鼠肾脏组织中的肾素活性和AngⅠ含量均显著升高,与AngⅡ水平变化趋势相同,与Brown等[18]的结果一致,而糖尿病肾损伤15d(模型1组)结果正好相反,大鼠肾脏组织中的肾素活性和AngⅠ含量降低。提示在糖尿病早期肾素活性下调,AngⅠ含量降低可能是RAS保护组织受损的一种机制。
本实验中也对肾脏组织中Ang-(1-7)的受体Mas、AngⅡ的受体AT1的mRNA表达进行了研究,结果发现,糖尿病肾损伤15d(模型1组)大鼠肾脏组织中的Mas受体mRNA表达有升高趋势;30d(模型2组)大鼠肾组织中的AT1受体mRNA表达升高,因此,认为ACE-AT1轴和ACE2-Mas轴异常是引发糖尿病肾损伤的一个重要原因,其机理一方面可能是ACE-AngⅡ-AT1通路的过度激活加速了AngⅡ的生成;另一方面ACE2-Ang-(1-7)-Mas轴相对不足又减少了AngⅡ的降解和Ang(1-7)的生成,而过多的AngⅡ反馈抑制了ACE2的表达引起组织损伤。
综上所述,STZ致不同程度糖尿病肾脏局部RAS的激活程度不同,糖尿病初期以ACE2轴占主导,ACE2激活程度强于ACE,ACE2抗衡ACE的作用,控制过量AngⅡ的生成,对肾脏组织的损伤具有保护作用;糖尿病中末期ACE轴占优势,ACE激活程度强于ACE2,表现为肾脏局部组织中肾素活性增强,AngⅠ、AngⅡ含量显著升高,肾脏组织损伤加剧;ACE2在糖尿病肾损伤早期具有抗损伤作用,其抗损伤机理不完全是通过Mas受体介导,详细机制有待进一步的研究。
[1] DONOGHUE M, HSIEH F, BARONAS E, et al. A novel angiotensinconverting enzyme–related carboxypeptidase (ACE2) converts angiotensin Ⅰ to angiotensin 1-9[J]. Circulation Research, 2000, 87(5): e1-e9.
[2] CANALS M, JENKINS L, KELLETT E, et al. Up-regulation of the angiotensin II type 1 receptor by the MAS proto-oncogene is due to constitutive activation of Gq/G11 by MAS[J]. Journal of Biological Chemistry, 2006, 281(24): 16757-16767.
[3] HIGUCHI S, OHTSU H, SUZUKI H, et al. Angiotensin II signal transduction through the AT1 receptor: novel insights into mechanisms and pathophysiology[J]. Clinical Science, 2007, 112: 417-428.
[4] CRACKOWER M A, SARAO R, OUDIT G Y, et al. Angiotensinconverting enzyme 2 is an essential regulator of heart function[J]. Nature, 2002, 417: 822-828.
[5] YAGIL Y, YAGIL C. Hypothesis ACE2 modulates blood pressure in the mammalian organism[J]. Hypertension, 2003, 41(4): 871-873.
[6] MIZUIRI S, HEMMI H, ARITA M, et al. Expression of ACE and ACE2 in individuals with diabetic kidney disease and healthy controls[J]. American Journal of Kidney Diseases, 2008, 51(4): 613-623.
[7] SANTOS R A, FERREIRA A J, SIMÕES E SILVA A C. Recent advances in the angiotensin-converting enzyme 2-angiotensin (1-7)-Mas axis[J]. Experimental Physiology, 2008, 93(5): 519-527.
[8] 李鹏飞, 郑君希, 张伟, 等. 血管紧张素转换酶 Ⅱ 在中毒大鼠肝脏中的作用与机制分析[J]. 畜牧兽医学报, 2010, 41(3): 353-359.
[9] 王艳霞, 张伟, 韩东宁, 等. 血管紧张素转化酶 2 (ACE2) 对大鼠肾氧化应激损伤的保护作用及其机制[J]. 农业生物技术学报, 2011, 19(5): 881-886.
[10] 沈亚非, 徐焱成. 链脲佐菌素诱导实验性糖尿病大鼠模型建立的研究[J]. 实用诊断与治疗杂志, 2005, 19(2): 79-80.
[11] SHARMA K, JIN Y, GUO J, et al. Neutralization of TGF-β by anti-TGF-β antibody attenuates kidney hypertrophy and the enhanced extracellular matrix gene expression in STZ-induced diabetic mice[J]. Diabetes, 1996, 45(4): 522-530.
[12] YE M, WYSOCKI J, WILLIAM J, et al. Glomerular localization and expression of angiotensin-converting enzyme 2 and angiotensinconverting enzyme: implications for albuminuria in diabetes[J]. Journal of the American Society of Nephrology, 2006, 17(11): 3067-3075.
[13] ZHANG W, MIAO J, MA C, et al. β-Casomorphin-7 attenuates the development of nephropathy in typeⅠdiabetes via inhibition of epithelial-mesenchymal transition of renal tubular epithelial cells[J]. Peptides, 2012, 36(2): 186-191.
[14] INGELFINGER J R. ACE2: a new target for prevention of diabetic nephropathy?[J]. Journal of the American Society of Nephrology, 2006, 17(11): 2957-2959.
[15] MITSUHASHI T, NAKAYAMA H, ITOH T, et al. Immunochemical detection of advanced glycation end products in renal cortex from STZ-induced diabetic rat[J]. Diabetes, 1993, 42(6): 826-832.
[16] TIPNIS S R, HOOPER N M, HYDE R, et al. A human homolog of angiotensin-converting enzyme cloning and functional expression as a captopril-insensitive carboxypeptidase[J]. Journal of Biological Chemistry, 2000, 275(43): 33238-33243.
[17] DANSER A H. Novel drugs targeting hypertension: renin inhibitors[J]. Journal of Cardiovascular Pharmacology, 2007, 50(2): 105-111.
[18] BROWN L, WALL D, MARCHANT C, et al. Tissue-specific changes in angiotensin Ⅱ receptors in streptozotocin-diabetic rats[J]. Journal of Endocrinology,1997, 154(2): 355-362.
