酪蛋白糖巨肽和乳铁蛋白灌胃对小鼠肠道微生物定殖抗力的影响
2013-08-07任效东陈庆森李俊洁周丽丽阎亚丽
任效东,陈庆森*,李俊洁,周丽丽,阎亚丽
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
酪蛋白糖巨肽(casein glycomacropeptide,CGMP)是一种糖基磷酸肽,其主要是在生产干酪的过程中,由κ-酪蛋白经凝乳酶(rennet enzyme)降解后产生的一类含糖链的多肽片段[1]。在1965年Delfour等[2]利用凝乳酶作用κ-酪蛋白的特定部位,发现产生副κ-酪蛋白和可溶于12%三氯乙酸(TCA)水溶液的多肽片段,该多肽部分含有丰富的糖链基团,因而被称为糖巨肽,由于来自酪蛋白所以统称为CGMP。近年来国内外的学者大量研究和报道了CGMP的生物学活性,其中包括:结合霍乱毒素和大肠杆菌肠毒素[3-4];抑制细菌和病毒吸附[5];促进双歧杆菌增殖[6];调节免疫系统应答[7];抑制胃酸分泌[8]等。同时CGMP不含有芳香族氨基酸,所以可作为苯丙酮尿症(PKU)患者的专用蛋白质的来源[9]。
乳铁蛋白(lactoferrin,Lf)是一种分子质量约为80kD的铁结合性糖蛋白,主要存在于哺乳动物的各种外分泌物中[10]。1960年首先由Groves从牛乳中分离获得,因与铁结合呈红色故称之为“红蛋白”[11]。由于Lf兼具抗菌和多种生物学功能,既可用作食品和化妆品的天然防腐剂,也可以直接作为功能性食品、保健品或药品来防治感染性疾病,现已广泛应用于食品、医疗领域[12-13]。
肠道微生物定殖抗力(colonization resistance,CR)是于1971年由荷兰的微生物学家van der Waaij等[14]提出的,肠道内源性专性厌氧菌具有抑制消化道内主要需氧菌的潜在的致病菌群数量的作用。Vollaard等[15]认为在粪便内需氧革兰氏阴性杆菌、酵母菌和肠球菌的数量可以作为肠道微生物定殖抗力的指标。肠道菌群间形成的相互协调、制约的微生态环境与人体健康密切相关。近年来随着厌氧菌培养技术的发展,对肠道厌氧菌的作用尤其是双歧杆菌具有的作用有了比较透彻的了解。通过用双歧杆菌数量与肠杆菌数量的对数值比值(B/E值)来作为CR的指标,使其具有很重要的临床意义。由于B/E值包括了肠道内组成定殖抗力主要的有益专性厌氧菌——双歧杆菌与主要需氧条件下的致病菌——肠杆菌这两部分,所以其能更加全面、简洁地反映出肠道内的定殖抗力的概况。同时B/E值的确定可能也便于指导临床应用微生态活菌制剂[16]。
本研究从肠道微生物定殖抗力的定义出发,以正常小鼠作为研究对象,用乳源CGMP和Lf进行干预,通过对小鼠肠道粪便中双歧杆菌和肠杆菌定性、定量检测,探讨粪便中双歧杆菌和肠杆菌的数量的变化,以B/E值作为肠道微生物定殖抗力的指标,阐明2种乳源生物活性肽在促进动物肠黏膜对有益菌的定殖力水平,以及维系肠道微生物菌群健康的作用,也为乳源生物活性肽广泛应用于肠道健康提供科学基础。
1 材料与方法
1.1 实验动物
BALB/c雄性健康小鼠(SPF级,8周龄,体质量(25±2)g)、小鼠常规饲料,购自中国人民解放军军事医学科学院实验动物中心。
1.2 试剂与仪器
L-盐酸半胱氨酸、X-Gal 拜尔迪生物技术有限公司;乳铁蛋白和CGMP 新西兰Tatua公司;琼脂粉 北京奥博星生物科技有限责任公司;伊红美蓝琼脂(EMB)和改良的MRS培养基 青岛高科园海博生物技术有限公司。
MLS-3750三洋全自动灭菌锅 日本三洋公司;SPX-250BS-II生化培养箱 上海新苗医疗器械制造有限公司;FA2004A电子分析天平 上海沪西分析仪器有限公司;XW-80A微型旋涡混合仪 上海沪西分析仪器有限公司;可调节移液器及吸头 德国普兰德(Brand)公司。
1.3 CGMP溶液和Lf溶液的配制
1.3.1 CGMP溶液
准确称取0.063g的CGMP置于10mL的离心管中,加入无菌的生理盐水6mL,充分混匀,作为CGMP的母液备用(质量浓度为10.5mg/mL),用CGMP的母液配成质量浓度分别为0.3、0.5、0.7mg/mL的溶液,每天用前新鲜配制。
1.3.2 Lf溶液
准确称取0.05g 的乳铁蛋白置于10mL的离心管中,加入无菌的生理盐水5mL,充分混匀,作为乳铁蛋白的母液备用(质量浓度为10mg/mL),用Lf的母液配成质量浓度分别为0.01、0.1、1mg/mL的溶液,每天用前新鲜配制。
1.4 方法
1.4.1 分组和给药
实验小鼠购得后适应饲养一周之后随机分为8组,每组6只,各组喂以基础饲料;实验期间,每天给小鼠灌胃,各组小鼠均自由取食和饮水,灌胃的周期为14d。组别、实验项目及灌胃剂量见表1。

表1 组别、实验项目及灌胃剂量Table 1 Mouse groups and corresponding administration doses
1.4.2 粪便样品的处理
“重要的是,这些巨噬细胞会发生和许多吸烟者及慢性阻塞性肺疾病患者中的巨噬细胞相似的病理变化。”这项研究的主要研究人员指出,肺泡巨噬细胞属于免疫细胞,能够吞噬和清除灰尘、细菌和过敏源,电子烟蒸汽会损害这些功能。因此,电子烟的危害或许比过去认为的更大。
分别于第0(即灌胃前1d)、3、7、11、15、21天(即停止灌胃后第6天)用逼迫法在无菌条件下分别采集8组小鼠的新鲜粪便,每组粪便样品放入2支已灭菌的小试管中,每管约0.1g粪便,称质量,分别置于10mL灭菌的生理盐水中,然后将试管置于XW-80A微型旋涡混合仪上进行充分振荡混匀,再用无菌生理盐水将8组粪便悬液依次进行10倍稀释至10-5稀释度。
1.4.3 肠道B/E值的检测和分析
1.4.3.1 双歧杆菌的培养及计数
利用传统菌群鉴定的方法,选择10-3、10-4、10-5稀释度的样品0.5mL采用倾注平板法在改良的MRS培养基上于37℃条件下进行厌氧培养,每个稀释度做3个平行板,于(72±3)h后进行观察以及菌落计数,结果以每克粪便中的细菌菌落数的对数值表示。
1.4.3.2 肠杆菌的培养及计数
利用传统菌群鉴定的方法,选择10-2、10-3、10-4稀释度的样品0.5mL采用倾注平板法在伊红美蓝琼脂培养基上于37℃进行培养,每个稀释度做3个平行板,于(48±3)h后进行观察以及菌落计数,结果以每克粪便中的细菌菌落数的对数值表示。
1.4.3.3 B/E值的检测[16]

1.4.4 统计方法
2 结果与分析
2.1 CGMP对BALB/c小鼠肠道双歧杆菌的影响
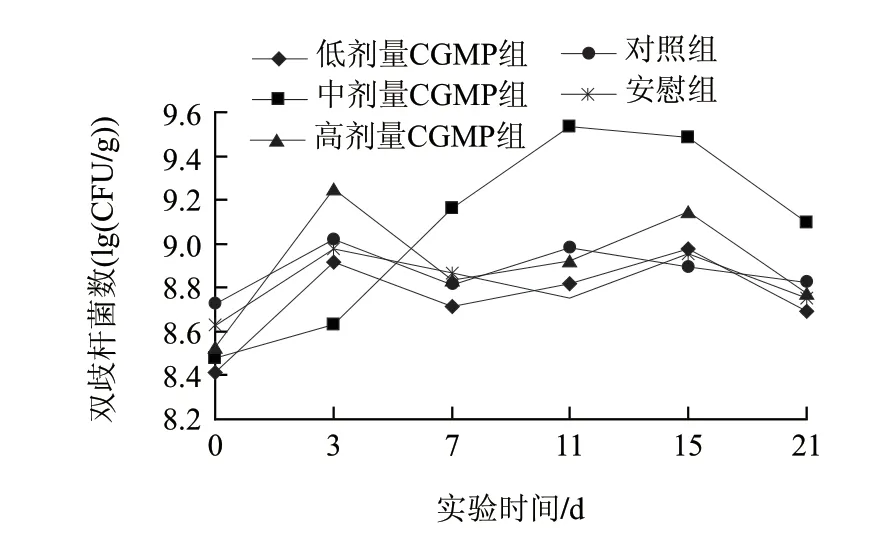
图 1 CGMP对小鼠肠道双歧杆菌的影响Fig.1 Effect of CGMP on intestinal Bifi dobacterium numbers of mice in different groups
以正常小鼠为实验对象,由图1可知,对照组和安慰组肠道内双歧杆菌的水平没有明显的变化,两种干预条件下,生理波动范围是4.22×108~1.05×109CFU/g。低剂量CGMP组和高剂量CGMP组的波动趋势与对照组、安慰组基本一致,在2.61×108~1.78×109CFU/g之间波动,通过SPSS11.5统计软件进行显著性检验,不存在显著性差异(P>0.05),即对小鼠肠道双歧杆菌的增殖作用不显著。从高剂量的CGMP组第0~3天的结果可以看出,双歧杆菌的数量有显著的增长,说明高剂量(即CGMP质量浓度达到0.14mg/mL)CGMP可以有效地促进双歧杆菌的增殖,但随后促进效果并不明显,分析表明高剂量连续干预小鼠肠黏膜发生耐受,导致双歧杆菌数量的明显下降;随后肠道干预适应性增强,双歧杆菌菌数不断升高;到干预结束菌数明显下降。中剂量的CGMP组与对照组、安慰组相比,其双歧杆菌的水平在3.00×108~3.44×109CFU/g之间波动,存在显著性差异(P<0.05)。中剂量组在干预的第3天后双歧杆菌的数量就发生了很大的变化,并处于直线上升的趋势,在第11天达到最高值(3.44×109CFU/g)。但当第15天停止灌胃后,双歧杆菌的数量虽然有所回落,但在6d后的检测小鼠粪便双歧杆菌的数量水平仍高于灌胃前1个数量级。该研究结果提示,给实验动物以灌胃方式干预小鼠肠道双歧杆菌增殖,非常显著地存在小分子短肽剂量与增殖效果的相关性。
2.2 乳铁蛋白对BALB/c小鼠肠道双歧杆菌的影响
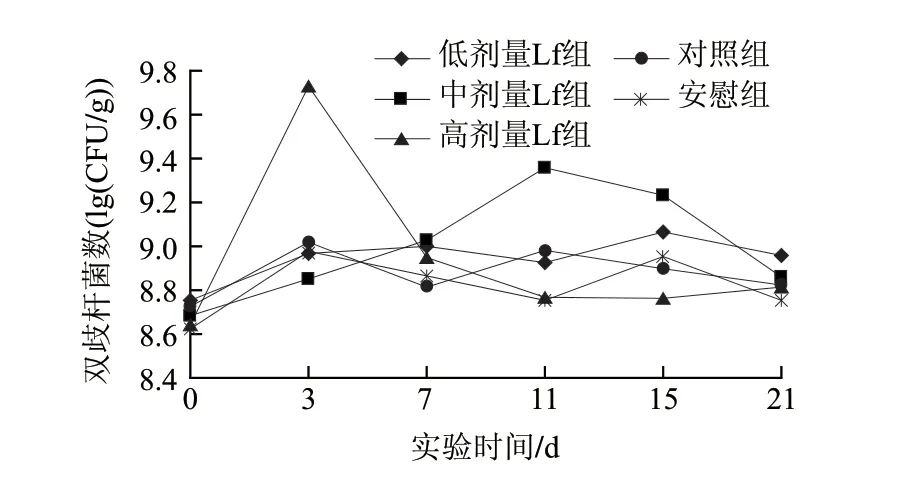
图 2 乳铁蛋白对小鼠肠道双歧杆菌的影响Fig.2 Effect of Lf on intestinal Bifi dobacterium numbers of mice in different groups
由图2可知,对于正常小鼠其对照组、安慰组和低乳铁蛋白组肠道内双歧杆菌的菌数的影响水平基本上一致,表明低剂量的干预对肠道内双歧杆菌没有促进增殖的作用,统计分析表明不存在显著性差异(P>0.05),其波动范围为4.22×108~1.16×109CFU/g。高剂量的乳铁蛋白组在第0~3天取样的检测结果可以看出,双歧杆菌的数量有显著的增长且达到最高值(5.40×109CFU/g),但从第7天以后的分析结果来看,肠道中双歧杆菌的数量回落到对照组和安慰剂组的水平,说明刚开始(1~3d)灌胃大剂量的乳铁蛋白可以有效地促进双歧杆菌的增殖作用;随着干预时间的延长,小鼠肠道内双歧杆菌的菌数水平降低,可能是因为肠道黏膜中的双歧杆菌对乳铁蛋白刺激存在明显的耐受性。中剂量的乳铁蛋白组与对照组、安慰组相比,其增殖肠内双歧杆菌的菌数水平在4.84×108~2.29×109CFU/g水平,存在显著性差异(P<0.05)。中剂量组在连续灌胃到11d(即1~11d的连续干预条件下)双歧杆菌的数量表现上升趋势,在第11天达到2.29×109CFU/g水平。但从11d以后的连续干预,使肠道内双歧杆菌的菌数逐渐下降,表明一定剂量的乳铁蛋白的长时间连续干预对肠道内有益菌的增殖将发生负相关作用,也提示乳铁蛋白的剂量越高肠内双歧杆菌的耐受时间越短。当第15天停止灌胃后,连续干预的影响使肠道内双歧杆菌的数量明显地回落到对照组的水平。
2.3 CGMP对BALB/c小鼠肠道肠杆菌的影响
由图3可知,对照组和安慰组肠道内肠杆菌的数量没有明显的变化,在8.87×106~1.99×107CFU/g之间较窄的范围内变化。低剂量组对肠道肠杆菌影响的变化趋势与对照组和安慰组相比存在相似的趋势,不存在显著性差异(P>0.05),其波动范围在1.13×107~2.72×107CFU/g之间,说明低剂量的CGMP对肠道内肠杆菌数量的影响存在微弱的促进作用。中剂量CGMP组从第3、7天的取样分析结果看,显示较为明显的促进肠内肠杆菌的增殖作用;从实验的第7天开始肠道肠杆菌的数量明显减少且下降的幅度很大,连续灌胃的第7~21天的波动范围为3.14×107~5.14×106CFU/g,存在显著性差异(P<0.05),说明灌胃合适剂量的CGMP可以有效地抑制肠杆菌的增殖,降低了条件致病菌的致病几率。相比之下,灌胃高剂量的CGMP则在一定程度上起到了促进肠道肠杆菌增殖的作用,其波动范围8.41×106~3.66×107CFU/g。
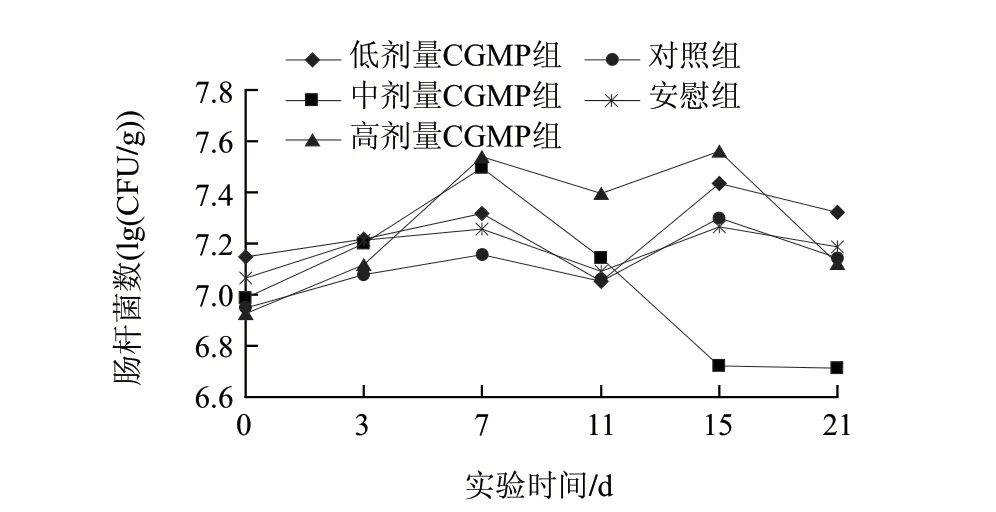
图 3 CGMP对小鼠肠道肠杆菌的影响Fig.3 Effect of CGMP on intestinal Enterobacter numbers of mice in different groups
2.4 乳铁蛋白对BALB/c小鼠肠道肠杆菌的影响
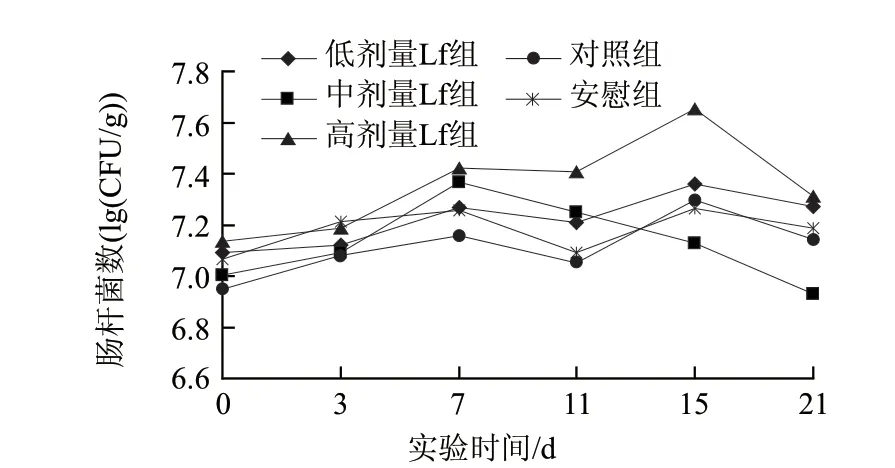
图 4 乳铁蛋白对小鼠肠道肠杆菌的影响Fig.4 Effect of Lf on intestinal Enterobacter numbers of mice in different groups
由图4可知,低剂量的乳铁蛋白组肠道内肠杆菌的数量上下缓慢波动(1.24×107~2.29×107CFU/g),其变化趋势与对照组和安慰组相比基本一致,没有明显变化,统计分析表明,低剂量的乳铁蛋白对肠杆菌的影响不存在显著性差异(P>0.05)。中剂量组在干预的前7d肠道内肠杆菌的水平变化趋势与对照组、安慰组基本一致,但从实验的第7天开始肠道肠杆菌的数量明显减少且下降的幅度较大,存在显著性差异(P<0.05),其波动范围在8.50×106~2.33×107CFU/g之间,说明灌胃合适剂量的乳铁蛋白可以有效地抑制肠杆菌的增殖,降低了条件致病菌的致病几率。相比之下,连续灌胃高剂量的乳铁蛋白15d,肠道内肠杆菌的数量缓慢波动呈上升趋势,在停止灌胃后肠道内肠杆菌的数量虽然有所下降,但其仍然高于灌胃前肠杆菌的数量,说明高剂量的乳铁蛋白在一定程度上促进了小鼠肠道肠杆菌的增殖。
2.5 CGMP和乳铁蛋白对BALB/c小鼠肠道B/E值的影响
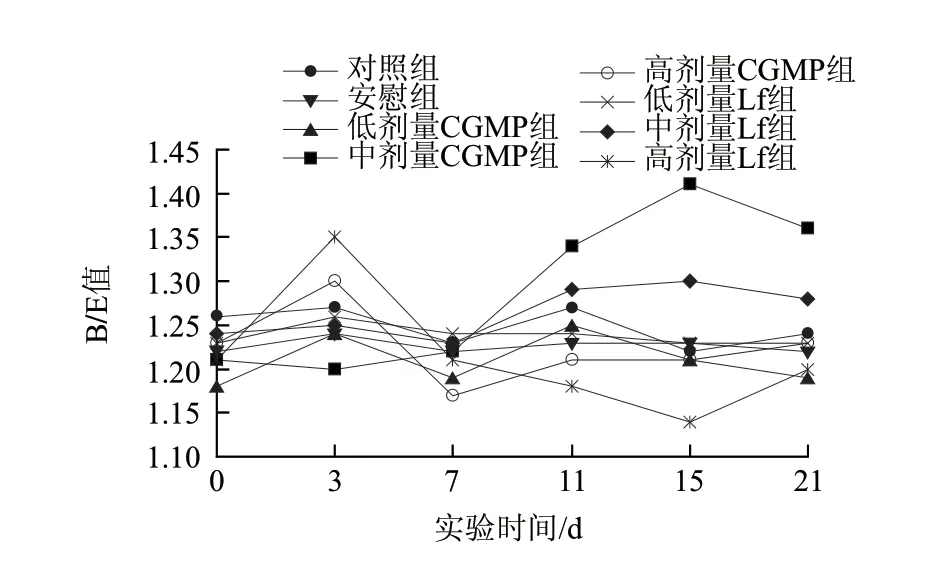
图 5 CGMP和乳铁蛋白对小鼠肠道B/E值的影响Fig.5 Effect of CGMP and Lf on intestinal B/E ratio of mice in different groups
由图5可知,安慰组对小鼠肠道B/E值的波动趋势与对照组基本一致,均为缓慢的上下波动,其波动范围在1.22~1.27之间。低剂量CGMP组和低剂量乳铁蛋白组与对照组、安慰组相比B/E值的波动趋势没有大的变化,不存在显著性差异(P>0.05),说明灌胃低剂量的CGMP和乳铁蛋白对小鼠肠道B/E值没有明显的影响。
高剂量CGMP组B/E值在第3天时达到最高值1.3,随后在第7天下降到最低值1.17,后有缓慢的回升,说明刚开始(1~3d)灌胃大剂量的CGMP可有效地促进双歧杆菌的增殖,对肠杆菌的作用并不明显,在第7天时双歧杆菌的数量明显下降,相对的肠杆菌的数量是上升的,随后两种菌群的数量均呈上下波动。高剂量乳铁蛋白组B/E值也是在干预的第3天达到最高值1.35,随后一段时间内(3~15d)B/E值呈直线下降趋势,在第15天达到最低值1.14,停止灌胃6d后有所回升,说明在干预开始时连续灌胃高剂量的乳铁蛋白3d,可以有效地促进双歧杆菌的增殖,对肠杆菌的作用效果不明显,但随后双歧杆菌的增殖受到抑制,相反的,肠杆菌的增殖受到了促进,停止灌胃6d后取样分析表明肠杆菌的数量有所下降。
中剂量的CGMP和乳铁蛋白组在实验的前期B/E值的变化趋势与对照组、安慰组基本一致,没有较大的波动,但在第7天开始有上升的趋势,存在显著性差异(P<0.05),且在停止灌胃后6d均有所回落。中剂量乳铁蛋白组B/E值的波动范围为1.23~1.30,在第7天达到最低值(1.23)后开始上升,在第15天达到最高值(1.3)后开始回落。在干预的前7d两种菌群均为上升趋势,在第7天肠杆菌上升到最高值后开始回落,而双歧杆菌在第7天后继续上升到干预的第11天达到最高值后开始回落,在第11~15天肠杆菌的下降速率比双歧杆菌的下降速率快,因而B/E值呈上升趋势;但停止灌胃6d后双歧杆菌的下降速率比肠杆菌的快,B/E值呈下降趋势。中剂量CGMP组B/E值的波动范围在1.20~1.41之间,在第0天到干预的第7天B/E值的波动趋势不明显,但在随后的一段时间内(7~15d)呈直线上升趋势,在干预的第15天达到最高值1.41后开始回落。在CGMP干预的第3~11天双歧杆菌呈直线上升达到最高值,随后到第15天有缓慢的回落趋势,而肠杆菌是在第7~15天呈直线下降,因而B/E值在第7~15天呈直线上升,而在第3~7天两种菌群均为上升,但双歧杆菌的上升速率较快,因而B/E值呈缓慢上升。停止灌胃6d后,双歧杆菌的数量下降趋势比肠杆菌的显著,则B/E值有所回落。通过以上分析表明,中剂量的CGMP对小鼠肠道B/E值的促进作用比中剂量的乳铁蛋白的促进作用更为显著。
从以上肠道微生物定殖抗力指标(B/E值)的分析表明,低剂量的CGMP和乳铁蛋白对小鼠肠道B/E值的影响不显著,中剂量的CGMP和乳铁蛋白均可使B/E值增加,但中剂量的CGMP对小鼠肠道B/E值的促进作用比中剂量的乳铁蛋白的促进作用更为显著。高剂量的CGMP和乳铁蛋白在实验前期(1~3d)均可使B/E值增加,随后高剂量的CGMP对B/E值的影响不大,而高剂量的乳铁蛋白则使B/E值上下波动明显。
3 结论与讨论
尽管有关CGMP和乳铁蛋白促进和调控肠道双歧杆菌和肠杆菌变化规律的研究报道很少,但已有研究表明,胃肠道正常的双歧杆菌和肠杆菌的菌群参与了生物体的生理、生化、病理和药理的全过程,这些正常的菌群实际上已成为宿主生命必需的组成部分,而这也会对生命奥秘的揭示做出重大的贡献[17-19]。本研究利用CGMP和乳铁蛋白对小鼠肠道B/E值的影响进行了系统的研究,得到了如下的研究结果:1)利用传统菌群鉴定的方法,研究证实了CGMP和乳铁蛋白的最佳口服剂量分别为0.5mg/mL和0.1mg/mL作为肠道中有益菌的增殖底物。且灌胃中剂量的CGMP对小鼠肠道B/E值的影响最为显著,B/E值显著增加,特别是明显地促进双歧杆菌增殖,且抑制肠杆菌增殖。2)本研究证实了肠道B/E值具有作为肠道微生物定殖抗力指标。在国内外的研究中曾提出B/E值可作为肠道定殖抗力的指标,并且认为B/E值小于1表示肠道定殖抗力受损[14-16,20]。在本研究结果中显示各组B/E值均大于1表示肠道定殖抗力正常。3)从2种乳源生物活性短肽对小鼠肠道内双歧杆菌和肠杆菌的影响研究表明,不同剂量的生物活性短肽对肠道内不同菌属的作用功效存在明显的剂量依赖性关系。研究还提示,小鼠肠道内不同微生物种属尚表现对一定干预时间的适应能力,说明生物活性物质对动物肠道微生物的干预具有耐受性的特征。研究获得的这些成果与本实验室前期研究[21]的结论是一致的。
本研究结论对CGMP和乳铁蛋白与机体肠道菌群关系的研究具有很好的应用价值。根据粪便中B/E值的变化,评价正常小鼠肠道微生物定殖抗力,为CGMP和乳铁蛋白的功能特性的广泛应用提供一定的理论依据。
[1] 曹晋宜, 陈庆森, 王友湘, 等. 酪蛋白糖巨肽(CGMP)对小鼠肠道菌群消长规律的影响[J]. 食品科学, 2007, 28(11): 536-540.
[2] DELFOUR A, JOLLÈS J, ALAIS C. Caseino-glycopeptides: characterization of a methionine residue and of the N-terminal sequence[J]. Biochemical and Biophysical Research Communications, 1965, 19(4): 452-455.
[3] YOSHIHIRO K, SHUNICHI D. Process of producing κ-casein glycomacropeptides: United States Patent, 5278288[P]. 1994-06-08.
[4] WOROBOL R, KIM B C, KIM S, et al. Detection of choleratoxin-binding activity of glycomacropeptide from bovine κ-casein and optimization of its production by use of response surface methodology[J]. Dairy Foods, 1998, 81(1): 28-31.
[5] SHUNICHI D, HIROKO K, EIKI D, et al. Infection protectant: United States Patent, 5147853[P]. 1992.
[6] 李海平, 程涛, 霍贵成, 等. 乳源糖巨肽的生物活性[J]. 中国乳品工业, 2002, 30(5): 74-77.
[7] OTAIN H, HATA I. Inhibition of proliferative responses of mouse spleen lymphocytes and rabbit Peyer’s patch ceils by bovine milk caseins and their digests[J]. Journal of Dairy Research, 1995, 62(2): 339-348.
[8] BRODY E P. Biological activities of bovine glycomacropeptide[J]. British Journal of Nutrition, 2000, 84(1): 39-46.
[9] 朱晨晨, 陈庆森. 乳源酪蛋白糖巨肽改善炎症性肠病的研究进展[J]. 食品科学, 2012, 33(1): 262-266.
[10] 罗献梅, 陈代文, 张克英. 乳铁蛋白及其活性肽的营养生理作用及应用前景[J]. 饲料工业, 2005, 26(2): 5-9.
[11] 陈莎莎, 丁月云, 金融, 等. 乳铁蛋白的抑菌作用及其机制[J]. 中国乳品工业, 2007, 35(5): 53-58.
[12] 曹阳, 包永明, 安利佳, 等. 乳铁蛋白研究现状[J]. 食品科学, 2002, 23(12): 132-138.
[13] TANAKA K, IKEDA M, KATO N. Property of lactoferrin and ite application in patients with chronic hepatitis C(in Japanese)[J]. Bio Industy, 2000, 17: 45-51.
[14] van der WAAIJ D, de VRIES J M B, van der WEES J E C L. Colonization resistance of the digestive tract in conventional and antibiotic-treated mice[J]. Hygiene, 1971, 69(3): 405-411.
[15] VOLLAARD E J, CLASENCER H A L. Colonization resistance[J]. Antimicrob Agents Chemother, 1994, 38: 409-414.
[16] 吴仲文, 李兰娟, 马伟杭, 等. 肠道微生物定殖抗力的新指标: B/E值[J]. 浙江预防医学, 2000, 12(7): 4-6.
[17] CHEN Qingsen, CAO Jinyi, JIA Yuchen, et al. Modulation of mice fecal microbiota by administration of casein glycomacropeptide[J]. Microbiology Research, 2012, 3(e3): 8-12.
[18] 李俊洁, 陈庆森. 双歧杆菌V调理和改善肠道相关疾病作用的研究进展[J]. 食品科学, 2011, 32(23): 326-332.
[19] 刘雪姬, 陈庆森, 阎亚丽. 高脂饮食对小鼠肠道菌群的影响[J]. 食品科学, 2011, 32(23): 306-311.
[20] 吴仲文, 李兰娟, 马伟杭, 等. 肠道菌群正常参考值的检测[J]. 中国微生态学杂志, 2001, 13(6): 314-315.
[21] 曹晋宜, 陈庆森. 基于ERIC-PCR技术研究酪蛋白糖巨肽对小鼠肠道菌群结构的影响[J]. 中国微生态学杂志, 2010, 22(9): 769-772.
