酶法制备黑豆抗氧化肽及其分离纯化与氨基酸组成分析
2013-08-07刘恩岐唐仕荣巫永华
李 华,刘恩岐,,唐仕荣,巫永华
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,江苏 徐州 221008)
国内外研究发现[1-3],通过对蛋白质适当酶解可得到具有各种生物活性的功能肽,其中研究报道最多的是抗氧化肽,多肽在原蛋白序列中并无活性,一般通过胃肠道消化时释放出来的很少,但通过体外定向酶解并加以分离纯化,得到的肽段具有与天然活性肽类似或相同的功能。黑豆是种皮为黑色的大豆,属于高蛋白低脂肪类型大豆,通过酶法水解与分离纯化制备抗氧化黑豆肽类产品,尽管活性稍低,但价廉易得,易于吸收,安全性高,具有良好的开发前景[4-5]。蛋白质水解过程中,因肽键的断裂,氨基和羧基发生质子交换,溶液pH值会自动下降,采用单一的酶制剂水解过程中一般都要外加碱液来维持水解液的pH值以确保酶的最佳活性,增加了水解物下游处理过程的脱盐除杂难度。在没有外加碱的pH值渐变条件下,采用多酶组合分步水解有利于产品的后期分离精制和提高产品纯度,并且由于不同酶在底物上的作用位点不同,还能缩短水解时间,提高酶水解物中的多肽含量并减少氨基酸含量。本实验在Alcalase碱性蛋白酶、Neutrase中性蛋白酶和Flavourzyme风味蛋白酶单酶水解黑豆蛋白的基础上,在pH值渐变条件下,采用多酶组合分阶段水解的方式,研究确定提高黑豆蛋白酶解产物抗氧化活性的多酶组合水解工艺,进一步研究抗氧化黑豆肽的分离纯化技术和氨基酸组成。
超滤膜分离技术具有设备操作方便、能耗低、分离效果好等优点,是根据相对分子质量大小分离蛋白肽类物质的有效方法。大孔吸附树脂是一类新型非离子型高分子吸附剂,具有条件温和、容易再生、设备简单、操作方便等特性,是根据分子极性大小对肽类物质分离纯化的有效方法之一[6],已被广泛应用于生物活性肽的分离纯化。氧自由基清除能力(oxygen radical absorbance capacity,ORAC)是目前国际上应用范围较广且最为准确的体外抗氧化活性检测方法之一,具有生物相关性强、灵敏度高、稳定性与重现性好等特点,2004年在第一届抗氧化方法国际会议上被推荐为抗氧化活性评价的标准方法之一[7-9]。本研究在多酶组合水解实验确定的抗氧化活性相对最强的黑豆蛋白酶解液超滤分离的基础上,以不同体积分数的乙醇对大孔树脂吸附的黑豆肽进行洗脱分级,以ORAC值为测定指标评价超滤与大孔树脂吸附分离纯化抗氧化肽的效果,并通过测定黑豆肽氨基酸的组成,分析探讨不同性质氨基酸种类对抗氧化活性的贡献,为功能性黑豆肽的开发应用提供一定的依据。
1 材料与方法
1.1 材料与试剂
晚熟小粒黑豆由山西农业大学大豆育种研究室提供。
Alcalase碱性蛋白酶(2.4AU/g)、Neutrase中性蛋白酶(0.8AU/g)和Flavourzyme风味蛋白酶(500LAPU/g) 丹麦诺维信(Novozymes)生物技术有限公司(中国);AB-8、D101大孔吸附树脂 天津南开和成科技有限公司;DA201-C大孔吸附树脂 江苏苏青水处理工程集团有限公司;HPD-400大孔吸附树脂 沧州宝恩化工有限公司;荧光素钠(FL)、自由基产生剂2,2’-偶氮二异丁基脒二盐酸盐(C8H18N6·2HCl,AAPH)、水溶性VE(抗氧化标准物质Trolox) 美国Sigma-Alorich公司;还原型谷胱甘肽 美国Amresco公司;乙醇、磷酸二氢钾、磷酸氢二钾 国药集团化学试剂有限公司。
1.2 仪器与设备
Synergy H1全功能酶标仪 美国BioTek公司;ALPHA1-2 LO plus真空冷冻干燥机 德国Christe公司;Labscale TFF小型切向流超滤系统 美国Millipore公司;5417R台式高速冷冻离心机 德国Eppendorf公司;HYG-Ⅱ恒温调速摇瓶柜 上海欣蕊自动化设备有限公司。
1.3 方法
1.3.1 ORAC的测定[10-11]
用磷酸氢二钾和磷酸二氢钾配制75mmol/L的磷酸盐缓冲液(pH7.4),用磷酸盐缓冲液配制10μmol/L的FL溶液、0.1mol/L的AAPH溶液和质量浓度为1mg/mL的黑豆肽溶液。在96孔酶标板中,依次加入25μL黑豆肽样品、25μL FL溶液,最后用多道移液器迅速加入150μL AAPH诱发荧光淬灭反应,空白以25μL缓冲液磷酸代替样品。将微孔酶标板置于酶标仪振荡8s,振荡幅度4mm,在37℃条件下以激发波长485nm,发射波长535nm进行连续测定,每1min测定1次各孔荧光强度,测定时间设定在荧光衰减呈基线后为止。应用BioTek全功能酶标仪Gen5 数据分析软件得出荧光强度-时间曲线(荧光衰减曲线)下面的面积(AUC),通过黑豆肽荧光衰减曲线的保护面积(netAUC)与标准抗氧化物质水溶性VE(Trolox)及谷胱甘肽(GSH)的netAUC值比较,即可得出黑豆肽样品的ORAC值,即Trolox当量(μmol/L)和GSH当量(mmol/L)。
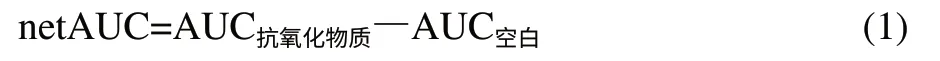
1.3.2 黑豆肽的酶法水解工艺与超滤分离
黑豆去皮粉碎、脱脂,采用碱提酸沉法制备黑豆分离蛋白。在Alcalase碱性蛋白酶、Neutrase中性蛋白酶和Flavourzyme风味蛋白酶最适水解温度和pH值条件下,对黑豆蛋白分别进行单酶水解实验,测定酶解物的水解度(甲醛滴定法)[12]和ORAC值。具体水解工艺条件为:料液比1:10(m/V),Alcalase碱性蛋白酶加酶量为蛋白质底物含量的2%、pH8.5、温度60℃;Neutrase中性蛋白酶加酶量为蛋白质底物含量的2%、pH7.0、温度50℃;Flavourzyme风味蛋白酶加酶量为蛋白质底物含量的2%、pH7.0、温度50℃。
在单酶水解实验的基础上,采用Alcalase、Neutrase与Flavourzyme分阶段水解的方式,对黑豆蛋白进行双酶或三酶组合水解实验。方法如下:先用Alcalase(温度60℃、pH8.5)水解黑豆蛋白,约30min后pH值降到7.0左右,加热钝化Alcalase碱性蛋白酶,再按4种不同组合方式加入Neutrase或Flavourzyme于50℃温度条件下进一步水解,提高黑豆蛋白的水解度和多肽含量[13],与单酶水解进行比较,研究探讨多酶水解不同组合方式对黑豆蛋白水解物ORAC值的影响。
采用Labscale TFF超滤系统对最佳酶解组合获得的抗氧化活性相对最强的黑豆肽溶液进行分离,控制蠕动泵转速为25~35r/min,超滤膜板出口压力为2.0×105Pa[14],将相对分子质量不同的各组分冻干后测其ORAC值。
1.3.3 大孔吸附树脂对黑豆肽的静态吸附与解吸[15]
将大孔吸附树脂用无水乙醇浸泡24h,用无水乙醇洗至220nm无吸收峰时,再用去离子水洗净。称取100g湿树脂于250mL锥形瓶中, 加入pH4.0、20mg/mL超滤纯化后的黑豆肽溶液100mL,置于25℃恒温摇床中150r/min振荡吸附,每隔30min测定溶液中的肽含量,按公式(2)计算吸附率,确定吸附平衡时间。
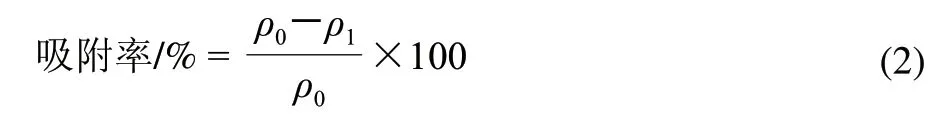
式中:ρ0为原液中肽的质量浓度/(mg/mL);ρ1为吸附后溶液中肽的质量浓度/(mg/mL)。
对充分吸附黑豆肽的大孔树脂进行乙醇洗脱,每隔30min测定解吸液中的肽浓度,按公式(3)计算解吸率,确定解吸平衡时间。
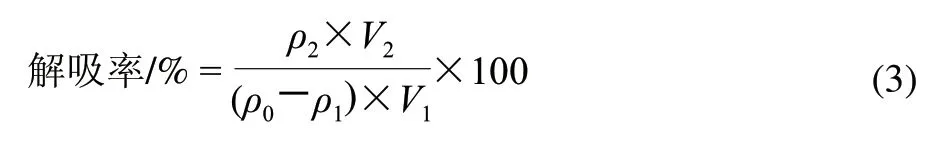
式中:ρ0为原液的肽质量浓度/(mg/mL);ρ1为吸附后溶液的肽质量浓度/(mg/mL);ρ2为解吸液的肽质量浓度/(mg/mL);V1为吸附液体积/mL;V2为解吸液体积/mL。
1.3.4 大孔树脂吸附黑豆肽的乙醇分级洗脱[16]
黑豆蛋白水解液经大孔吸附树脂充分吸附后,抽滤,弃去未吸附的溶液,用体积分数为25%、50%、75%和100%的乙醇依次洗脱,分别收集洗脱液,再浓缩、冷冻干燥后得到黑豆肽分级组分,并按公式(4)计算肽得率。将乙醇洗脱分级各黑豆肽组分用pH7.4的磷酸盐缓冲液配制成质量浓度为1mg/mL的肽溶液,测定比较其ORAC值。
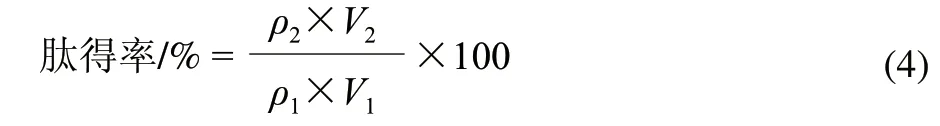
式中:ρ1为原液的肽质量浓度/(mg/mL);ρ2为解吸液的肽质量浓度/(mg/mL);V1为吸附液体积/mL;V2为解吸液体积/mL。
1.3.5 黑豆肽乙醇洗脱分级组分的氨基酸组成分析与疏水性值的计算[17]
按照国家标准GB/T 5009.124—2003《食品中氨基酸的测定》测定黑豆肽乙醇洗脱分级组分的氨基酸组成。根据每种氨基酸的疏水值和黑豆肽的氨基酸组成,按公式(5)和(6)计算黑豆肽分级组分的平均疏水性值[10]。
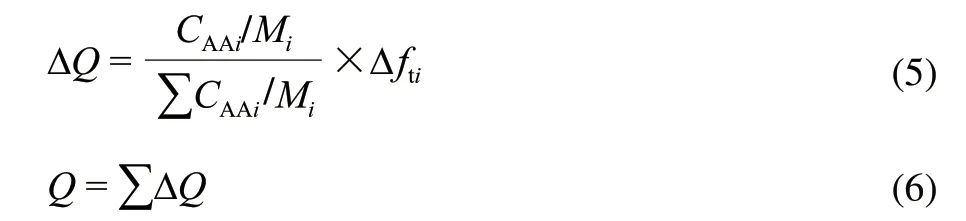
式中:CAAi为100g黑豆肽中每种氨基酸的含量/g;Mi为各种氨基酸的摩尔质量/(g/mol);ΣCAAi/Mi为100g肽中氨基酸的总物质的量/mol;Δfti为氨基酸侧链疏水值/(kJ/mol);Q为黑豆肽的平均疏水性/(kJ/mol)。
1.3.6 ORAC法Trolox与GSH当量值相关性的统计检验
采用Excel计算黑豆肽及其超滤组分与大孔树脂分离组分ORAC 值Trolox当量与GSH当量值结果之间的相关系数r,通过查统计分析临界r值表对相关系数r进行显著性检验[18]。
2 结果与分析
2.1 ORAC标准曲线的建立
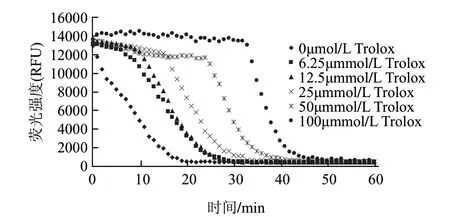
图 1 不同浓度的Trolox荧光淬灭动力学曲线Fig.1 Fluorescence quenching dynamic curve of Trolox
由图1可知,随着Trolox浓度的增加荧光淬灭的时间逐渐延长,到达荧光衰减呈基线的时间从无Trolox时的20min增加到Trolox浓度为100μmol/L的50min。荧光动力学曲线下面的面积随着Trolox浓度的增大而逐渐增大,Trolox浓度与荧光动力学曲线下面的保护面积netAUC值之间的线性方程为y= 55385.8258x+1217801.2500(R2=0.9924)。
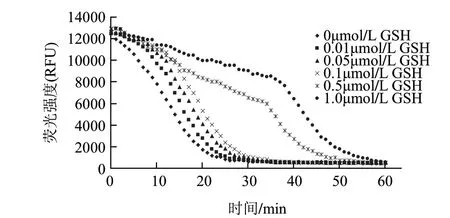
图 2 不同浓度的GSH荧光淬灭动力学曲线Fig.2 Fluorescence quenching dynamic curve of GSH
由图2可知,随着GSH浓度的增加荧光淬灭的时间逐渐延长,荧光动力学曲线下面的面积随着GSH浓度的增大而逐渐增大,GSH浓度与荧光动力学曲线下面的保护面积netAUC值之间的线性方程为y=3384025.6367x+ 2156577.4886(R2=0.9961)。
2.2 黑豆蛋白单酶与多酶组合水解产物的氧自由基清除能力比较
由表1可知,在单酶最适水解条件下,Alcalase、Neutrase和Flavourzyme单酶水解180min后黑豆蛋白的水解度均基本不再增加,且酶解物的ORAC值(Trolox当量和GSH当量)均达到最大值,原因可能是在水解度较高时形成的水解产物会抑制反应的进行,而抗氧化活性与水解度在一定范围内呈正相关关系。但在单酶水解度趋于最大时,黑豆蛋白Alcalase碱性蛋白酶水解产物的抗氧化活性最强,Neutrase中性蛋白酶水解物次之,Flavourzyme风味蛋白酶水解物较差,说明不同蛋白酶具有不同的水解特异性。多酶组合水解采用以Alcalase碱性蛋白酶和Neutrase中性蛋白酶为主、辅以Flavourzyme风味蛋白酶短时间水解的组合3、组合4两种组合方式的黑豆蛋白水解物的ORAC值均高于Alcalase单酶水解物,且达到水解度基本接近的水解时间从单酶水解的3h缩短为2h,说明通过合理的多酶组合水解方式可以提高酶解速率并改善水解液的抗氧化活性。采用Flavourzyme较长时间酶解与Alcalase碱性蛋白酶短时间水解组合方式2的黑豆蛋白水解物的ORAC值最低,可能是Flavourzyme风味蛋白酶含有内切蛋白酶和外切肽酶两种活性,酶水解物中抗氧化性较弱的游离氨基酸比例增加所致。采用Neutrase中性蛋白酶和Alcalase碱性蛋白酶组合水解方式1的黑豆蛋白水解物ORAC值较低,可能与Neutrase中性蛋白酶的蛋白水解能力相对较弱,酶水解物的水解度较低有关。组合4的抗氧化活性高于组合3,原因可能是先采用含有内切蛋白酶和外切肽酶两种活性的Flavourzyme水解,有利于增加后续Neutrase中性蛋白酶的水解作用位点,最终水解物的水解度相对较高。结果表明,组合4(Alcalase 30min+Flavourzyme 30min+Neutrase 60min)水解的黑豆蛋白水解物具有最高的氧自由基清除能力,因而选定该多酶组合酶解产物进行后续抗氧化黑豆肽的超滤与大孔树脂吸附分离纯化。
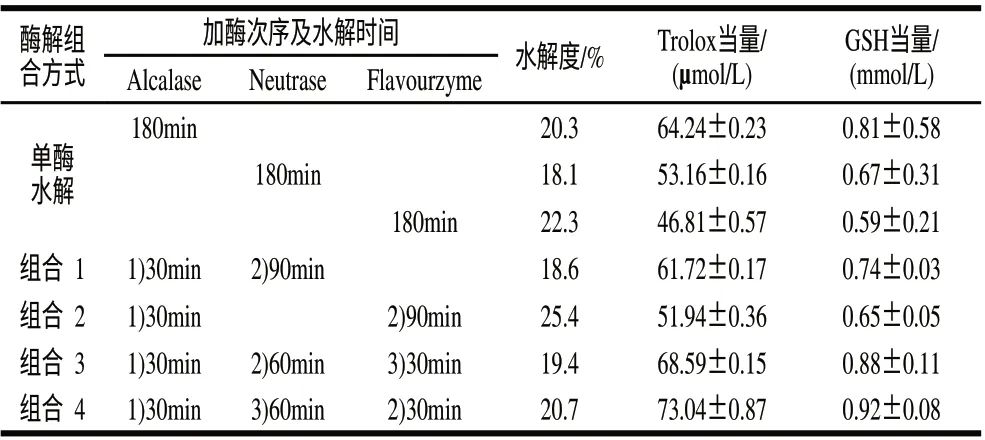
表 1 黑豆蛋白单酶与多酶组合分步水解结果Table 1 Effect of three proteases, alone or in combination, on degree of hydrolysis and ORAC
2.3 黑豆肽的超滤分离及其氧自由基清除能力
采用(Alcalase 30min+Flavourzyme 30min+Neutrase 60min)多酶组合方式水解黑豆蛋白,经冷冻干燥得到黑豆肽粉(BSP),按国家标准GB/T 22492—2008《大豆肽粉》规定的肽含量的测定方法测得其肽含量为80.3%(干基)。分别用截留相对分子质量为3000、5000和10000的超滤膜对黑豆肽水溶液分离,收集各超滤组分,冻干后用pH7.4的磷酸盐缓冲液配制成质量浓度为1mg/mL的肽溶液,测定其ORAC值,黑豆肽BSP及其超滤分离组分的Trolox当量和GSH当量比较见表2。结果表明,相对分子质量较小的黑豆肽组分具有较强的氧自由基清除能力,BSP-UF-Ⅳ超滤组分的Trolox当量值为104.59μmol/L、GSH当量值为1.43mmol/L,Trolox当量和GSH当量分别比超滤前提高了43.2%和55.4%,文献[19]报道认为大多数抗氧化肽的相对分子质量小于3000,因而基于该组分进行后续大孔树脂吸附分离纯化。
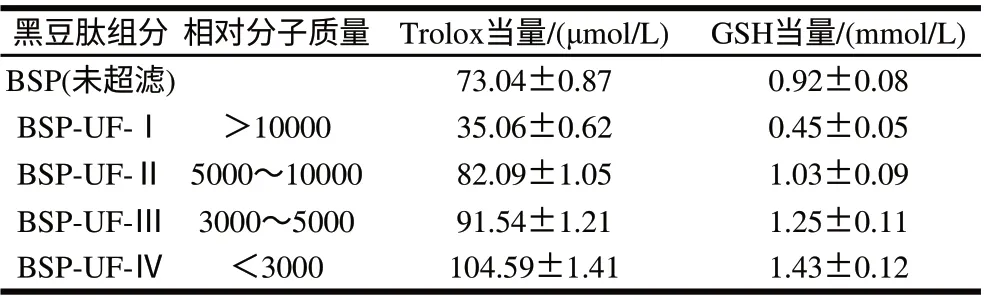
表 2 黑豆肽超滤分离组分的氧自由基清除能力Table 2 ORAC of the fractions purificated by ultrafiltration
2.3 黑豆肽的大孔树脂吸附分离及其氧自由基清除能力
2.3.1 不同大孔吸附树脂对黑豆肽的静态吸附与解吸性能比较
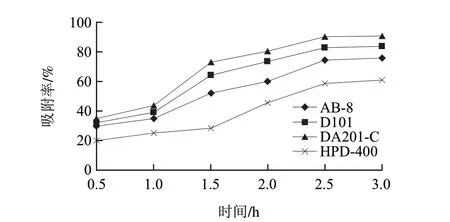
图 3 不同大孔树脂对黑豆肽的静态吸附曲线Fig.3 Static adsorption curves of different types of macroporous resin
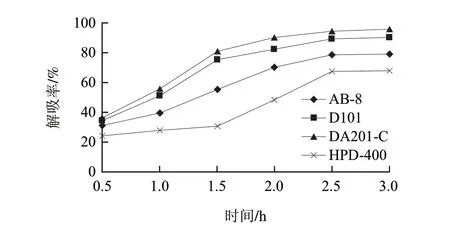
图 4 不同大孔树脂对黑豆肽的静态解吸曲线Fig.4 Static desorption curves of different types of macroporous resin
由图3、4可知,前2h吸附率和解吸率均增加较快,2.5h后吸附率和解吸率都趋于平衡。DA201-C的吸附率和解吸率均大于其他树脂,D101的吸附率和解吸率与DA201-C比较接近,其次为AB-8,而HPD400的吸附率和解吸率都较低。DA201-C和D101都是非极性树脂,AB-8为弱极性树脂,HPD400为中极性树脂,据此推测非极性树脂可能更适合于肽类物质的吸附分离。DA201-C和D101的平均孔径分别为3~5、9~10nm,DA201-C的比表面积约是D101的2倍,对小分子多肽有较多的吸附位点,有利于提高吸附和解吸效率,因此选择DA201-C作为抗氧化黑豆肽分离纯化实验用树脂,这一结果与李勇等[20]的研究报道一致。
2.3.2 DA201-C大孔树脂吸附黑豆肽的乙醇分级洗脱及其氧自由基清除能力
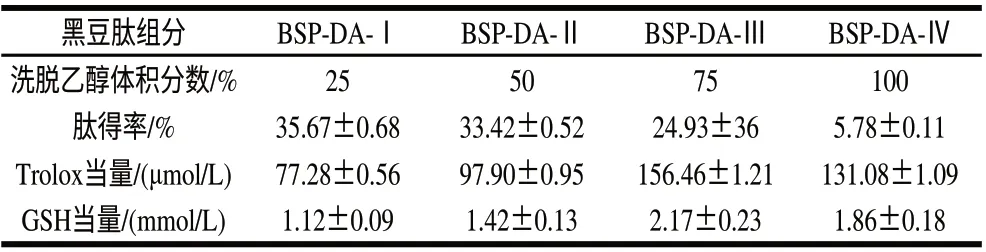
表 3 不同体积分数乙醇洗脱组分的得率和氧自由基清除能力Table 3 Peptide yield and ORAC of each fraction eluted by different concentrations of ethanol
由表3可知,体积分数为25%及50%乙醇洗脱的黑豆肽组分占69%,氧自由基清除能力较低;体积分数为75%及100%乙醇洗脱的黑豆肽组分占31%,氧自由基清除能力较高,而75%乙醇洗脱组分BSP-DA-Ⅲ的ORAC值最高,其Trolox当量和GSH当量分别比吸附分离前提高了49.6%和51.7%,表明大孔树脂吸附、乙醇分级洗脱对抗氧化黑豆肽具有较好的分离纯化效果。
2.4 大孔树脂吸附乙醇洗脱分离纯化抗氧化黑豆肽的氨基酸组成分析
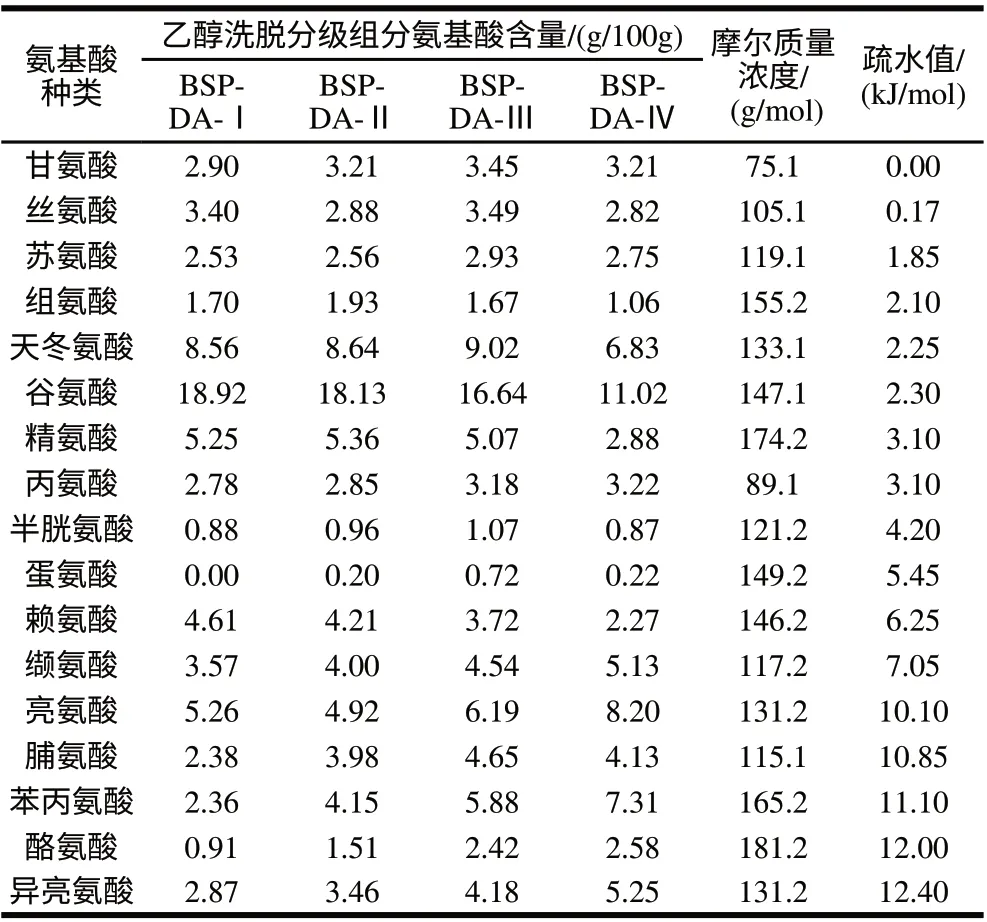
表 4 黑豆肽乙醇洗脱分级组分的氨基酸组成与疏水性值Table 4 Amino acid composition and hydrophobicity of each fraction eluted by different concentrations of ethanol
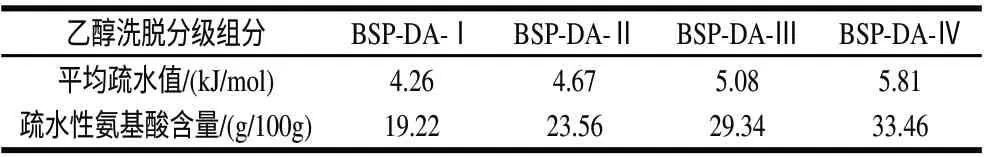
表 5 黑豆肽乙醇洗脱分级组分的平均疏水性值与疏水性氨基酸含量Table 5 Average hydrophobic value and hydrophobic amino acid content of each fraction eluted by ethanol with different concentrations
由表4、5可知,随着乙醇体积分数增大,洗脱组分的平均疏水性值和疏水性氨基酸含量呈明显增大趋势,该结果与张晓梅等[16]的相关研究报道一致,表明DA201-C型大孔吸附树脂可以根据疏水性大小通过不同体积分数乙醇的分级洗脱对肽段进行分离。
由表3、5可知,黑豆肽的抗氧化活性与肽段的疏水性有一定关系,随着疏水性的增加,对氧自由基的清除能力总体呈增强趋势,表明肽链中疏水性非极性氨基酸与肽段的抗氧化活性具有较强的关联性,75%和100%乙醇洗脱组分含有较高的酪氨酸,它具有酚羟基结构,能提供质子从而猝灭自由基,表现出较强的抗氧化能力,这与文献[22-24]的研究结果一致。另有研究报道[25]认为碱性氨基酸对多肽抗氧化活性的贡献大于酸性氨基酸,因为碱性氨基酸侧链很容易被氧自由基攻击氧化而生成羰基衍生物,可充当清除氧自由基的角色,达到抗氧化的效果;75%乙醇洗脱组分BSP-DA-Ⅲ的赖氨酸、精氨酸、组氨酸等碱性氨基酸含量(10.46g/100g)远大于100%乙醇洗脱组分BSP-DA-Ⅳ(6.21g/100g),因而BSP-DA-Ⅲ具有相对最强的氧自由基清除能力。
2.5 黑豆肽氧自由基清除能力Trolox当量与GSH当量的相关性分析
对黑豆肽BSP及其超滤组分BSP-UF-Ⅰ、BSPUF-Ⅱ、BSP-UF-Ⅲ、BSP-UF-Ⅳ和大孔树脂分离组分BSPDA-Ⅰ、BSP-DA-Ⅱ、BSP-DA-Ⅲ、BSP-DA-Ⅳ的ORAC值Trolox当量与GSH当量值进行相关性分析,其相关系数r=0.9933,根据其自由度n-2=7,从统计检验临界r值表查得r0.01=0.798,故r=0.9933>0.798,表明黑豆肽的Trolox当量值与GSH当量值呈极显著的正相关关系(P<0.01),即用ORAC法GSH当量值与Trolox当量值评价黑豆肽的氧自由基清除能力具有一致性,本研究的抗氧化活性物质是多肽,用还原型谷胱甘肽当量表达其氧自由基清除能力,能较好地反映黑豆肽在抗氧化活性肽类物质开发中的应用价值。
3 结 论
采用单酶水解与多酶组合分阶段水解工艺制备抗氧化黑豆肽,结果表明通过合理的多酶组合水解方式可以缩短水解时间并提高水解液的抗氧化活性,采用(Alcalase 30min+Flavourzyme 30min+Neutrase 60min)三酶组合水解2h与Alcalase单酶水解3h的水解度基本接近,与单酶水解抗氧化最强的Alcalase酶解物和其他多酶水解组合相比较,具有相对较强的氧自由基清除能力。对该最佳多酶组合水解物进行超滤分离,相对分子质量<3000的黑豆肽超滤组分的抗氧化活性较强,以不同体积分数乙醇对充分吸附相对分子质量<3000黑豆肽超滤组分的DA201-C大孔树脂进行洗脱,可以根据氨基酸组成的疏水性值对抗氧化肽段进行有效分离,体积分数为75%乙醇洗脱的黑豆肽组分具有较强的氧自由基清除能力,表明采用大孔树脂吸附、乙醇梯度洗脱是分离抗氧化活性肽的一种有效方法。75%乙醇洗脱分离的黑豆肽组分中非极性疏水性氨基酸、碱性氨基酸的含量较高,说明黑豆肽的抗氧化活性与其氨基酸组成侧链基团性质有高度的关联性。ORAC法测定黑豆肽氧自由基清除能力的GSH当量值与Trolox当量值呈极显著的正相关关系(P<0.01),GSH当量值能直观反映黑豆肽在抗氧化肽类物质中的地位,Trolox当量值则便于和其他类型的抗氧化活性物质进行比较。
[1] 黎观红, 晏向华. 食物蛋白源生物活性肽: 基础与应用[M]. 北京: 化学工业出版社, 2010.
[2] GILL I, LOPEZ-FANDINO R, JORBA X, et al. Biologically active peptides and enzymatic approaches to their production[J]. Enzyme Microb Technol, 1996, 18: 162-183.
[3] YAMAMOTO N, EJIRI M, MIZUNO S. Biogenic peptides and their potential use[J]. Curt Pharma Design, 2003, 9(16): 1345-1355.
[4] 张瑞芬, 池建伟, 丘银清, 等. 黑大豆的营养及保健功能研究进展[J]. 广东农业科学, 2006(11): 13-16.
[5] 刘恩岐, 贺菊萍, 陈振家, 等. 黑豆蛋白质酶水解物体外抗氧化活性的研究[J]. 中国粮油学报, 2009, 24(11): 38-41.
[6] 赵利, 钱芳, 许建军, 等. 大孔吸附树脂及其在蛋白质、多肽和氨基酸分离纯化中的应用[J]. 四川食品与发酵, 2003(2): 39-41.
[7] 宋立霞, 王向社, 吴紫云, 等. 氧自由基吸收能力测定方法的研究进展[J]. 食品研究与开发, 2008, 29(12): 166-170.
[8] PRIOR R L, WU X, SCHAICH K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J]. J Agric Food Chem, 2005, 53: 4290-4302.
[9] PRIOR R L, HOANG H, GU L, et al. Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity (ORACF)) of plasma and other biological and food samples[J]. J Agric Food Chem, 2003, 51: 3273-3279.
[10] 曹亚兰, 赵谋明, 郑赛晶, 等. 以ORAC 法为评价指标优化制备大豆抗氧化肽[J]. 食品与发酵工业, 2011, 37(10): 73-77.
[11] BLANCA H L, LOURDES A, ISIDRA R, et al. ACE-inhibitory and radical-scavenging activity of peptides derived from β-lactoglobulin[J]. J Agric Food Chem, 2007, 55: 3392-3397.
[12] 赵新淮, 冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学, 1994, 15(11): 65-67.
[13] 王玲琴, 王志耕, 方玉明, 等. 双酶法制备大豆降胆固醇活性肽的研究[J]. 大豆科学, 2010, 29(1): 109-112.
[14] 任娇艳, 赵谋明, 崔春, 等. 草鱼蛋白源抗氧化肽的分离及鉴定[J]. 食品科学, 2009, 30(13): 13-17.
[15] 钟芳, 张晓梅, 麻建国. 大豆肽的大孔吸附树脂以及凝胶过滤色谱分离[J]. 食品与机械, 2006, 22(4): 25-28.
[16] 张晓梅, 钟芳, 麻建国. 大豆降胆固醇活性肽的初步分离纯化[J]. 食品与机械, 2006, 22(2): 33-36.
[17] 任建东. 酶解鹿茸血疏水性肽的分离及活性研究[D]. 无锡: 江南大学, 2008.
[18] 王钦德, 杨坚. 食品试验设计与统计分析[M]. 北京: 中国农业大学, 2003.
[19] 沈勇根, 徐明生, 尹忠平, 等. 卵白蛋白抗氧化肽分离与纯化[J]. 中国食品学报, 2011, 11(8): 16-22.
[20] 李勇, 黄先智, 阚建全, 等. 大孔树脂吸附分离蚕蛹ACE抑制肽的研究[J]. 食品工业科技, 2012, 33(16): 281-284.
[21] KWON D Y, OH S W, LEE J S, et al. Amino acid substitution of hypocholesterolemic peptide originated from glycinin hydrolysate[J]. Food Sci Biotechnol, 2002, 11: 55-61.
[22] CHEN H M, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from soybean 13-conglycinin[J]. Journal of Agriculture and Food Chemistry, 1995, 43: 574-578.
[23] SAIGA A, TANABE S, NISHIMURA T. Antioxidant activity of peptides obtained fromporcine myofibrillar proteins by protease treatment[J]. J Agric Food Chem, 2003, 51: 3661-3667.
[24] RAJAPAKSE N, MENDIS E, JUNG W, et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38: 175-182.
[25] AMICI A, LEVINE R L, TSAI L, et al. Conversion of amino acid residues in proteins and amino acid homopolymers to carbonyl derivatives by metal-catalyzed oxidation reactions[J]. J Biol Chem, 1989, 264: 3341-3346.
