黑曲霉H1-9b发酵产葡萄糖氧化酶的工艺优化
2013-08-07唐云明
唐 菁,赵 芯,苏 茉,唐云明*
(西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆 400715)
葡萄糖氧化酶(glucose oxidase,GOD)是一种需氧脱氢酶,它能利用分子氧作为电子受体,专一催化β-D-葡萄糖氧化成葡萄糖酸和过氧化氢[1]。这种酶广泛应用于工业、食品加工、酿酒[2]及医药卫生行业[3-5]。葡萄糖氧化酶在工业生产中多以黑曲霉(Aspergillus niger)、点青霉 (Penicilliun notatun)等微生物为主要来源[6]。表面活性剂具有乳化和分散的作用,在发酵过程中可以改善气液表面的状态以及发酵液流动性的功能,也具有改变细胞膜通透性的功能。本实验筛选获得一株葡萄糖氧化酶的高产菌株,黑曲霉H1-9b(20U/mL),与Petruccioli等[7]研究得出的5.49U/mL和Khattab等[8]测得的最大酶活力15.9U/mL相比,该菌株在产酶能力上有较大优势。本实验以黑曲霉H1-9b为出发菌株,采用单因素和正交设计优化发酵条件,并通过向培养基中添加表面活性剂,提高单位体积发酵液的葡萄糖氧化酶产量,以期为工业化生产提供一定的参考。
1 材料与方法
1.1 菌种
菌种为本实验室分离保藏的菌株黑曲霉H1-9b[9]。
1.2 培养基
斜面培养基:察氏(Czapek)培养基[10];发酵培养基:采用本实验室优化后的培养基,即含葡萄糖80g/L、蛋白胨2g/L、NaNO35g/L、KH2PO40.7g/L、KCl 0.5g/L、MgSO4·7H2O 0.6g/L,pH值自然。
1.3 方法
1.3.1 培养
活化培养:挑1环孢子接种于斜面培养基上,28℃培养箱中培养96h。
孢子悬液制备:取活化的斜面培养的1支,加入无菌水洗下孢子,制成孢子悬液,采用血细胞计数法调整孢子浓度为106个/mL。
发酵培养:250mL的三角瓶中装入50mL的发酵培养基,于28℃摇床上200r/min振荡培养78h。
1.3.2 粗酶液制备
1.3.2.1 菌丝体粗酶液制备
摇床发酵培养完成后,用纱布过滤发酵液,收集球状菌丝体,用双蒸水将其反复冲洗,直至把发酵液冲洗干净;再用0.2mol/L pH5.7的磷酸缓冲液冲洗菌丝体,压干水分,称质量。将菌丝体置于研钵中,加入适量石英砂,对菌体进行研磨;充分研磨后按1:1(m/V)加入预冷的0.05mol/L pH5.7的磷酸缓冲液浸酶,4℃抽提2h。抽提完成后在4℃、12000r/min的条件下离心20min,取上清,于4℃保存。
1.3.2.2 发酵液粗酶液制备
发酵液先用两层纱布过滤,滤液冷冻离心,条件为4℃、10000r/min离心15min,取上清,于4℃保存。
1.3.3 酶活力测定参照文献[4,11]的方法并加以改进,取适当稀释后酶液50μL,加入2.0mL 0.1mol/L pH5.7的磷酸缓冲溶液、0.3mL 10%葡萄糖溶液、50μL 16mmol/L 4-氨基安替吡啉、50μL 7.5mmol/L苯酚、50μL 1000U/mL的过氧化物酶,在37℃条件下,准确反应4min,再置于沸水浴中快速灭活4min,冷却至室温,在500nm波长处测定其吸光度;用预先灭活的酶液作空白对照,其他处理条件相同。酶活力单位(U)定义为:每分钟消耗1μmol葡萄糖所需要的酶量为1个活力单位。
1.3.4 蛋白质的含量
采用紫外分光光度法[12]测定蛋白质含量。
1.3.5 菌体干质量测定[13]
将经两层纱布过滤后的菌丝体,用蒸馏水冲洗2次,于55℃烘箱中干燥至质量恒定后称质量。
1.3.6 不同发酵条件对产酶的影响[14]
1.3.6.1 转速对产酶的影响
以发酵培养基为基础,装液量为250mL三角瓶中发酵液50mL,接种200μL孢子悬液,摇床转速设定为1~4组,分别为150、200、250、300r/min,28℃振荡培养78h。每组处理设3个重复。
1.3.6.2 初始pH值对产酶的影响
用0.1mol/L的HCl溶液和0.1mol/L的NaOH溶液调节,使发酵液初始pH值为3~8,0.5为1个pH值间隔,各组pH值重复3次。摇床转速为250r/min,28℃振荡培养78h。
1.3.6.3 接种量对产酶的影响
以发酵培养基为基础,接种量设定为10、50、100、150、200、250、300μL孢子悬液,每组水平重复3次。初始pH4.5,装液量为250mL三角瓶中发酵液50mL,摇床转速为250r/min,28℃振荡培养78h。
1.3.6.4 装液量对产酶的影响
设定250mL三角瓶中所含的发酵液为20、40、50、60、80、100、120、140mL,每组水平重复3次。接种量为250μL孢子悬液,摇床转速为250r/min,28℃振荡培养78h。
1.3.6.5 表面活性剂对产酶的影响
向基础发酵培养基中分别添加0.5%的吐温-20、吐温-80和Triton X-100来考察表面活性剂种类对产酶的影响。摇床转速为250r/min,28℃振荡培养78h。
1.4 数据处理
采用SPSS 11.5软件进行数据处理,参考文献[15]的方法。
2 结果与分析
2.1 发酵条件的优化研究
2.1.1 转速对产酶的影响
黑曲霉为专性好氧菌,孢子的萌发、菌体的繁殖和酶的合成都需要氧气。三角瓶中的发酵液在摇床上振荡,产生气液的混合和分散,使空气中的氧有效地溶解。因此,摇床转数影响菌体的生产和酶的产量。由图1可知,最适转速为200r/min。若转速低于200r/min,由于通氧差,产酶量降低;随着转速的增加,剪切力增大而影响菌体生长,产酶量也随之下降。
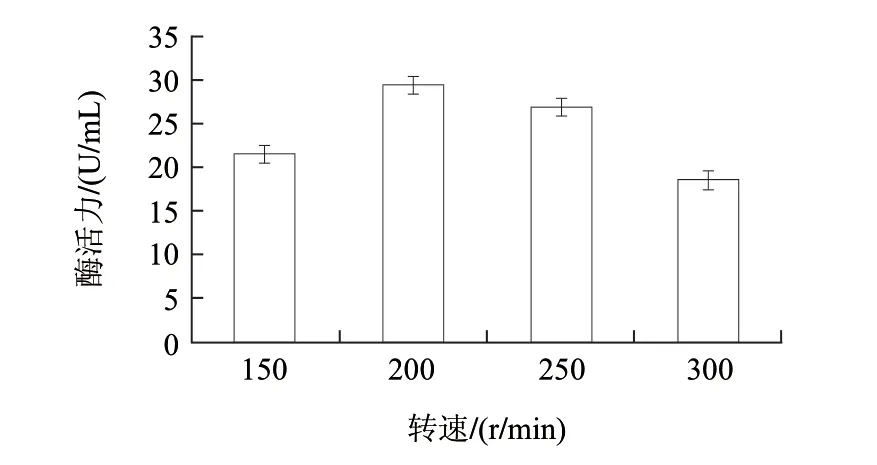
图 1 转速对产酶的影响Fig.1 Effect of rotation speed on glucose oxidase production
2.1.2 初始pH值对产酶的影响
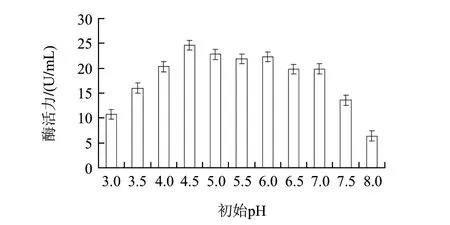
图 2 初始pH值对产酶的影响Fig.2 Effect of initial pH on glucose oxidase production
初始pH值会影响菌的代谢途径和生长速率[16],从而影响菌的生长和酶的合成。黑曲霉在pH1.5~9.0的范围内都能生长[17]。由图2可知,黑曲霉H1-9b在初始pH值为3~8的范围内都能生长,最适pH值为4.5。当初始pH>7时,黑曲霉H1-9b基本贴壁生长;当初始pH<4.5时,这由于菌代谢产酸,进一步降低发酵液pH值,影响跨膜pH值梯度,引起菌体膜渗透性的变化,从而影响菌对养分的吸收和代谢产物的分泌,导致产酶量不高。
2.1.3 接种量对产酶的影响
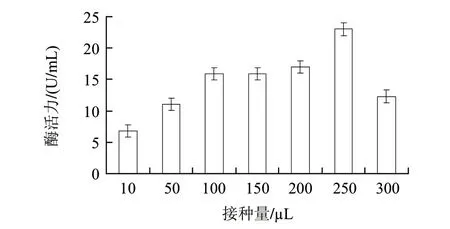
图 3 接种量对产酶的影响Fig.3 Effect of inoculum amount on glucose oxidase production
接种量影响菌生长达到高峰的时间,从而影响产物的合成。由图3可知,接种量为250μL时,其酶活力最高。接种量<100μL时产酶量较低,可能原因是菌丝体生长过慢,需要较长的发酵时间才能达到最大菌丝生物量,从而影响了产酶量;接种量>250μL时,产酶量也随之降低,可能是由于菌体生长过快,发酵液黏度增加,导致溶氧不足,影响葡萄糖氧化酶的合成。
2.1.4 装液量对产酶的影响
装液量的多少直接影响溶氧水平,从而影响菌生长和产酶。由图4可知,当装液量为80、100、120mL时,酶活力较高。当装液量为140mL时,酶活力降低,这主要是因为随着装液量的增加,体积溶氧系数降低,导致黑曲霉生长所必需的氧供应不足,从而导致产酶量降低。
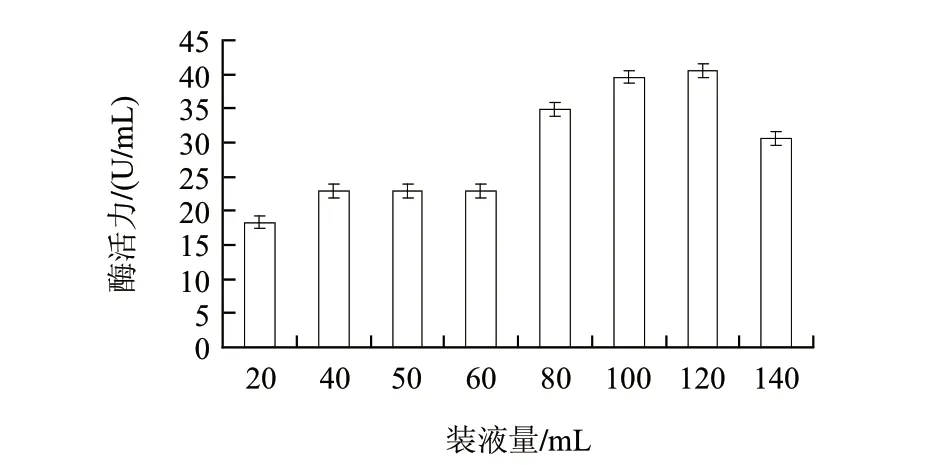
图 4 装液量对产酶的影响Fig.4 Effect of broth amount on glucose oxidase production
2.1.5 正交试验[18]优化发酵工艺
选用L9(34)设计正交试验,对接种量、装液量、初始pH值以及转速这4个因素进行优化,见表1,初始pH值是影响摇瓶发酵生产葡萄糖氧化酶的最主要因素,而影响摇瓶发酵的最小因素为接种量。A1B2C2D1为最佳组合,即转速200r/min、初始pH5.3、接种量200μL孢子悬液、装液量80mL。
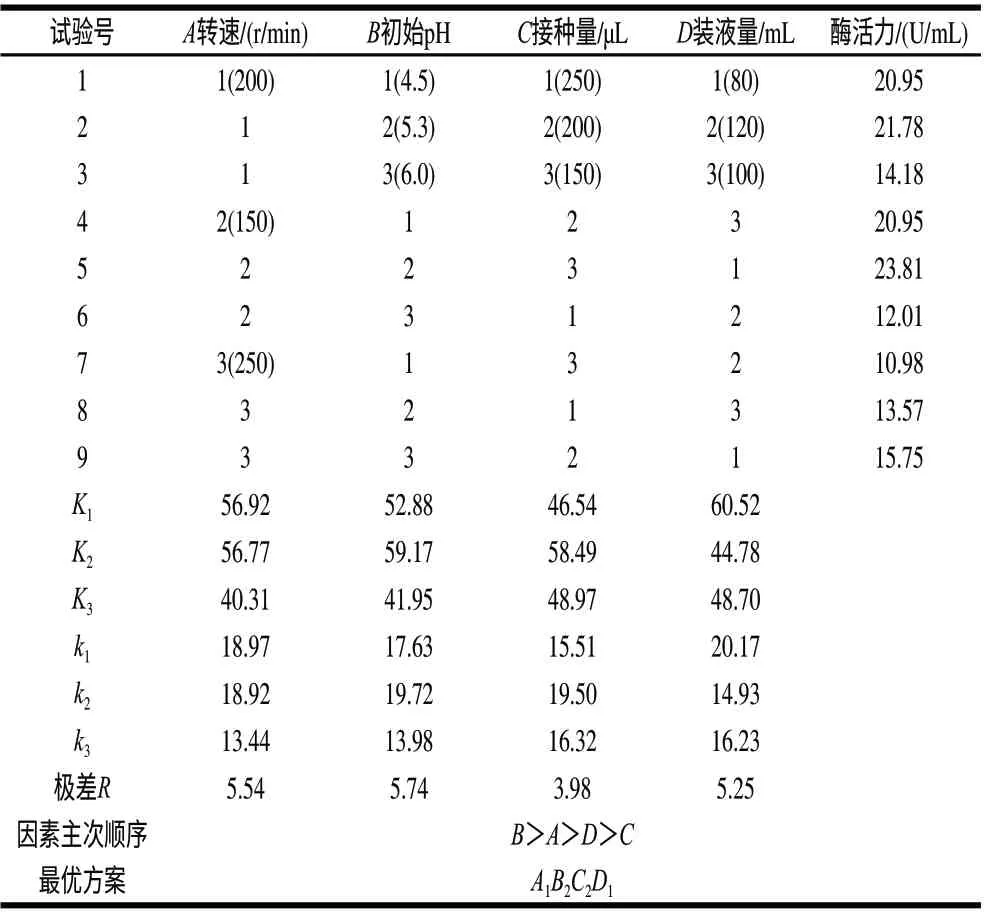
表 1 正交试验设计及结果Table 1 Design and results of orthogonal tests
2.2 表面活性剂对产酶的影响
2.2.1 表面活性剂种类对产酶的影响
表面活性剂一方面具有改善细胞膜通透性,减少氧及营养物质进入细胞的传递阻力,加快物质传递运输的能力;另一方面对微生物有毒性和杀菌作用[19]。黑曲霉H1-9b产的葡萄糖氧化酶为胞内酶,考虑通过添加表面活性剂促使酶释放,从而提高发酵液中葡萄糖氧化酶的含量,达到提高总酶活力的目的。由图5可知,3种表面活性剂对产酶都有促进作用,其中吐温-80对产酶的促进作用最强。因此选用吐温-80作进一步研究。
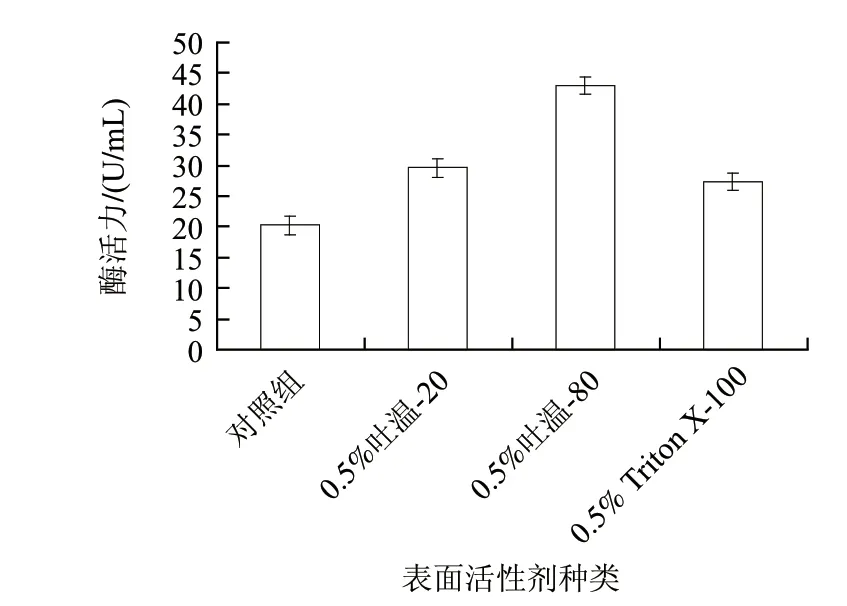
图 5 表面活性剂对产酶的影响Fig.5 Effect of surfactant type on glucose oxidase production
2.2.2 吐温-80添加量对产酶的影响
由图6可知,吐温-80添加量为0时,酶活力为28.60U/mL;随着吐温-80添加量的增高,产酶的促进效果也增强;当添加量为3%时,酶活力达到68.96U/mL,约提高了1.4倍。可能原因是添加量达到3%之前,细胞膜和细胞壁的通透性随着添加量的增高而逐渐增大,在3%附近,菌体产酶达到最大值。添加量继续增大,过大的细胞膜和细胞壁通透性会影响菌体细胞的正常生命活动。因此,选择吐温-80添加量为3%。
2.3 发酵时间对产酶的影响
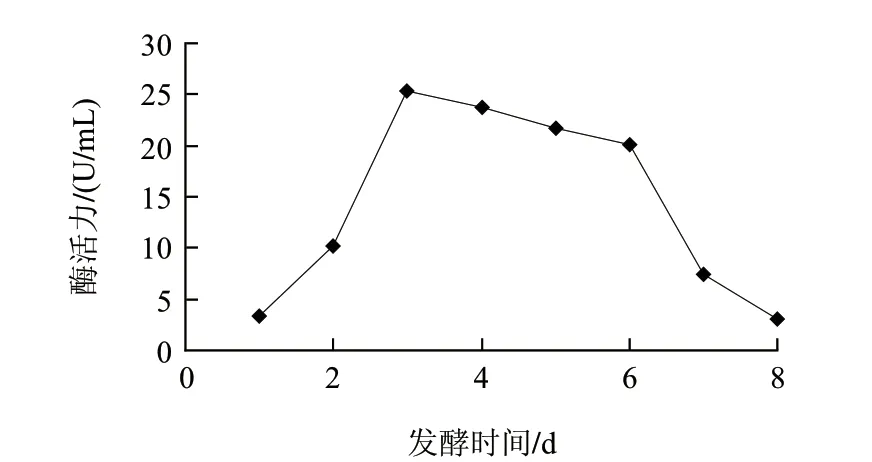
图 7 黑曲霉H1-9b的产酶曲线Fig.7 Production curve of glucose oxidase
由图7可知,黑曲霉H1-9b在培养3d时,达到产酶高峰,之后酶活力缓慢下降,因此发酵时间应为3d左右。
3 讨 论
影响黑曲霉产葡萄糖氧化酶的因素很多,在液体发酵状态下培养基的组成、发酵条件等都是重要因素。本实验室已经研究不同发酵培养基对黑曲霉H1-9b的产酶影响(未发表);在此基础上,本研究对发酵条件进行了正交试验优化;之后向培养基添加3%吐温-80以提高葡萄糖氧化酶产量。优化后的发酵条件为:接种量200μL孢子悬液、装液量80mL、初始pH5.3、转速200r/min。这时所获得的葡萄糖氧化酶总酶活力最高可达28.60U/mL;当在培养基中添加3%吐温-80后,酶活力提高到68.96U/mL,是未添加吐温-80发酵产酶量28.60U/mL的2.4倍,是文献[8]报道的4倍。通过发酵动力学曲线得知,黑曲霉H1-9b的发酵时间应为3d左右。
本研究通过添加表面活性剂吐温-80[20]的方法,显著提高了酶产量。这对小规模发酵生产更多的酶有一定的参考价值。使用吐温-80具有以下优点:属于非离子表面活性剂,对菌体的毒性最小;是水溶性长链脂肪酸的酯类物质,可影响微生物细胞的膜通透性[20]及发酵液的乳化性和分散性,使葡萄糖氧化酶释放到发酵液中;分泌到胞外的葡萄糖氧化酶更适合于工业化大生产和获得高纯度样品,因为胞外酶收集方便,发酵液中蛋白质种类较细胞内部少,从而可以降低后续纯化难度,故可考虑将此方法应用于小规模工业化生产,同时也为今后研究大规模发酵生产工艺提供一定的参考。
[1] HATZINIKOLAOU D G, HANSEN O C, MACRIS B J, et al. A new glucose oxidase from Aspergillus niger: characterization and regulation studies of enzyme and gene[J]. Appl Microbiol Biotechnol, 1996, 46: 371-381.
[2] PICKERING G J. Optimising glucose conversion in the production of reduced alcohol wine using glucose oxidase[J]. Food Research International, 1998, 31(10): 685-692.
[3] SANDIP B B, MAHESH V B, REKHA S S, et al. Glucose oxidase: an overview[J]. Biotechnology Advances, 2009, 27(4): 489-501.
[4] GROMADA A, FIEDUREK J. Selective isolation of Aspergillus niger mutants with enhanced glucose oxidase production[J]. Journal of Applied Microbiology, 1997, 82(5): 648-652.
[5] BANKAR S B, BULE M V, SINGHAL R S, et al. Glucose oxidase: an overview[J]. Biotechnology Advances, 2009, 27(4): 489-501.
[6] FOGARTY W M. Microbial enzymes and biotechnology[M]. London: Applied Science Publishers, 1983: 111-123.
[7] PETRUCCIOLI M, CECCARELLI M, FEDERICI F. Screening of Penicillium species for the production of extracellular glucose oxidase[J]. Springer Netherlands, 1993, 9(1): 77-79.
[8] KHATTAB A A, BAZARAA W A. Screening, mutagenesis and protoplast fusion of Aspergillus niger for the enhancement of extracellular glucose oxidase production[J]. Journal of Industrial Microbiology and Biotechnology, 2005, 32(7): 289-294.
[9] 苏茉, 高亚鹏, 梁建荣, 等. 黑曲霉H1-9b葡萄糖氧化酶的分离纯化及性质研究[J]. 食品科学, 2011, 32(3): 181-185.
[10] 刘峰, 黄鹭强, 林颖, 等. 从土壤中快速筛选葡萄糖氧化酶产生菌及发酵工艺的优化[J]. 生物技术, 2007, 17(3): 64-68.
[11] 张茜, 傅婉辉, 康劲翔, 等. 青霉葡萄糖氧化酶的分离纯化及性质研究[J]. 厦门大学学报: 自然科学版, 2009, 48(1): 100-102.
[12] LAYNE E. Spectrophotometic and turbidimetric methods for measuring proteins[M]//COLEEICK S P, KAPLAW N O. Methods in enzymology. Vol. Ⅲ. New York: Academic Press, 1957: 447-454.
[13] 诸葛健, 李华钟. 微生物学[M]. 2版. 北京: 科学出版社, 2009: 124-221.
[14] 张婷. Aspergillius niger Z-25产葡萄糖氧化酶发酵条件优化及酶的分离纯化研究[D]. 南京: 南京农业大学, 2008.
[15] 郝拉娣, 张娴, 刘琳. 科技论文中正交试验结果分析方法的所有[J]. 编辑学报, 2007, 19(5): 340-341.
[16] 杨斌, 李彤森, 柳成益, 等. 摇床速度、初始接种量和pH值对粉拟青霉生长的影响[J]. 云南大学学报: 自然科学版, 2005, 27(3): 267-271.
[17] 岑沛霖, 蔡谨. 工业微生物学基础[M]. 北京: 化学工业出版社, 2000.
[18] 李云雁, 胡传荣. 试验设计与数据处理[M]. 2版. 北京: 化学工业出版社, 2008: 231.
[19] 陈荣圻. 表面活性剂化学及应用[M]. 北京: 纺织工业出版社, 1990: 41.
[20] REESE E T, MAGUIRE A. Surfactants as stimulants of enzyme production by microorganisms[J]. Appl Microbiol, 1969, 17: 242-245.
