重组毕赤酵母葡萄糖氧化酶的纯化和性质
2013-08-07郝杰清王帅坤王振伟孟延发
郝杰清,王帅坤,师 慧,王振伟,孟延发*
(四川大学生命科学学院,生物资源与生态环境教育部重点实验室,四川 成都 610064)
葡萄糖氧化酶(glucose oxidase,GOD,EC 1.1.3.4)是一种需氧脱氢酶,能够在有氧条件下高度专一性的将β-D-葡萄糖氧化成葡萄糖酸和过氧化氢[1]。它广泛分布于动物、植物和微生物体内。葡萄糖氧化酶在食品工业、医疗诊断、生物传感器方面有着广泛的应用[2-4]。目前应用于工业生产中的主要是青霉属和黑曲霉两种[5-6]。但这两种菌在发酵生产过程中会产生大量的杂蛋白,较难纯化。甲醇毕赤酵母是一类新的真核表达系统,它具有真核表达系统所共有的优点,而且表达产物分泌至胞外,杂蛋白少,易于纯化[7-8]。本研究在已有重组毕赤酵母葡萄糖氧化酶基础上,对其进行分离纯化并对酶学性质进行研究,以期为其在食品工业和医药生产上的应用提供依据。
1 材料与方法
1.1 材料
1.1.1 菌种与培养基
重组Pichia pastoris GS115是用黑曲霉的葡萄糖氧化酶基因构建的基因工程酵母菌,由本实验室保存。
种子培养基(g/L):蛋白胨20、酵母膏10、葡萄糖20,自然pH值。发酵培养基(g/L):蛋白胨20、酵母膏10,溶于100mmol/L pH6.0的磷酸钾缓冲液中。均于121℃灭菌30min。
1.1.2 试剂与仪器
酵母膏、蛋白胨 英国Oxoid公司;过氧化物酶(POD) 日本Toyobo公司;牛血清白蛋白(BSA)、4-吗啉乙磺酸(MES) 美国Sigma公司;4-氨基安替比林(4-AA) 上海灵锦精细化工有限公司;EHSPT 上海阿拉丁试剂有限公司;Q-Sepharose Fast Flow 美国Pharmacia公司;葡萄糖、无水甲醇等为国产分析纯。
5804R冷冻高速离心机 德国Eppendorf公司;UV-2102紫外-可见分光光度计 美国Unico公司;Mini Ⅱ型电泳仪 美国Bio-Rad公司;Pellicon Biomax超滤器 美国Millipore公司;HD-2000紫外检测仪 上海嘉鹏科技有限公司。
1.2 方法
1.2.1 粗酶液的制备
将在斜面培养基上(30℃)培养48h的毕赤酵母接入种子培养基中,30℃、200r/min振荡培养24h至OD600nm约为2~6,种子液以5%的接种量接入300mL发酵培养基中,相同条件振荡培养24h,以体积分数0.5%加入甲醇开始诱导,温度调整为25℃,每24h后加入等量的甲醇连续诱导10d。将发酵液在4℃、10000r/min离心5min,收集上清液,即为粗酶液。
1.2.2 酶的分离纯化
将粗酶液在冰浴条件下用Biomax 50kD超滤器浓缩至较小体积,用pH7.0 20mmol/L磷酸钾缓冲液透析除盐,上Q-Sepharose Fast Flow柱,以0~0.5mol/L NaCl,pH7.0 20mmol/L磷酸钾缓冲液进行直线梯度洗脱,检测并收集有酶活性部分。
1.2.3 蛋白质含量的测定
采用Bradford法[9],以BSA为标准。
1.2.4 重组葡萄糖氧化酶酶活力的测定
取适当稀释后酶液50μL,加入1.0mL 含有79mmol/L pH6.0 MES-Na,131mmol/L葡萄糖,0.2mmol/L 4-AA,0.3mmol/L EHSPT,4U/mL POD的底物反应液中,在40℃准确反应5min,再置于沸水浴中快速灭活30s,冷却至室温,在波长555nm处测定其吸光度;空白对照除酶液预先灭活,其他处理相同。在上述条件下,每分钟催化生成1μmol/L H2O2所需的酶量定义为一个酶活力单位。
1.2.5 分子质量的测定
梯度PAGE[10]测定GOD全蛋白分子质量,浓缩胶4.0%、分离胶5.0%~15.0%;SDS-PAGE[10]测定GOD亚基分子质量,浓缩胶4.0%、分离胶10.0%,在还原和非还原条件下进行电泳;考马斯亮蓝R-250染色。
1.2.6 最适pH值和酸碱稳定性的分析
在40℃条件下测定GOD纯酶在pH 3.0、4.0、5.0、5.5、6.0、6.5、7.0、8.0时的酶活性,确定GOD的最适pH值。将酶液用0.2mol/L的不同pH值(3.0~12.0)的缓冲液进行适当稀释,4℃处理24h后在40℃、pH6.0条件下测定剩余酶活力,考察酶的酸碱稳定性。
pH3.0~6.0为0.2mol/L磷酸氢二钠-柠檬酸缓冲液;pH7.0~9.0为0.2mol/L Tris-HCl缓冲液;pH10.0~12.0为0.2mol/L甘氨酸-氢氧化钠缓冲液。
1.2.7 最适温度和热稳定性的分析
在pH6.0条件下测定25~60℃的酶活力,确定酶的最适温度。将适当稀释的酶液在不同温度(40、45、50、55、60℃)条件下分别处理10、20、30、40min后,在40℃、pH6.0条件下测定剩余酶活力,观察酶的热稳定性。
1.2.8 部分金属离子和试剂对GOD活性的影响
在反应体系中分别加入浓度均为2.0mmol/L的金属离子(Mg2+、Ca2+、Fe2+、Co2+、Mn2+、Ni2+、Hg2+、Ag+、Zn2+、Cu2+、Al3+)和试剂(5.0mmol/L的EDTA、NaN3、2.0mmol/L NaF以及0.2%的SDS、Triton X-100、吐温-20),测定酶活力,以未加入化学试剂的酶液做对照,观察金属离子和试剂对酶活力的影响。
1.2.9 米氏常数(Km)的测定
在40℃、pH6.0条件下,变化葡萄糖浓度(6~120mmol/L),测定GOD酶活力。采用Lineweaver-Burk双倒数作图法测定GOD对底物葡萄糖的Km。
1.2.10 GOD的光谱特征
在UV-2102紫外分光光度计上对GOD进行自然条件下的紫外光谱测定,扫描波长200~340nm。用蒸馏水做对照调节基线。
在F-4500荧光分光光度计上对GOD进行自然条件下的内源荧光光谱测定,以280nm为激发波长。其中,光径1cm,激发与发射光夹缝为5nm,光电倍增管的电压为700V,扫描速率1200nm/min。
1.2.11 GOD的液体保存稳定性
将过滤除菌后的液体GOD纯酶分别放置在4、25℃和37℃条件下,每隔一段时间测定剩余酶活性,考察GOD的保存稳定性。
2 结果与分析
2.1 酶的分离纯化
取3 0 0 m L 发酵液经高速冷冻离心,浓缩,透析除盐后为20mL,上Q-Sepharose Fast Flow层析柱(3cm×4cm),洗脱曲线见图1,蛋白含量和酶活性最高的部分均为50~150mL。纯化前后电泳图谱见图2,纯化后得到单一蛋白条带,酶比活力由54.08U/mg提高到73.17U/mg,纯化1.35倍,收率达92.7%(表1)。纯化的葡萄糖氧化酶经SDS-PAGE(还原/非还原条件下)鉴定,由标准蛋白可知该酶分子肽链的分子质量约为75kD(图3)。通过梯度PAGE测得GOD全酶分子质量约为150kD(图4)。
pH值对GOD酶活性的影响结果(图5)表明,该酶在pH6.0时活性最大;在pH5.0~8.0之间较稳定,催化活力无明显变化,而酶在pH4.0以下或pH9.0以上,其稳定性迅速下降。温度对酶活性的影响结果(图6)表明,该酶的最适温度为40℃,在30~50℃之间有较高的酶活力,60℃及以上活力较低;将酶液在50℃以下作用20min,活性基本不变,高于55℃后酶稳定性降低,在60℃保温40min,酶基本失活。

表 1 重组葡萄糖氧化酶的纯化结果Table 1 Summary of isolation and purification of recombinant P.pastoris GOD
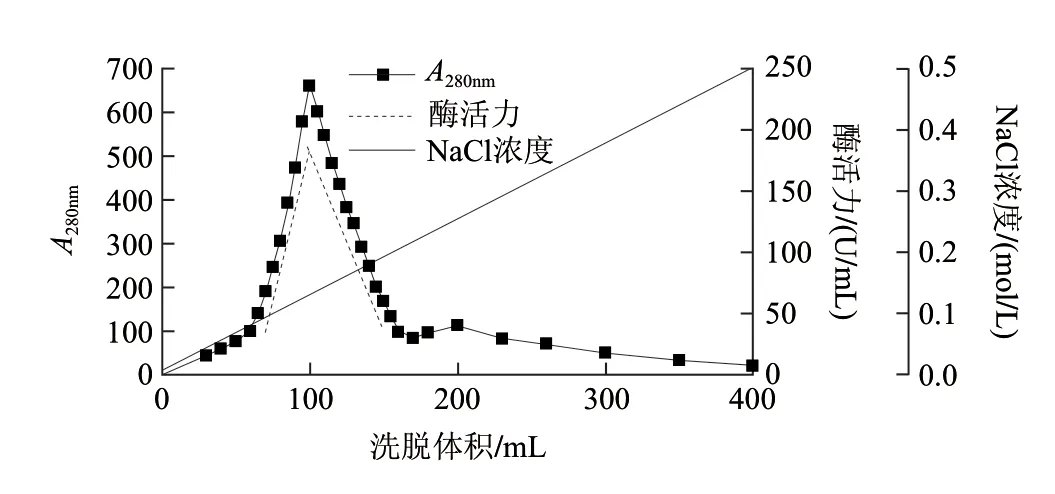
图 1 离子交换层析图Fig.1 Elution profi le of GOD on Q-Sepharose Fast Flow column
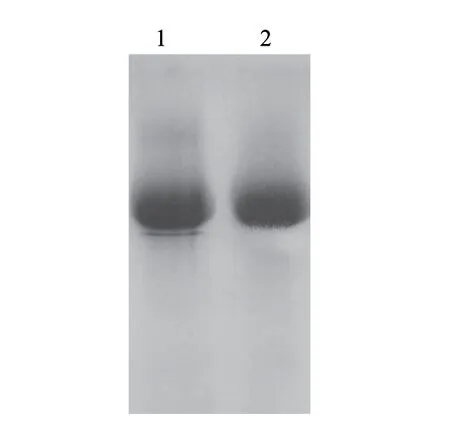
图 2 纯化前后葡萄糖氧化酶的SDS-PAGE电泳Fig.2 SDS-PAGE of crude and purifi ed GOD
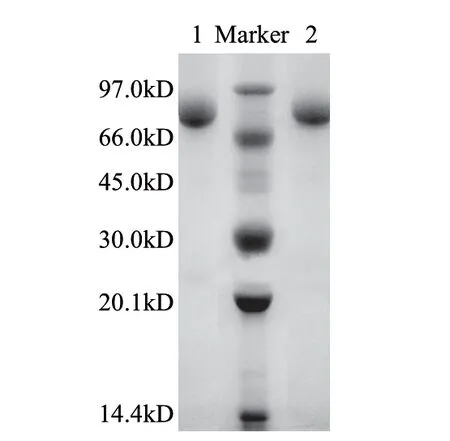
图 3 纯化后GOD的SDS-PAGEFig.3 SDS-PAGE pattern for molecular weight determination of purifi ed GOD
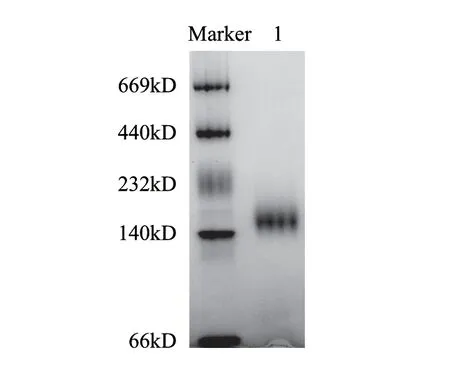
图 4 纯化后GOD的梯度PAGEFig.4 Gradient PAGE of purifi ed GOD
2.2 pH值和温度对GOD酶活力的影响
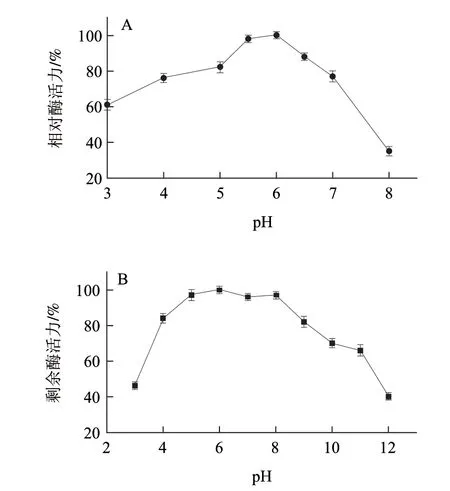
图 5 葡萄糖氧化酶的最适pH值(A)和酸碱稳定性(B)Fig.5 Optimum pH (A) and pH stability (B) of GOD
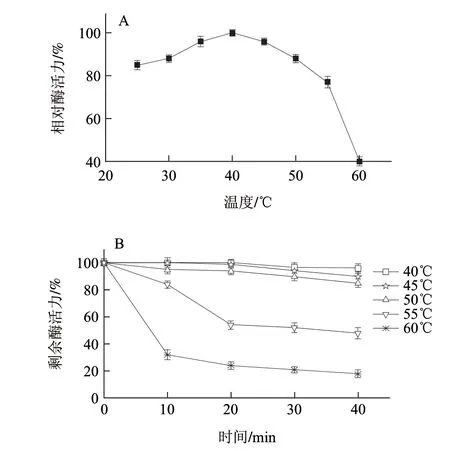
图 6 葡萄糖氧化酶的最适温度(A)和温度稳定性(B)Fig.6 Optimum temperature and temperature stability of GOD
pH值对酶活性的影响结果(图5)表明,该酶在pH6.0时活性最大;在pH5.0~8.0之间较稳定,催化活力无明显变化,而酶在pH4以下或pH9以上,其稳定性迅速下降。温度对酶活性的影响结果(图6)表明,该酶的最适温度为40℃,在30~50℃之间有较高的酶活力,60℃及以上活力较低;将酶液在50℃以下作用20min,活性基本不变,高于55℃后酶稳定性降低,在60℃保温40min,酶基本失活。
2.3 部分金属离子、表面活性剂和有机溶剂对GOD活性的影响
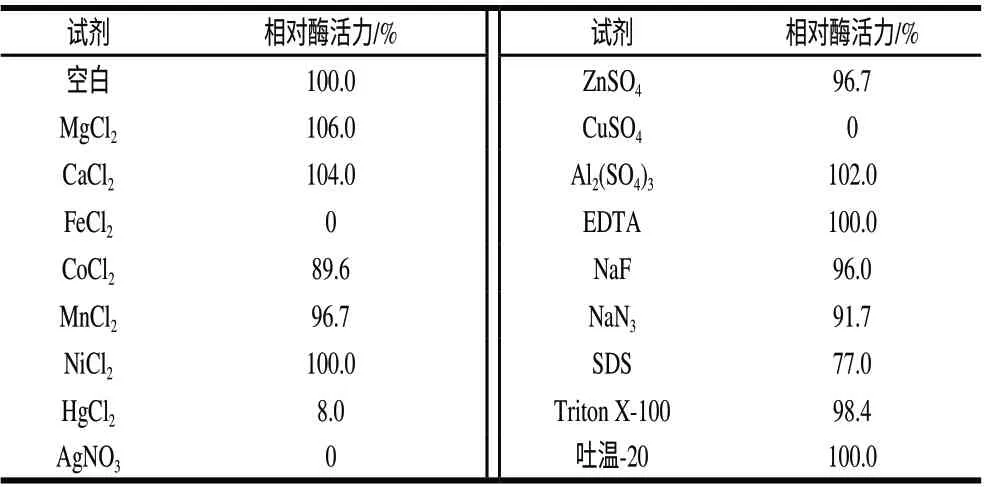
表 2 不同化学试剂对重组GOD活性的影响Table 2 Effects of different chemicals on GOD activity
由表2可知,Hg2+、Ag+、Cu2+、Fe2+对葡萄糖氧化酶有强烈的抑制作用,2.0mmol/L Ag+、Cu2+、Fe2+均可使酶活力完全丧失,其他金属离子对葡萄糖氧化酶的活力影响不大。表面活性剂SDS对GOD有抑制作用,0.2% SDS作用后酶活力剩余77%。
2.4 米氏常数的测定结果
以6~120mmol/L葡萄糖为底物,在pH6.0、40℃条件下,测定底物反应速率,按Lineweaver-Burk法作图(图7),求出葡萄糖氧化酶的Km为21.06mmol/L。
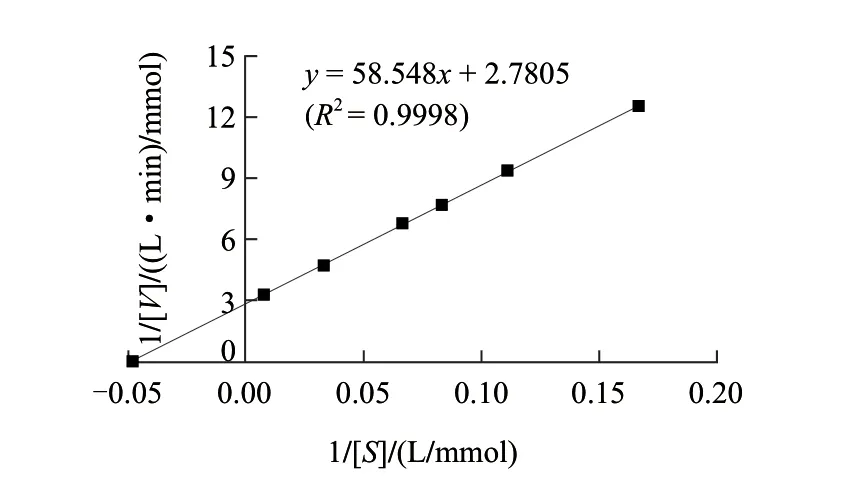
图 7 葡萄糖氧化酶的Lineweaver-Burk曲线Fig.7 Lineweaver-Burk plot of GOD
2.5 GOD的光谱特征
图8是GOD溶液在200~340nm波长范围扫描得到的GOD紫外吸收光谱曲线,结果显示GOD在波长275nm处有最大光吸收。图9是在280nm波长激发下得到的GOD荧光发射光谱,最大峰位于344nm处。
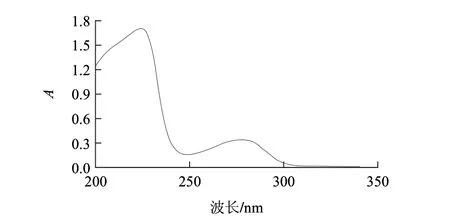
图 8 自然状态下GOD的紫外光谱图Fig.8 Ultraviolet absorption of GOD
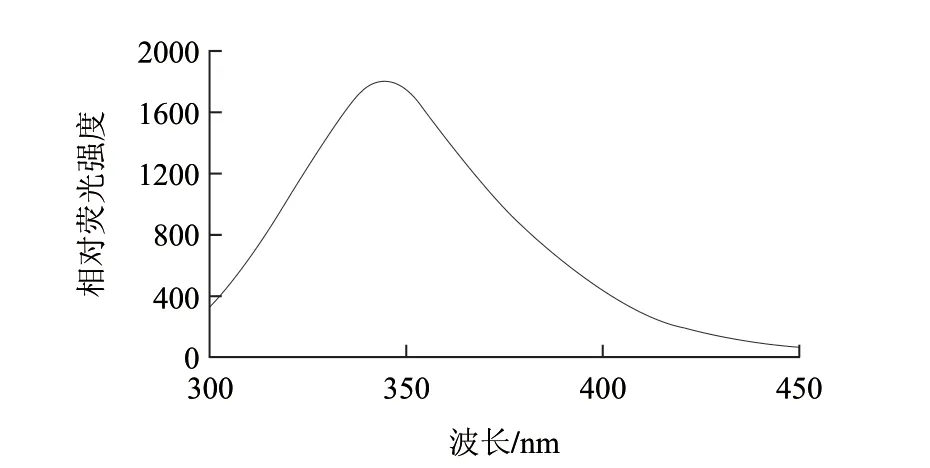
图 9 GOD的内源荧光光谱(280nm激发)Fig.9 Fluorescence absorption of GOD
2.6 GOD的液体保存稳定性结果
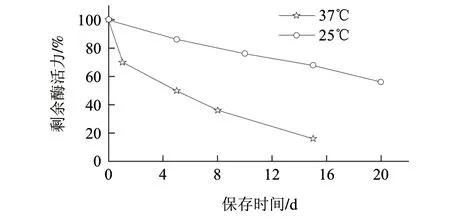
图 10 葡萄糖氧化酶的液体保存稳定性Fig.10 Storage ability of GOD in water
将纯化后的液体葡萄糖氧化酶样品除菌后分别在4、25、37℃条件下放置一段时间后,在最适条件下测定其酶活力。由图10可知,在4℃条件下放置6个月活性没有损失。常温25℃放置10d酶活力仍有76%,放置20d后仍有酶活力约56%;37℃条件下酶活力下降较为明显,1d后约有酶活力70%,10d后酶活力有20%。总体来说,在液体状态下,葡萄糖氧化酶在冷藏下是稳定的,常温下可放置3~5d。
3 讨 论
本实验从甲醇毕赤酵母发酵的上清液中得到的葡萄糖氧化酶,杂蛋白含量低,且不需破碎菌体,只经过一步离子交换层析就可以达到电泳纯,纯化收率高达92.7%,张茜等[11]从青霉中提取的GOD和苏茉等[12]从黑曲霉中提取的GOD都需要经过DEAE离子交换层析和凝胶过滤层析两步才能纯化,时间和费用成本相对较高,苏茉等[12]纯化的收率也仅为30.2%。另外本实验省去了上样量小,耗时长的凝胶过滤层析,有利于大规模纯化。有关文献[11,13-14]报道葡萄糖氧化酶是分子质量在150~170kD之间的二聚体,本实验纯化得到的酶分子质量为150kD,亚基分子质量为75kD,与报道相符。
本实验得到的GOD纯品的最适pH值为6.0,在pH5.0~8.0之间都可以稳定存在,由此可见该酶的pH值稳定范围较宽,酸碱耐受性很强,适于工业生产。提纯的葡萄糖氧化酶的最适温度为40℃,在50℃条件下保温30min仍有90%酶活力,可见该酶的热稳定性良好,在食品工业中可以适用不同的灭菌条件,温度高对防止杂菌的生长也很有利,因此提纯的GOD有很高的应用价值。
不同来源的GOD的Km值不同,周亚凤等[15]报道的黑曲霉葡萄糖氧化酶的Km值为38.25mmol/L,张茜等[11]纯化的青霉菌葡萄糖氧化酶Km值为122.6mmol/L,Rando等[16]报道的GOD的Km值为6.2mmol/L,王志新等[17]测得的黑曲霉A9葡萄糖氧化酶的Km为35.74mmol/L。Km值表征酶与底物亲和力的大小,Km越小,亲和力越大,本实验中测得的GOD的Km值为21.06mmol/L,显示本实验得到的GOD对葡萄糖的亲和力较好。
在蛋白质中Trp、Tyr、Phe等残基可以吸收紫外光[18],因此蛋白质溶液对一定波长范围的紫外光具有吸收值,葡萄糖氧化酶在275nm波长处有最大光吸收,符合其特征吸收峰。在蛋白质分子中,能够发射荧光的氨基酸为Phe、Tyr和Trp,以280nm为激发波长得到的荧光发射光谱是由Trp和Tyr等残基共同生成[19-20],并没有出现由Tyr基团产生的荧光峰(303nm),因此说明天然GOD的内源荧光来自Trp基团,在GOD分子内可能由于Tyr与Trp距离很近而产生了从Tyr与Trp的能量转移,与其游离Trp基团的最大荧光发射峰348nm相比,蓝移至344nm,蓝移了4nm。蛋白质分子中Trp如果位于蛋白质分子表面,其最大荧光发射峰应当在342~350nm之间,如果Trp位于蛋白质分子内部,最大荧光发射峰应当在326~342nm之间,如果Trp位于非极性环境中,最大荧光发射峰应当在310~324nm之间。实验结果表明在GOD分子内Trp基团可能位于分子表面。
该酶被Hg2+、Ag+、Cu2+、Fe2+强烈抑制,Mg2+、Ca2+、Mn2+等对酶活性几乎没有影响,由此可见葡萄糖氧化酶在测定含有上述离子的样品时不会有明显影响,所以此酶可广泛应用于血糖含量的测定。液体状态下该酶可长期冷冻保存,在常温下也可保存3~5d,有利于该酶在生物传感器方面的应用。综上所述,葡萄糖氧化酶具有很大的应用潜力,适用于食品、医疗、生物等行业。但是液体葡萄糖氧化酶在37℃条件下的保存时间较短,将该酶固定化来提高其稳定性方面还可做进一步的研究。
[1] BANKAR S B, BULE M V, SINGHAL R S. Glucose oxidase: an overview[J]. Biotechnology Advances, 2009, 27(4): 489-501.
[2] WONG C M, WONG K H, CHEN Xiaodong. Glucose oxidase: natural occurrence, function, properties and industrial applications[J]. Appl Microbiol Biotechnol, 2008, 78(6): 927-938.
[3] MINKSTIMIENE A K, MAZEIKO V, RAMANAVICIENE A. Evaluation of amperometric glucose biosensors based on glucose oxidase encapsulated within enzymatically synthesized polyaniline and polypyrrole[J]. Sensors and Actuators B, 2011, 158(1): 278-285.
[4] CRUZ A G, CASTRO W F, FARIA J A F. Glucose oxidase: a potential option to decrease the oxidative stress in stirred probiotic yogurt[J]. Food Science and Technology, 2012, 47(2): 512-515.
[5] HATZINIKOLAOU D G, HANSEN O C, MACRIS B J, et al. A new glucose oxidase from Aspergillus niger: characterization and regulation studies of enzyme and gene[J]. Appl Microbiol Biotechnol, 1996, 46(4): 371-381.
[6] SUKHACHEVA M V, DAVYDOVA M E, NETRUSOV A I. Production of Penicillium funiculosum 433 glucose oxidase and its properties[J]. Appl Biochem Microbiol, 2004, 40(1): 25-29.
[7] YAMAGUCHI M, TAHARA Y, NAKANO A, et al. Secretory and continuous expression of Aspergillus niger glucose oxidase gene in Pichia pastoris[J]. Protein Expression and Purifi cation, 2007, 55(2): 273-278.
[8] CROGNALE S, PULCI V, BROZZOLI V, et al. Expression of Penicillium variabile P16 glucose oxidase gene in Pichia pastoris and characterization of the recombinant enzyme[J]. Enzyme and Microbial Technology, 2006, 39(6): 1230-1235.
[9] 李娟, 张耀庭. 应用考马斯亮蓝法测定总蛋白含量[J]. 中国生物制品学杂志, 2000, 13(2): 118-120.
[10] 郭晓君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 2001: 128-140.
[11] 张茜, 傅婉辉, 康劲翮, 等. 青霉葡萄糖氧化酶的分离纯化及性质研究[J]. 厦门大学学报: 自然科学版, 2009, 48(1): 99-102.
[12] 苏茉, 高亚鹏, 梁建荣, 等. 黑曲霉H1-9b葡萄糖氧化酶的分离纯化及部分性质研究[J]. 食品科学, 2011, 32(3): 181-186.
[13] 张婷. Aspergillius niger Z-25产葡萄糖氧化酶发酵条件优化及酶的分离纯化研究[D]. 南京: 南京农业大学, 2008.
[14] SIMPSON C, JORDAAN J, GARDINER N S, et al. Isolation, purification and characterization of a novel glucose oxidase from Penicillium sp.CBS 120262 optimally active at neutral pH[J]. Protein Expression and Purifi cation, 2007, 51(2): 260-266.
[15] 周亚凤, 张先恩, 刘虹, 等. 黑曲霉葡萄糖氧化酶基因的克隆及其在酵母中的高效表达[J]. 生物工程学报, 2001, 17(4): 400-405.
[16] RANDO D, KOHRING G W, GIFFHORN F. Production, purifi cation and characterization of glucose oxidase from a newly isolated strain of Penicillium pinophilum[J]. Applied Microbiology and Biotechnology, 1997, 48(1): 34-40.
[17] 王志新, 于宏伟, 韩军, 等. 黑曲霉A9葡萄糖氧化酶的酶学性质研究[J]. 河北农业大学学报, 2006, 29(4): 69-74.
[18] 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 3版. 北京: 高等教育出版社, 2002: 145-146.
[19] PRZYBYT M, MILLER E, SZREDER T. Thermostability of glucose oxidase in silica gel obtained by sol-gel method and in solution studied by fl uorimetric method[J]. J Photoch Photobio B, 2011, 103(1): 22-28.
[20] 袁燕, 肖涵, 康洪钧, 等. 新的植物毒素蒜头果蛋白的荧光光谱研究[J]. 光谱学与光谱分析, 2009, 29(3): 777-780.
