大肠杆菌重组表达磷脂酶C的发酵工艺优化
2013-08-07赵金星顾正华丁重阳石贵阳
赵金星,张 梁,顾正华,丁重阳,石贵阳
(江南大学 食品科学与技术国家重点实验室,工业生物技术教育部重点实验室,粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
磷脂酶C(PLC,EC3.1.4.3) 广泛存在于微生物和动植物的组织和细胞中,到目前为止已发现20多种不同的PLC分子结构。PLC可水解甘油磷脂C3位点甘油磷酸脂键,生成甘油二酯(DAG)和磷酸单酯[1],磷脂酶C的活性需要Zn2+、Mg2+等金属离子激活。
PLC在抗血小板新药研究[2-4]、高血压[5]等病理研究以及食品工业添加剂、油脂精炼等方面都有应用。但是从长远角度来看,磷脂酶C应用于油脂酶法脱胶最具工业应用前景。从目前的研究结果来看,酶法脱胶的效果较好,但使用的酶主要是Novoeymes公司推出的2款磷脂酶-Lecitse Novo和Lecitase Ultra,对于大宗油脱胶来说,成本较高。目前国内尚无商业化磷脂酶,国内的工业用磷脂酶主要依赖进口,国外能够引进工业应用的磷脂酶只有诺维信A/S链霉菌属来源磷脂酶和镰刀菌属磷脂酶来源磷脂酶A。虽然有研究表明利用磷脂酶C进行油脂精炼可以将油耗降低3.6%,但是由于磷脂酶C产量较低,工业化应用价值还不能很好的体现。
鉴于磷脂酶C在医药、食品等工业特别是油脂脱胶领域的应用前景,相关研究正愈发受到重视。由于野生微生物菌株磷脂酶产量较低,并且已知的大多数微生物来源磷脂酶C都以毒素因子的形式存在于致病性的病原体中,异源表达虽得到了一定的效果,但是离工业化生产的要求还有一定的距离,导致磷脂酶C的价格比较昂贵,磷脂酶C的工业应用受到限制。研究合适的磷脂酶C表达体系并进行工艺优化,对促进磷脂酶C的发酵产业化及工业应用具有重要的学术与实践价值。
微生物来源的磷脂酶C结构一般较为简单,目前已经从多种微生物中分离得到。国内研究起步较晚,但也取得了一定的成果,自1989年至今分别对黏质沙雷氏武汉菌株[6]、Bacillus cereus[7]、哈维氏弧菌[8]和B. mycoide[9]产磷脂酶C菌株进行了诱变、产酶性质及发酵工艺等研究。国外对微生物磷脂酶C的研究起源于20世纪的60年代,多株细菌来源的磷脂酶C基因相继被克隆并对其底物特异性、酶学性质等进行了较为深入的研究[10],国内除本课题组成功实现不同来源磷脂酶C的重组表达外,公开报道的最高酶活力为26U/mL。
本课题组近年来也对磷脂酶C进行了较为系统的研究,筛选获得了多株磷脂酶C高产菌株,并在国内首次实现了B. cereus磷脂酶C基因的重组表达[10],研究分析了Pseudomonas aeruginosa来源各磷脂酶C的特性并构建了高产菌株,在LB培养基中的初步发酵实验即获得了较高酶活[11]。但是在用LB培养基进行上罐发酵时,与摇瓶发酵时相比,不论是添加甘氨酸前后,总酶活力的提升幅度都较小,原因可能是LB培养基中菌体量无法有效增长,难以高密度培养。本实验以实验室前期构建的重组大肠杆菌BL21(DE3)/pET28a-plcH为出发菌株,进一步在摇瓶中对其发酵工艺进行优化,并在7L发酵罐中进行了工艺验证。
1 材料与方法
1.1 菌株与试剂
重组大肠杆菌BL21 (DE3)/pET28a-plcH,本实验室前期构建并保藏。
p-NPPC (p-nitrophenylphosphoryl cholone,p-NPPC)美国Sigma公司;其他试剂均为分析纯。
1.2 培养基
LB(luria-bertani)液体培养基;TB(terrific broth)培养基;TB-TH培养基(g/L):称取12g蛋白胨、24g酵母提取物和5g甘油加入到1L的Tris-HCl (0.25mol/L,pH 7.2~7.4)缓冲液中,1×105Pa高压灭菌20min。
1.3 方法
1.3.1 酶活力的检测
反应体系构成参考文献[12],酶活力单位的定义参考文献[13]。
1.3.2 发酵培养基的比较
考察LB、TB两种培养基的产酶情况,诱导方法:取保藏于甘油管中的重组大肠杆菌50μL于37℃、200r/min振荡培养10h,次日以5%接种量转接至50mL终质量浓度为100μg/mL的Kana-LB或TB液体培养基中,37℃、150r/min培养4h,加入IPTG至终浓度为1.0mmol/L,25℃、150r/min诱导6~10h。诱导结束时测量发酵液OD600nm值,取等量发酵液破碎测定酶活力。
1.3.3 TB培养基中碳源的优化
以下优化的发酵条件为:取保藏于甘油管中的重组大肠杆菌50μL,接种于装有30mL的Kana-LB液体培养基的250mL三角瓶中,37℃、200r/min培养10h,然后以5%的转接量转接于若干装有50mL的Kana-TB-TH液体培养基的250mL三角瓶中,37℃、200r/min振荡培养4h后添加IPTG至终浓度为1.0mmol/L,诱导6 h后收集细胞并破碎,酶活力测定方法同1.3.1节。
碳源的确定:按照碳源的添加量相同的原则,选择麦芽糖、蔗糖、乳糖、葡萄糖、可溶性淀粉、糊精、壳聚糖7种碳源分别替代TB培养基中的甘油,并与甘油做对比,诱导后根据酶活力测定结果,选择合适的碳源。碳源添加量的确定:根据上述结果,配制含不同质量浓度碳源的TB培养基,培养方法如前所述,诱导后根据酶活力测定结果,选择合适的碳源添加量。
1.3.4 重组大肠杆菌生长曲线的绘制
1.3.4.1 摇瓶条件下重组大肠杆菌生长曲线的绘制
取保藏于甘油管中的重组大肠杆菌50μL,接种于装有30mL的Kana-LB液体培养基的250mL三角瓶中,37℃、200r/min培养10h,然后以5% 转接量转接于若干装有50mL的Kana-TB液体培养基的250mL三角瓶中,37℃、200r/min振荡培养,定点取样测OD600nm值。以时间为横坐标做该重组菌的生长曲线以及比生长速率曲线。
1.3.4.2 7L发酵罐中重组大肠杆菌生长曲线的绘制
将二级种子以5%接种量接至含3L TB培养基的7L发酵罐中,溶氧水平偶联搅拌转速,使溶氧浓度保持在30%左右,pH值控制在7.2左右,培养温度37℃,流加50%的甘油,在保证碳氮源充足的情况下,每隔1h取样测定OD600nm,绘制重组菌在3L TB培养基内的生长曲线。此处TB培养基组分为:12g/L蛋白胨鱼粉、24g/L酵母浸膏、30g/L甘油、0.1g/L卡那霉素。
1.3.5 TB-TH培养基条件下,添加IPTG对重组大肠杆菌进行诱导条件的初步优化
1.3.5.1 诱导温度的优化
根据宿主大肠杆菌适宜生长的温度范围及实验室条件,在37℃培养至6h,并添加IPTG至终浓度1.0mmol/L后分别在不同温度条件下进行诱导表达。酶活力测定方法参照1.3.1节,根据实验结果确定诱导温度。
1.3.5.2 IPTG添加时间的优化
参考TB培养基重组大肠杆菌生长曲线,在接种后不同时间添加IPTG诱导,并诱导6h。取相同体积的菌体,用0.25mol/L 的Tris-HCl (pH7.2)缓冲液稀释至相同OD600nm=2后进行超声波破碎,以p-NPPC法测得的酶活力的大小为参考,来确定诱导剂添加时间,具体操作参照1.3.1节。
1.3.5.3 IPTG 浓度的优化
添加不同浓度梯度的IPTG进行诱导表达。酶活力测定方法参照1.3.1节,根据结果确定诱导剂浓度。
1.3.5.4 诱导时间的确定
在上述已优化的诱导条件下进行诱导,分别诱导不同的时间后取样破碎,酶活力测定方法参照1.3.1节,以确定诱导时间。
1.3.5.5 卡那霉素添加量的优化
在上述已优化的诱导条件下进行诱导,分别添加不同质量浓度梯度的卡那霉素,诱导至1.3.6.1节所优化时间后,取样破碎,酶活力测定方法参照1.3.1节,确定卡那霉素的添加质量浓度。
1.3.6 TB-TH培养基条件下,添加乳糖对重组大肠杆菌进行诱导条件的初步优化
1.3.6.1 乳糖添加时间的优化
参考TB培养基重组大肠杆菌生长曲线,在接种后不同时间添加乳糖诱导,并诱导12h。酶活测定方法参照1.3.1节,根据测定结果确定乳糖添加时间。
1.3.6.2 乳糖添加量的优化
分别添加不同质量浓度的乳糖进行诱导表达。酶活力测定方法参照1.3.1节,根据结果确定诱导剂质量浓度。
1.3.6.3 诱导时间的优化
在上述已优化的诱导条件下进行诱导,分别诱导不同的时间后取样破碎,酶活力测定方法参照1.3.1节,根据测定结果以确定诱导时间。
1.3.6.4 甘氨酸添加量的优化
根据上述优化结果进行发酵诱导,在添加乳糖的同时添加不同质量浓度梯度的甘氨酸,诱导时间暂定为6h。诱导结束后分别收集发酵液上清和细胞,将收集到的细胞进行细胞破碎,用p-NPPC法分别测定发酵液上清和细胞破碎液上清的酶活力,根据测定结果确定甘氨酸添加量。若在TB培养基中,甘氨酸对重组菌产酶有促进作用,则继续进行甘氨酸添加时间、甘氨酸添加后诱导时间的优化,反之,则不会再继续优化。
1.3.7 7L发酵罐实验
1.3.7.1 一级、二级种子的制备
一级种子制备参照1.3.3节。
取一级种子转接,接种至250mL三角瓶(5%转接量)含50mL的Kana-LB培养基中,37℃、200r/min培养6h后,得到二级种子。150mL的二级种子作为7L发酵罐所用种子。
1.3.7.2 诱导时间对重组菌产酶的影响
参照重组菌生长曲线,在重组菌对数期中前期流加20%的乳糖(终质量浓度初步定为20g/L)进行诱导,诱导温度为25℃,每隔6h左右取样,测定OD600nm和酶活力。
2 结果与分析
2.1 TB培养基发酵实验
发酵培养基的成分会影响重组大肠杆菌细胞的生长和产物的合成,与LB培养基比较:1) TB培养基营养丰富,成分组成更适合菌体生长,可获得更多的菌体来生产重组酶;2) TB培养基含有缓冲体系,有较强的pH值缓冲能力,使pH值维持在7.0左右,有利于重组大肠杆菌的生长和重组酶的稳定;3) TB培养基酵母膏含量明显高于LB等其他培养基,文献报道酵母膏对重组大肠杆菌将重组酶释放到细胞的周知空间有明显的促进作用[14]。因此,本研究拟采用TB培养基代替LB培养基进行研究。

表 1 发酵培养基的比较Table 1 Comparison of different fermentation media on cell density and PLC activity
由表1可知,LB培养基的产酶量明显高于TB培养基,因此先选择LB培养基作为发酵培养基来进行摇瓶发酵优化。分析原因,可能是TB培养基中的高浓度磷酸盐对磷脂酶C表达具有抑制作用[14-17]。因此拟将替换TB培养基中的缓冲液。在考虑缓冲液缓冲范围及磷脂酶C和菌体的pH值耐受范围的情况下,分别考察磷酸盐、Tris-HCl、HEPES和无缓冲液4种情况对菌体生长和产酶的影响,方法参照1.3.2节。
由图1可知,磷酸盐、Tris-HCl的缓冲能力较好,发酵液的OD600nm可以达到12左右,而添加有HEPES的发酵液的OD600nm只有5左右,无缓冲液的情况下OD600nm只有4.5左右。诱导时间相同的情况下,缓冲液为为Tris-HCl时,酶活力可以达到260U/mL左右;缓冲液为磷酸盐缓冲液时,酶活力可达160U/mL左右;缓冲液位HEPES时,酶活力可达200U/mL左右;无缓冲液时,酶活力可达180U/mL左右,由此可见Tris-HCl缓冲液要明显好于其他3种情况。所以初步选择Tris-HCl作为TB培养基的缓冲液,并将新培养基命名为TB-TH培养基。
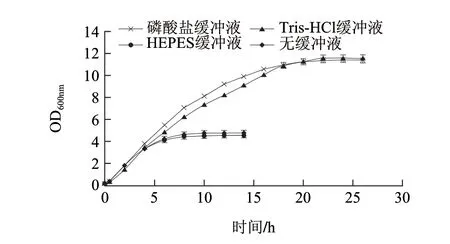
图 1 TB培养基中缓冲液的选择Fig.1 Choice of optimum buffer in TB medium
2.2 TB-TH培养基中碳源的优化
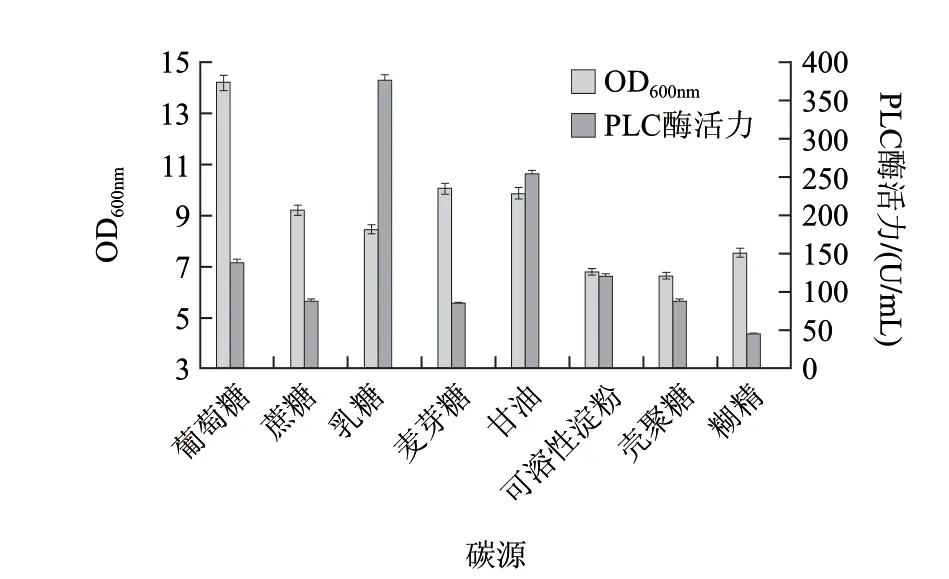
图 2 TB-TH培养基中碳源的选择Fig.2 Choice of optimum carbon source in TB medium
由图2可知,按产酶量从高到低排序,乳糖>甘油>葡萄糖>可溶性淀粉>壳聚糖>麦芽糖>蔗糖>糊精。对含有Lac启动子的重组菌,由于葡萄糖降低了胞内cAMP水平和减弱了诱导物的利用率,因此对其产酶有抑制作用[18],与结果相符,因此葡萄糖虽是常见的碳源,适合菌体的生长,但酶活力并不高;乳糖本身即可作为碳源又是诱导剂,因此酶活力最高,但是乳糖作为碳源会增加发酵成本,综合考虑后仍然选用甘油作为碳源。
2.3 TB-TH培养基中甘油质量浓度的优化
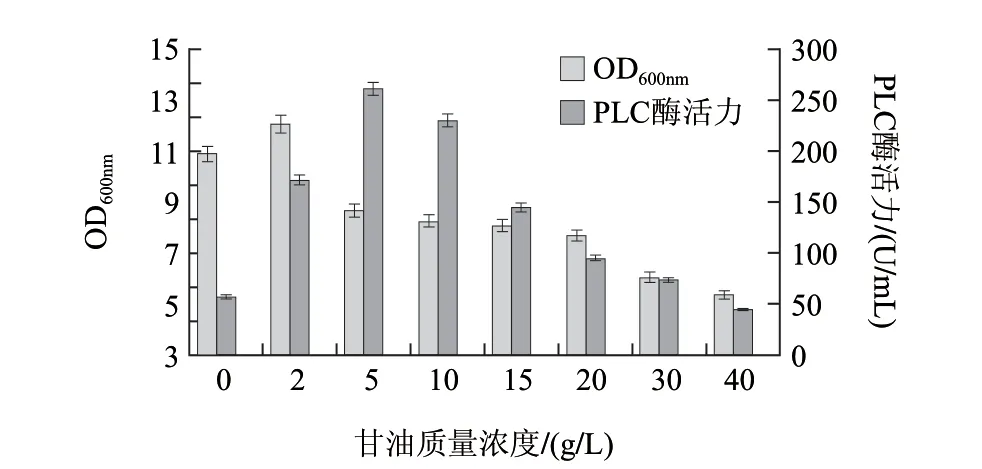
图 3 TB-TH培养基中甘油质量浓度的优化Fig.3 Choice of optimum glycerin concentration in TB medium
由图3可知,当甘油质量浓度为5g/L时,菌体产酶量最高,可达到260U/mL左右,因此甘油的初始质量浓度控制在5g/L 左右。综上所述,最终TB-TH的组分为:12g/L 蛋白胨、24g/L酵母提取物、5g/L甘油,Tris-HCl(0.25mol/L,pH 7.2~7.4)缓冲液配制。
TB-TH培养基作为摇瓶发酵优化的培养基,以期找到产酶量最优的培养基和培养条件。最后在7L发酵罐中进行了工艺放大实验,以验证是否适合工业化生产。
2.4 摇瓶条件下重组菌生长曲线和比生长速率曲线的绘制
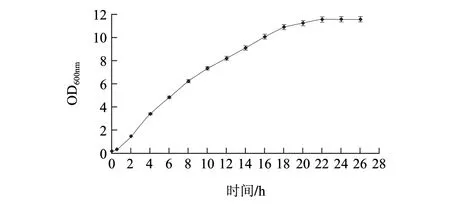
图 4 摇瓶条件下重组菌生长曲线Fig.4 Growth curve of the recombination strain under shake f lask conditions
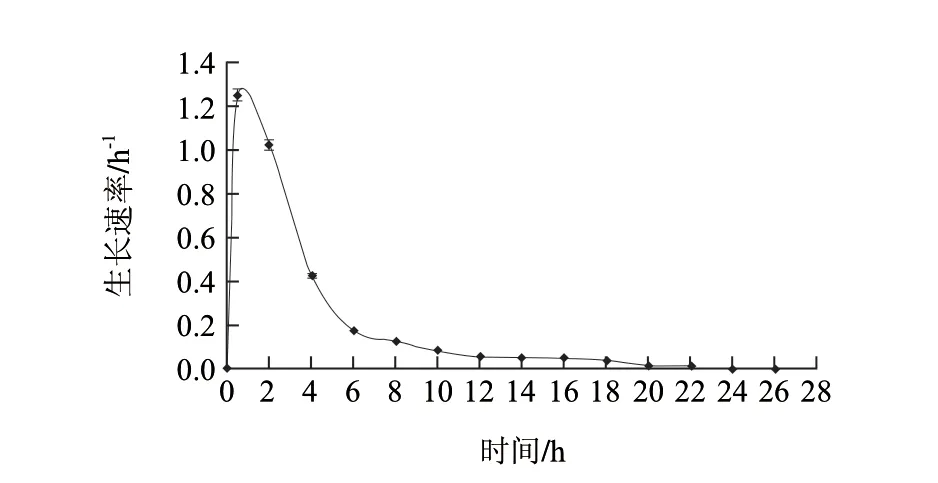
图 5 摇瓶条件下重组菌比生长速率曲线Fig.5 Specif ic growth rate curve of the recombination strain under shake f lask conditions
由图4、5可知,0~1.5h为适应期,1.5~24h为对数生长期,6h左右为对数中期。
2.5 TB-TH培养基中,添加IPTG对重组大肠杆菌进行诱导条件的初步优化
2.5.1 添加IPTG时诱导温度对产酶的影响

图 6 添加IPTG时诱导温度对产酶的影响Fig.6 Effect of IPTG induction temperature on phospholipase activity
由图6可知,诱导温度为25℃时,重组蛋白的酶活力达到最大,可达到280U/mL左右。故选取发酵诱导的温度为25℃。

图 7 IPTG添加时间对产酶的影响Fig.7 Effect of IPTG addition time on phospholipase activity
2.5.2 IPTG添加时间对产酶的影响由图7可知,在对数中期6h时添加IPTG,重组菌产酶量达到最大值,达到365U/mL左右。故IPTG添加时间为转接后6 h。
2.5.3 IPTG浓度对酶活力的影响
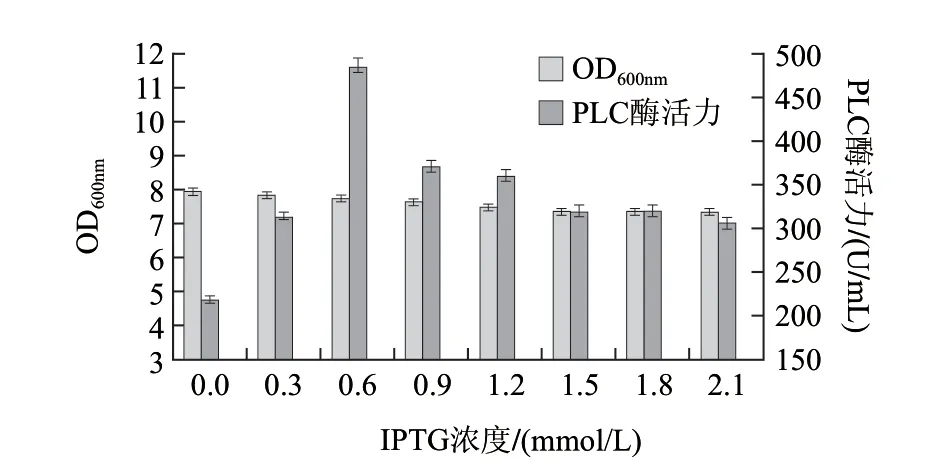
图 8 IPTG浓度对酶活力的影响Fig.8 Effect of IPTG concentration on phospholipase activity
由图8可知,在IPTG浓度为0.6mmol/L时,重组菌产酶量达到最大,约485U/mL。故IPTG浓度选为0.6mmol/L。
2.5.4 添加IPTG时诱导时间对产酶的影响
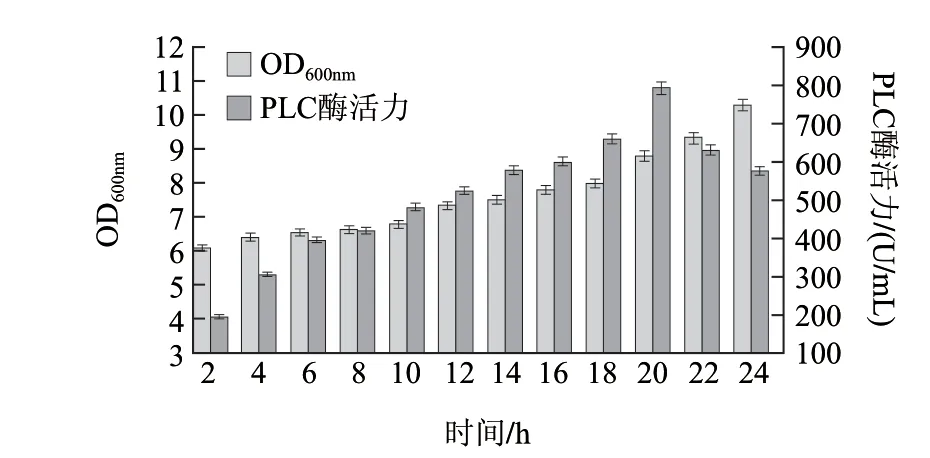
图 9 添加IPTG时诱导时间对产酶的影响Fig.9 Effect of IPTG induction time on phospholipase activity
由图9可知,IPTG添加后20h,重组蛋白的酶活力达到最大值,可达到800U/mL左右。故诱导时间选为20h。
2.5.5 添加IPTG时卡那霉素质量浓度对酶活力的影响
由图10可知,在卡那霉素质量浓度为0.15mg/mL时,重组菌产酶量达到最大,约850U/mL。故IPTG质量浓度选为0.15mg/mL。
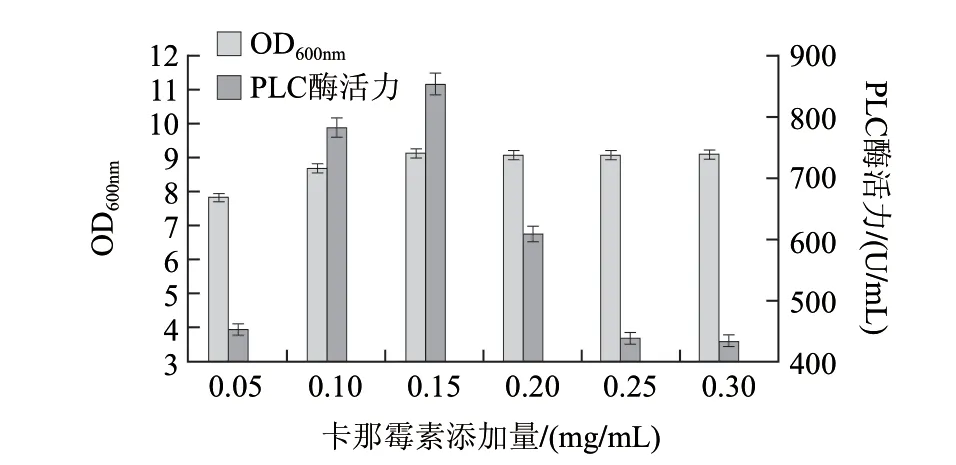
图 10 添加IPTG时卡那霉素添加量对酶活力的影响Fig.10 Effect of Kana concentration (when IPTG was added) on phospholipase activity
综上所述,TB-TH培养基下,添加IPTG时,重组大肠杆菌诱导条件为:取保藏于甘油管中的重组大肠杆菌50μL加入到30mL的Kana-LB培养基中,于37℃、200r/min振荡培养10h,次日以5%转接量接种至50mL的TB-TH培养基中,添加卡那霉素的质量浓度为0.15mg/mL,37℃、200r/min培养6h后,添加IPTG至终浓度为0.6mmol/L,并25℃、150r/min诱导培养20h。在此诱导条件下,酶活力可达到(794.01±24.84)U/mL。
2.6 TB-TH培养基中,添加乳糖对重组大肠杆菌进行诱导条件的初步优化
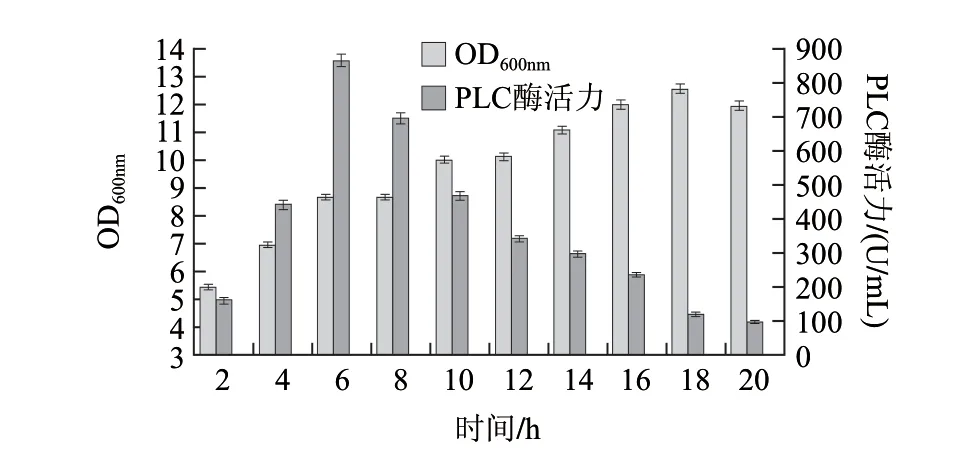
图 11 乳糖添加时间对酶活力的影响Fig.11 Effect of lactose addion time on phospholipase activity
2.6.1 乳糖添加时间的确定由图11可知,在对数中期6h时添加乳糖,重组菌产酶量达到最大值,达到860U/mL左右。故乳糖添加时间为转接后6h。
2.6.2 乳糖添加量对酶活力的影响
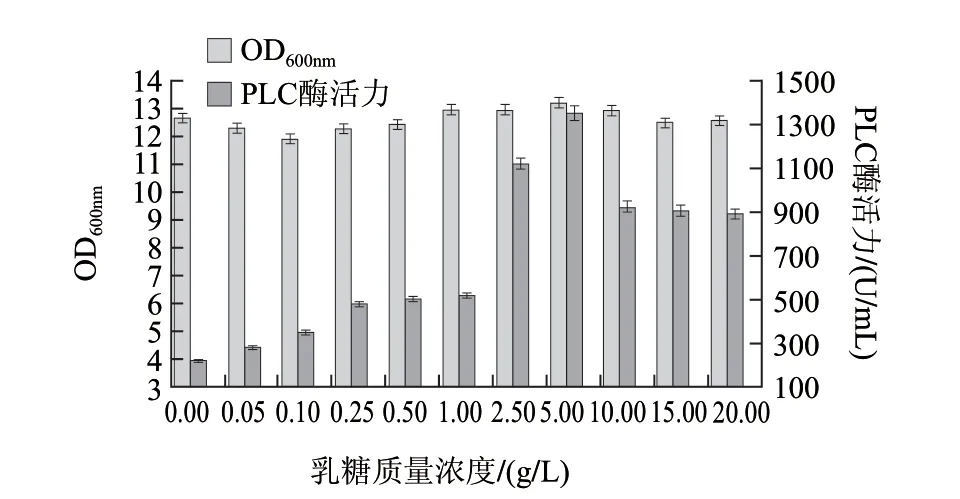
图 12 乳糖质量浓度对酶活力的影响Fig.12 Effect of lactose concentration on phospholipase activity
由图12可知,在乳糖质量浓度为5g/L时,重组菌产酶量达到最大,约1350U/mL。故乳糖质量浓度选为5g/L。
2.6.3 添加乳糖时诱导时间对产酶的影响
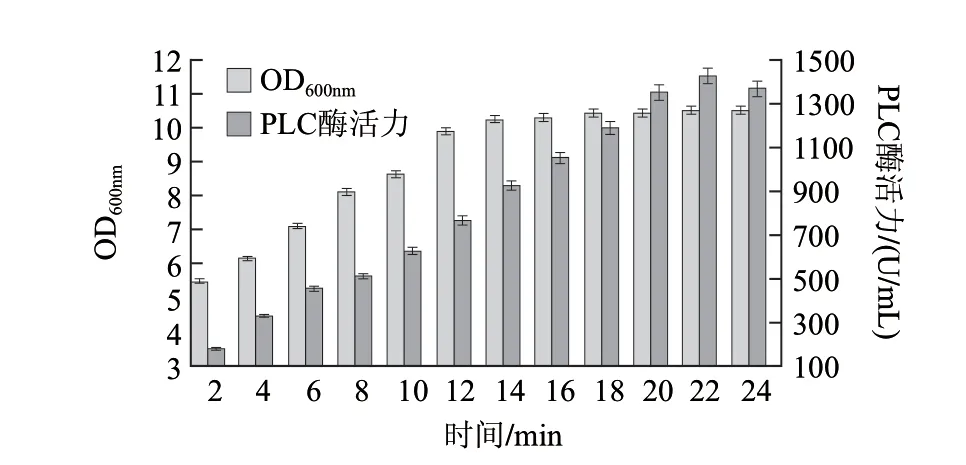
图 13 添加乳糖时诱导时间对产酶的影响Fig.13 Effect of lactose induction time on phospholipase activity
由图13可知,乳糖添加后22h,重组蛋白的酶活力达到最大值,可达到1422U/mL左右。故诱导时间选为22 h。
综上所述,TB-TH培养基下,添加乳糖时,重组大肠杆菌诱导条件为:取保藏于甘油管中的重组大肠杆菌50μL加入到30mL的Kana-LB培养基中,于37℃、200r/min振荡培养10h,次日以5%转接量接种至50mL的TB-TH培养基中,添加Kana质量浓度至0.15mg/mL,37℃、200r/min培养6h后,添加乳糖至终质量浓度为5g/L,并25℃、150r/min诱导培养20h。在此诱导条件下,酶活力可达到(1422.42±37.17)U/mL。
2.6.4 甘氨酸质量浓度对酶活力的影响
虽然甘氨酸在很多大肠杆菌产重组酶的发酵过程中具有促进重组酶分泌的作用[19-20],由图14可知,在TB-TH培养基中添加甘氨酸对重组菌酶活的提高无任何促进作用,反而有显著的抑制作用,因此,本研究不再对其进行进一步研究。参考有关文献[14]可得,某些渗透性物质(例如甘氨酸)可对磷脂酶C的生产有抑制作用,这也较好的解释了上述现象。
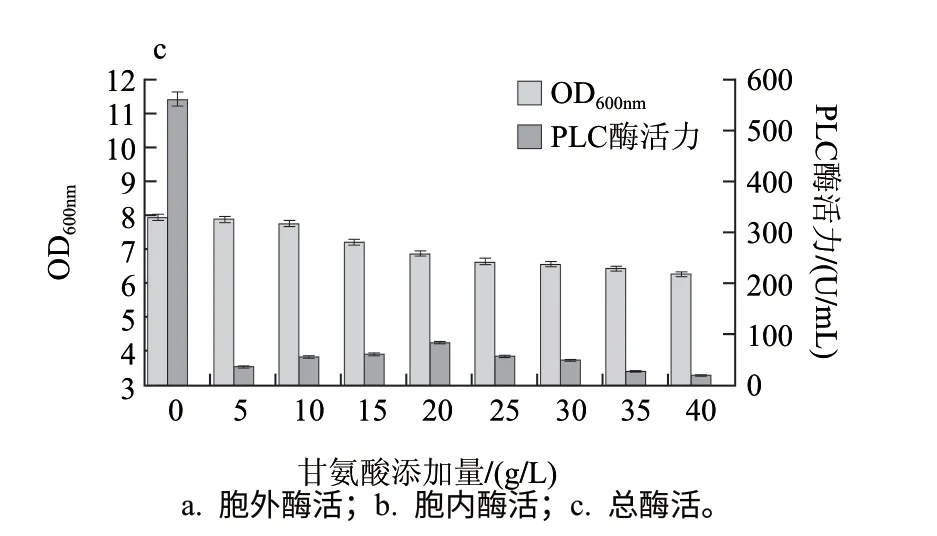
图 14 甘氨酸添加量对酶活力的影响Fig.14 Effect of glycine concentration on phospholipase activity
2.7 7L分批发酵实验
2.7.1 重组菌在7L发酵罐种生长曲线的绘制
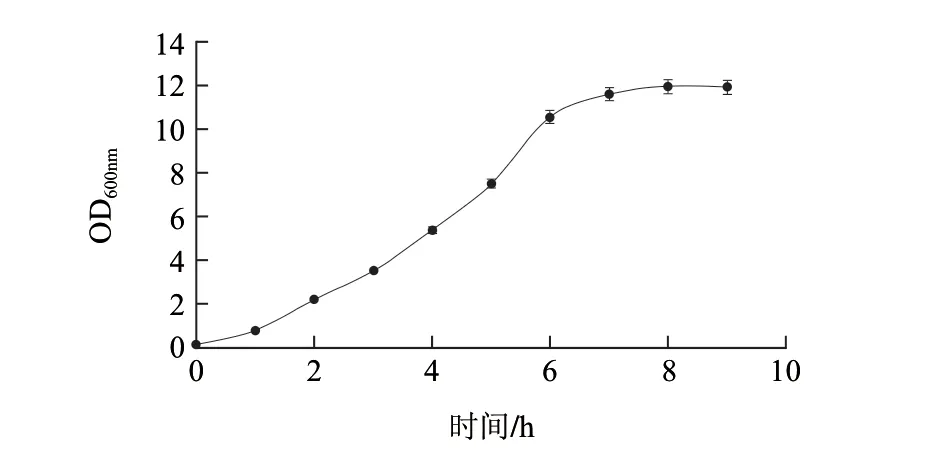
图 15 在发酵罐中不流加甘油时,重组菌生长曲线Fig.15 Growth curve of the recombination strain without the addition of glycerol in fermentation tanks
图15为不流加50%甘油时的生长曲线,重组菌在1h后进入对数生长期,8h左右进入稳定期,对比摇瓶发酵下的生长曲线(图4)可知,重组菌的生长周期比摇瓶发酵下大大缩短。在pH值和溶氧都得到较好控制的情况下,发酵的OD600nm值最高可以达到12左右,与摇瓶发酵下基本一致。
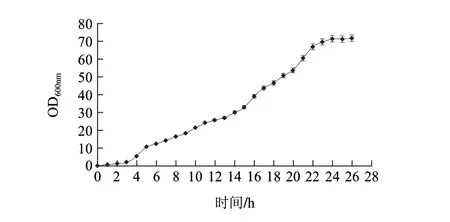
图 16 在发酵罐中流加甘油时,重组菌生长曲线Fig.16 Growth curve of the recombination strain with the addition of glycerol in fermentation tanks
图16为流加50%甘油时的生长曲线,重组菌在3h后进入对数生长期,24h左右进入稳定期。在碳氮源充足、pH值和溶氧都得到较好控制的情况下,发酵的OD600nm值最高可以达到70左右,比摇瓶发酵下提高了5倍左右。
综上所述,最终选择了流加甘油的方式进行后续乳糖诱导实验。
2.7.2 诱导时间对产酶的影响
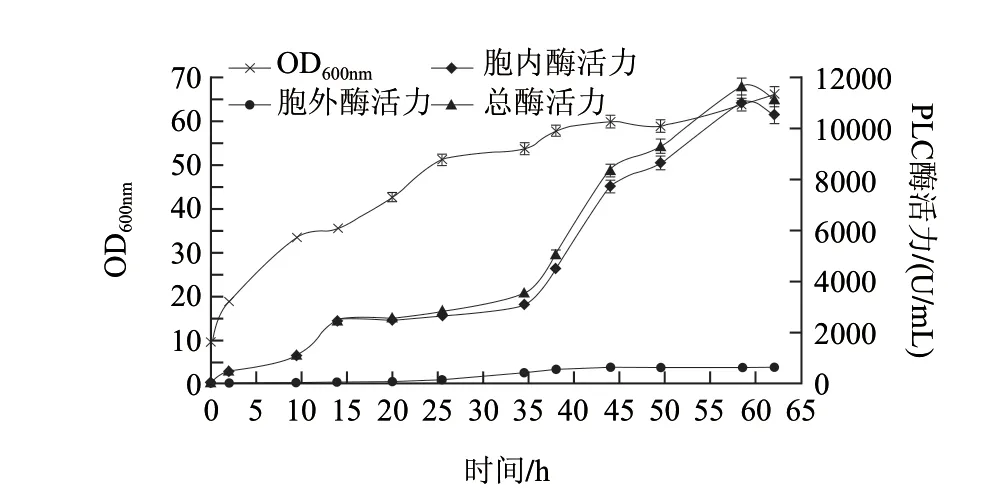
图 17 发酵罐中诱导时间对产酶的影响Fig.17 Inf luence of induction time on phospholipase production in fermentation tanks
乳糖的添加时间为发酵后6h,即OD600nm为20左右时。由图17可知,胞内酶活在加入诱导剂后2h便迅速增加,在14~34h左右酶活力增长趋于平缓,在62h左右酶活力达到最高,最高为(10957.97±58.03)U/mL;胞外酶活在加入诱导剂后25h左右迅速增加,在45h左右达到最高,最高为(645.27±13.87)U/mL;总酶活力在62h左右达到最高,达到(11583.35±70.21)U/mL,比摇瓶发酵下提高了7倍左右。
由于是在25℃诱导,因此菌体的生长速度明显不如在37℃培养时,且生长周期大大延长,OD600nm最大值为66左右。在14~34h左右时,酶活力增加不明显,但是菌体量增长迅速,原因可能是菌体此段时间主要进行分裂生长,即甘油的利用率远远大于乳糖的利用率,致使乳糖的诱导效率明显降低。
与LB培养基相比,利用TB培养基在7L发酵罐中发酵时,重组菌的酶活力提升幅度较理想,因此,如果将重组大肠杆菌BL21(DE3)/pET28a-plcH应用于工业化生产,TB (无缓冲液)培养基是较理想的培养介质。
3 讨 论
利用TB-TH培养基,对E. coli BL21(DE3)/pET28a-plcH进行了摇瓶发酵条件的优化。诱导剂为IPTG的情况下,确定的最优产酶条件为:5%转接量,250mL三角瓶装液量为50mL,卡那霉素的质量浓度150μg/mL,37℃、200r/min培养6h时添加IPTG至终浓度为0.6 mmol/L,25℃、150r/min诱导培养20h,酶活力可达到(794.01±24.84)U/mL;诱导剂为乳糖的情况下,确定的最优产酶条件为:5%转接量,250mL三角瓶装液量为50mL,卡那霉素的质量浓度150μg/mL,37℃、200r/min培养6h时添加乳糖至终质量浓度为5g/L,25℃、150r/min诱导培养22h,酶活力可达到(1422.42±37.17)U/mL,较IPTG诱导条件下提高了0.8倍。
进一步考察了添加甘氨酸对E. coli BL21(DE3)/pET28a-plcH产酶的影响。结果显示,在TB-TH培养基中添加甘氨酸对重组菌产酶量的提高无任何促进作用,反而有显著的抑制作用,一定程度上证实了相关文献报道,即某些渗透性物质(例如甘氨酸)可对磷脂酶C的生产有抑制作用[14],这也较好的解释了上述现象。
在7L发酵罐中对E. coli BL21(DE3)/pET28a-plcH进行发酵条件的优化。在加入乳糖后2h胞内酶活力便迅速增加,在14~34h左右酶活力增长趋于平缓,在62h左右酶活力达到最高,最高为(10957.97±58.03)U/mL;胞外酶活在加入乳糖后25h左右迅速增加,在45h左右达到最高,最高为(645.27±13.87)U/mL;总酶活力在62h左右达到最高,达到(11583.35±70.21)U/mL,比摇瓶发酵下提高了7倍左右。
P. aeruginosa含有多个与编码磷脂酶C有关的基因,基于课题组前期研究,选择重组表达具有溶血活性的plcH的大肠杆菌BL21 (DE3)/pET28a-plcH在实验室规模进行发酵条件的优化,并在7L发酵罐中进行了工艺验证,获得了(11583.35±70.21)U/mL的高酶活力,为下一步研究磷脂酶C的产业化奠定了较好的基础。
[1] RAMRAKHIANI L, CHAND S. Recent progress on phospholipase:different sources, assay methods, industrial potential and pathogenicity[J]. Applied Biochemistey and Biotechnology, 2011,164: 991-1022.
[2] 陈明铠, 陈蔚, 宋建华, 等. 磷脂酶C对实验性血栓形成和纤溶功能的影响[J]. 中国药理学通报, 2002, 18(4): 477-479.
[3] 宋建华, 陈明铠, 王常高, 等. 磷脂酶C对家兔血小板聚集和超微结构的影响[J]. 中国药理学通报, 2002, 19(4): 481-484.
[4] 王常高, 陈明铠, 高林, 等. 高产磷脂酶C菌株筛选及其抗血小板功能的研究[J]. 天然产物研究与开发, 2003, 15(4): 345-348.
[5] 王鹏飞, 凌宗秀. 磷脂肌醇特异的磷脂酶C与高血压关系的研究进展[J]. 重庆医科大学学报, 2007, 27(3): 364-368.
[6] 宋建华, 陈明铠, 陈涛, 等. 一株高产PLC的CW-W-90-3菌的鉴定[J].微生物学杂志, 2002, 22(2): 10-14.
[7] 高林. 磷脂酶C高产菌株的筛选、鉴定和培养条件的优化研究[D].合肥: 安徽农业大学, 2007.
[8] 李彩风, 陈吉祥. 哈维氏弧菌磷脂酶C的分离纯化及性质研究[D].青岛: 中国海洋大学, 2006.
[9] 王常高, 李伟, 陈涛. Bacillus mycoides磷脂酶C纯化制备研究[J]. 安徽农学通报, 2007, 13(8): 55-56.
[10] 刘菲菲. 蜡状芽孢杆菌磷脂酶C基因在大肠杆菌中的异源表达[D].无锡: 江南大学, 2012.
[11] 赵金星, 张梁, 顾正华, 等. 重组大肠杆菌表达铜绿假单胞菌溶血性磷脂酶C [J]. 微生物学报, 2013, 53(3): 259-268.
[12] BERKA R M, VASIL M L. Phospholipase C (heat-labile hemolysin)of Pseudomonas aeruginosa: purification and preliminary characterization[J]. Journal of Bacteriology, 1982, 152: 239-245.
[13] GUBASH S M. Improved egg-yolk agar plate medium for the detection of clostridial phospholipase C activity[J]. Research in Microbiology, 1991, 142(1): 87-93.
[14] HARRISON J S, KESHAVARZ-MOORE E, DUNNILL P, et al. Factors affecting the fermentative production of a lysozymebinding antibody fragment in Escherichia coli[J]. Biotechnology Bioengineering, 1997, 53(6): 611-622.
[15] BARKER A P, VASIL A I, FILLOUX A, et a1. A novel extracellular phospholipase C of Pseudomonas aeruginosa required for phospholipid chemotaxis[J]. Molecular Microbiology, 2004, 53(4): 1089-1098.
[16] BOYD N A, THOMSON R O, WALKER P D. The prevention of experimental Clostridium novyi and Cl. perfringens gas gangrene in high-veloeity missile wounds by active immunisation[J]. Journal of Medicinal and Microbiology, 1972, 5: 467-472.
[17] OKAWA Y, YAMAGUCHI T. Studies on phospholipases from Streptomyces. III. Purif ication and properties of Streptomyces hachijoensis phospholipase C [J]. Journal of Bacteriology, 1975, 78(3): 537-545.
[18] 侯文婷, 张梁, 顾正华, 等. 产苯丙氨酸解氨酶菌株筛选、重组菌构建及发酵工艺研究[D]. 无锡: 江南大学, 2012.
[19] 夏东翔, 汪美仙. L-异亮氨酸和甘氨酸对大肠杆菌表达与分泌邻苯二酚2,3-双加氧酶的作用[J]. 微生物学报, 1994, 34(1): 37-44.
[20] 郭森, 吴丹, 陈晟, 等. 重组大肠杆菌产角质酶-CBM摇瓶发酵优化及分泌表达研究[J]. 中国生物工程杂志, 2011, 35(9): 55-61.
