谷氨酰胺酶基因原核表达载体的构建与表达
2013-08-07吴拥军吴玉俊刘艳敏
卢 彪,吴拥军*,吴玉俊,罗 熹,刘艳敏
(贵州大学生命科学学院,贵州 贵阳 550025)
谷氨酰胺酶(glutaminase,GA,EC 3.5.1.2)广泛存在于包括细菌、酵母菌、真菌等微生物中,具有γ-谷氨酰基转移能力和谷氨酰胺水解活力。主要水解L-谷氨酰胺成L-谷氨酸和氨,在生物体氮代谢过程中扮演着重要作用,是谷氨酰胺分解的关键酶和限速酶[1-2]。将谷氨酰胺酶作为食品工业用酶己有100多年的历史[3]。谷氨酸被认为是酱、酱油等大豆发酵食品中主要的鲜味物质[4],而谷氨酸形成的钠盐谷氨酸钠(味精)是目前国内外广泛使用的增鲜调味品之一。经调查贵州水豆豉生产企业得知,味精的使用成本约占总成本的25%~30%左右。如能通过安全方式将高活性的GA酶编码基因整合至水豆豉主要发酵菌株枯草芽孢杆菌[5]中并表达其活性,将大量减少味精的添加量降低企业生产成本。
实验室前期已获得豆豉生产菌株BJ3-2[5],其GA酶活性较低;并从高谷氨酰胺酶活性的枯草芽孢杆菌株中克隆了glsA2基因[6]。本研究旨在通过验证glsA2在原核系统中表达GA酶的活力,为今后发酵生产和食品级改良置换BJ3-2的glsA1[6]基因奠定基础。
1 材料与方法
1.1 菌株与质粒
菌株:E.coli BL21(DE3)、E.coli DH5α为本实验室保存。
质粒:pET-32a、pMD18-glsA2为本实验室保存。
1.2 试剂与仪器
质粒提取试剂盒、DNA纯化试剂盒 美国Omega公司;Bacterium Glutaminase Assay Kit 美国Genmed公司;Taq酶、限制性内切酶、T4 DNA连接酶、DNA Marker等 日本TaKaRa公司;其他试剂均为国产分析纯。
MyLycler PCR仪、Universal Hood凝胶成像分析仪、Powerpac HC电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 重组质粒pMD18-glsA2的提取[7]
将含有重组质粒的pMD18-glsA2的E.coli DH5α接种于氨苄青霉素终质量浓度为100μg/mL的5mL LB液体培养基中,37℃、180r/min摇床过夜培养。取2mL菌液使用质粒小量试剂盒进行质粒提取;通过琼脂糖凝胶电泳分析。
1.3.2 表达载体pET32a-glsA2的构建
1.3.2.1 引物设计
根据glsA2基因序列及pET-32a的多克隆位点情况设计引物:Pga F:CGGGATCCATGCAGTGCATTGAAAC(BamHⅠ),Pga R:CGGAATTCTTAGCTCCAACCTTCTTG(EcoRⅠ)[8]。
1.3.2.2 PCR扩增[9]
glsA2基因PCR扩增反应体系为20μL;反应参数为:94℃、5min; 94℃、45s,52℃、40s,72℃、50s,30个循环;72℃延伸8min,4℃保存。
1.3.2.3 pET32a-glsA2的构建
对PCR产物进行琼脂糖凝胶电泳,并利用胶回收试剂盒进行回收。使用BamHⅠ和EcoRⅠ对回收产物及pET-32a进行双酶切,回收的酶切产物以T4 DNA连接酶连接[10],连接产物转化E.coli BL21(DE3)[11]。通过菌落及质粒PCR[12]并质粒酶切鉴定[13],获得重组表达载体pET32a-glsA2。
1.3.2.4 重组表达载体在大肠杆菌中的优化表达
阳性重组子于5mL含100μg/mL氨苄青霉素的液体M9培养基[14-15]中,置37℃培养过夜,取50μL菌液加入50mL含100μg/mL氨苄青霉素的LB液体培养基中37℃、180r/min培养至OD600nm值约为0.6[16]。加入终质量浓度为0.5mmol/L的IPTG进行诱导,诱导时间分别为2、3、4、5、6、7、8、9h[17]。确定最佳诱导时间后再设置0、0.01、0.025、0.05、0.075、0.1、0.25、0.5mmol/L IPTG终浓度进行诱导[18]。
1.3.2.5 SDS-PAGE检测表达情况[19-20]
取诱导后的菌液1mL,12000r/min离心去上清。沉淀悬于100μL SDS上样缓冲液,100℃水浴3min后12000r/min离心取上清点样进行电泳。
1.3.2.6 重组菌株谷氨酰胺酶活力测定
最优诱导表达条件下对重组菌株利用细菌谷氨酰胺酶活性定量检测试剂盒进行酶活力检测。谷氨酰胺酶单位活性定义为:在37℃、pH8.6条件下,每分钟能够转化1μmol谷氨酰胺至谷氨酸所需的酶量作为一个活力单位。
2 结果与分析
2.1 PCR扩增glsA2基因
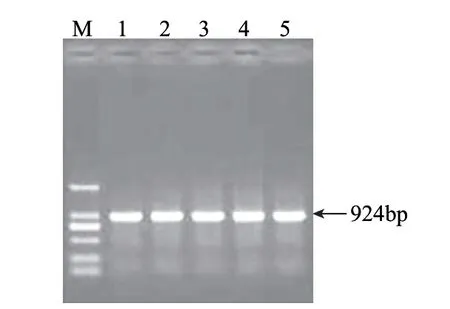
图 1 PCR扩增glsA2基因Fig.1 PCR amplifi cation of glsA2 gene from pMD18-glsA2
由图1可知,PCR扩增产物经1%琼脂糖凝胶电泳检测获得大小约924bp片段,与预期大小一致。
2.2 重组表达载体pET32a-glsA2质粒PCR检测及酶切结果
通过菌落PCR筛选得到的阳性菌株后提取阳性菌株的质粒DNA为模板,通过PCR扩增glsA2基因,结果在924bp处出现一特异性条带,所获得的基因片段大小与glsA2基因大小相吻合,表明目的基因己与表达载体pET-32a发生了重组。
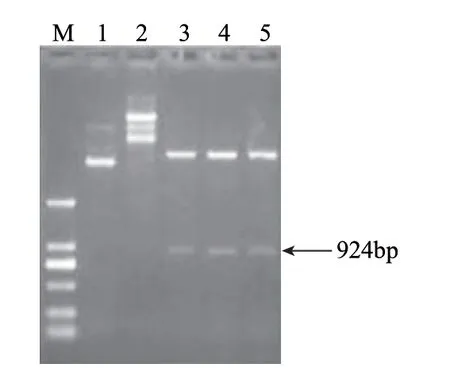
图 2 重组质粒pET32a-glsA2酶切鉴定Fig.2 Restriction digestion of recombinant plasmid pET32a-glsA2 with BamHⅠand EcoRⅠ
由图2可知,通过限制性内切酶对重组子pET32a-glsA2进行双酶切,酶切片段与预期大小一致,表明glsA2基因己插入表达载体pET-32a中,并成功发生了重组,即预期获得重组表达载体pET32a-glsA2重组子。
2.3 IPTG诱导表达优化
2.3.1 最佳诱导时间
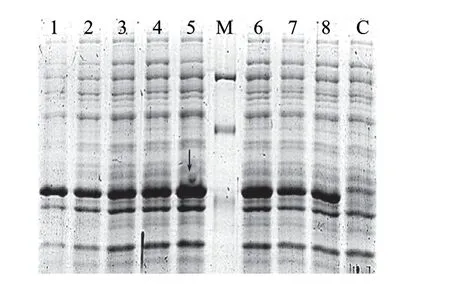
图 3 时间梯度诱导的SDS-PAGE分析Fig.3 Changes in time course of recombinant glutaminase expression in E. coli
将时间梯度诱导的阳性重组子进行SDS-PAGE分析。如图3所示,阳性重组子经诱导后出现特异性目的蛋白条带(箭头所示位置),而在同一位置的空载体未出现条带(泳道C);IPTG诱导时间为6h(箭头所示)时蛋白表达量最高。
2.3.2 最佳IPTG诱导浓度
设置IPTG浓度梯度对重组子6h诱导表达后进行SDSPAGE鉴定。由图4可知,随着IPTG浓度增加目的蛋白表达量也随之增加,当IPTG浓度达到0.1mmol/L时,目的蛋白表达量达到最大(箭头所示条带),随后IPTG浓度继续增加目的蛋白的表达量反而有所降低。
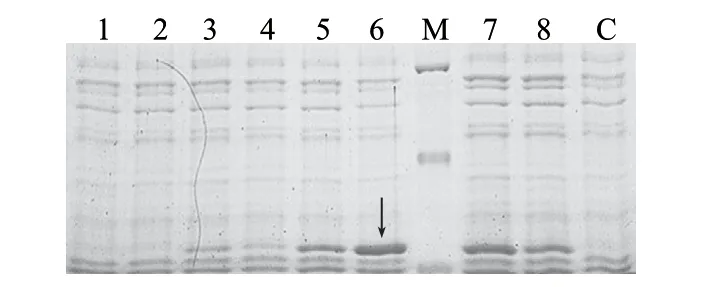
图 4 IPTG浓度梯度诱导的SDS-PAGE分析Fig.4 Expression of recombinant glutaminase induced at gradient concentrations of IPTG
2.4 重组pET32a-glsA2酶活力
在最优诱导条件下对pET-32a、pET32a-glsA2谷氨酰胺酶活力进行测定,两株菌的酶活力分别为40.2、608.2U/μg。重组菌株pET32a-glsA2酶活力约为对照pET-32a/BL21的15倍。
3 讨 论
通过构建谷氨酰胺酶基因glsA2原核表达载体pET32aglsA2,并在E.coli BL21(DE3)中进行优化表达初步确定了其最佳诱导条件。对枯草芽孢杆菌来源的glsA2在大肠杆菌中高谷氨酰胺酶活性的表达进行了验证。
对IPTG诱导浓度进行研究时,最初选用的培养基为LB培养基。但在未添加IPTG时重组蛋白仍然表达,并在SDS-PAGE中出现明显条带。推测原因为LB培养基组分中的胰蛋白胨或酵母提取物中含有乳糖或其类似物,使其在未添加IPTG时仍能促使重组蛋白表达。后来改用成分清晰的M9培养基后再进行实验验证,结果显示在未添加IPTG诱导或添加终浓度小于0.01mmol/L时SDS-PAGE检测不到重组蛋白条带,从而证明推测结果正确。
对影响诱导表达的两个关键因素(诱导时间和IPTG浓度)进行了单因素优化。其他因素如添加IPTG时的菌龄为OD600nm值为0.6及最适培养基等则是参考了pET表达手册的方案,未进行实验验证。
谷氨酰胺酶基因glsA2是从高酶活枯草芽孢杆菌菌株GA317中克隆得到的,可用于食品级菌株的改良。实验对谷氨酰胺酶基因glsA2在E.coli BL21(DE3)中通过原核表达载体pET32a-glsA2进行的酶活力表达进行了验证。高酶活谷氨酰胺酶基因用于食品发酵微生物的改造尚未见报道,如果能实现食品级改良发酵菌株提高其产谷氨酸能力将在食品发酵行业具有较大应用价值。
[1] NANDAKUMARA R, YOSHIMUNEB K, WAKAYAMAC M, et al. Microbial glutaminase: biochemistry, molecular approaches and applications in the food industry[J]. Enzymatic, 2003, 23(9): 87-100.
[2] FRANKENBERGER W T, Jr, TABATABAI M A. L-glutaminase activity of soils[J]. Soil Biology and Biochemistry, 1991, 23(9): 869-874.
[3] KOIBUCHI K, NAGASAKI H, YUASA A, et al. Molecular cloning and characterization of a gene encoding glutaminase from Aspergillus oryzae[J]. Appl Microbiol Biotechnol, 2000, 54(1): 59-68.
[4] 宋美. 大豆分离蛋白水解产物呈鲜味组分的制备及性质研究[D]. 北京: 中国农业大学, 2006.
[5] 贾东旭, 吴拥军, 李耀中, 等. 细菌型豆豉发酵芽孢杆菌的筛选与鉴定[J]. 食品科学, 2009, 30(5): 217-221.
[6] 詹寿年, 吴拥军, 郭倩倩, 等. 高活性谷氨酰胺酶豆豉芽孢杆菌的筛选及glsA基因的克隆[J]. 贵州农业科学, 2011, 39(6): 119-122.
[7] 朱芳, 邓思, 罗立新. 分选酶A在pET32a(+)原核表达载体中的表达和鉴定[J]. 生物技术通报, 2011(6): 219-222.
[8] 闻洁君, 江文正, 郝文丽, 等. HIV-1 nef基因的克隆及原核表达研究[J]. 细胞与分子免疫学杂志, 2010, 26(4): 348-350.
[9] 王文凯, 钟桥, 谢立苹, 等. 幽门螺杆菌cag4蛋白的原核表达、纯化及鉴定[J]. 中国免疫学杂志, 2011, 27(4): 347-351.
[10] 闻洁君, 江文正, 郝文丽, 等. HIV-1 nef基因的克隆及原核表达研究[J]. 细胞与分子免疫学杂志, 2010, 26(4): 348-350.
[11] 吴行伟, 刘泽源, 李前, 等. 质粒pBV220-PTD-tCNTF转化BL2菌株感受态细胞的高效制备方法[J]. 中国药理学通报, 2012, 28(4): 584-587.
[12] 张晓莉, 冯莹颖, 张强, 等. Triton X-100在单菌落PCR技术中的优化作用[J]. 化学与生物工程, 2009, 26(6): 82-85.
[13] 张海峰, 李景荣, 唐丽杰, 等. 重组犬IFN-γ在大肠杆菌中的高效表达[J]. 农业生物技术学报, 2005, 13(5): 639-643.
[14] 刘顺谊, 殷志敏. 重组枯草芽孢杆菌谷氨酰胺合成酶蛋白在改良M9培养基中的诱导表达[J]. 南京师范大学学报: 自然科学版, 2007, 30(4): 74-79.
[15] 王海波, 欧俊杰, 耿信笃. 基因工程菌生产rhG-CSF发酵培养基的研究[J]. 中国生物工程杂志, 2003, 23(11): 68-71.
[16] 张婷婷, 王春丽, 韩蕊莲, 等. 丹参C4H基因pET32a原核表达载体的构建[J]. 西北农林科技大学学报: 自然科学版, 2011, 39(7): 159-162.
[17] 丁岚, 侯晓彦, 王小红, 等. 乳糖诱导葡萄球菌肠毒素A基因在大肠杆菌中的表达[J]. 食品与生物技术学报, 2011, 30(2): 255-260.
[18] 孟凡荣, 司志飞, 刘昊英, 等. 小麦TaMBD2原核表达载体的构建和诱导表达[J]. 植物生理学通讯, 2008, 44(5): 860-864.
[19] 萨姆布鲁克J, 拉塞尔D W. 分子克隆实验指南[M]. 3版. 北京: 科学出版社, 2002: 1229-1236.
[20] 王劼, 蒋思文, 彭健. 重组K88黏附素亚单位蛋白在大肠杆菌中的诱导表达[J]. 农业生物技术学报, 2006, 14(6): 957-962.
