集胞藻PCC6803中S2P蛋白酶假定底物的体外诱导表达及纯化
2013-08-07秦春燕
秦春燕,陈 谷*
(华南理工大学轻工与食品学院,广东 广州 510640)
蓝细菌是一类分布广泛、行光合作用的原核生物,被认为是植物叶绿体的祖先。它是研究光合生物基因表达调控的模式生物[1],其胁迫响应机理一直是该领域的研究热点。当胁迫压力超过一定的阈值时,生物体会感知环境变化并将胁迫信号转导到基因转录区域以调控响应基因的表达,通过激活一系列响应基因的转录、合成特定蛋白、生成特定代谢物来应对胁迫。这个过程涉及跨膜信号转导[2]。蓝细菌基因组中包含9个σ因子[3],不同的σ因子的替换被认为是应对环境或细胞内变化改变基因表达模式的关键。其中SigG、SigH、SigI的功能未知,但被推断为胞外功能σ因子(ECF σ)[3]。细菌中的研究发现大部分负责响应胞外刺激和胁迫压力的ECF σ因子,其活力受到相对应并共转录的跨膜anti-σ因子结合抑制,在外界压力胁迫条件下,金属蛋白酶S2P(Site-2-Protease)在膜切割anti-σ因子跨膜区域解除对σ因子的抑制,启动一系列σ因子识别基因的转录[4-5]。
集胞藻PCC6803中有4个S2P同源蛋白:Sll0862、Slr0643、Sll0528、Slr1821[6],但其功能扑朔迷离。在此前的研究中发现,弱酸胁迫响应条件下(pH6.5),slr0643缺失突变体Δslr0643与野生型(wild type,WT)相比生长停滞,提示Slr0643可能参与这一胁迫响应过程[7],sll0862缺失突变体在氧化和热胁迫响应中出现异常[8],但其作用机理及底物均未明确。通过系统考察各个物种中S2P作用机理和底物特征,并深入分析集胞藻PCC6803的9个σ因子及anti-σ因子,发现了几对σ因子和anti-σ因子的组合:SigE-ChlH(Slr1055)[9]、SigI(Sll0687)-Sll0688、SigG(Slr1545)-Slr1546及SigH(Slr0856)-Sll0857。这些anti-σ因子是否作为S2P底物被S2P剪切,从而介导胁迫信号级联转导呢?这是个非常有趣的问题。此外,文献报道S2P对底物的剪切发生在S1P切割之后,且S2P剪切底物的效率受底物(跨膜蛋白anti-σ因子)的羧基端氨基酸影响[10]。例如,在体外大肠杆菌S2P蛋白酶(RseP)不能直接切割其底物RseA全长,但能有效切割其底物的截短片段RseA△(1~140)[10-12]。
故而通过体外重组系统,诱导表达并纯化几个可能的S2P底物,包括全长及截去羧基端部分序列的截短片段:Slr1055及Slr1055△(1~232)、Sll0688及Sll0688△(1~152)、Slr1546及Slr1546△(1~174)、Sll0857及Sll0857△(1~101)和RseA(1~148)[10],为构建体外酶切体系,验证S2P与anti-σ因子之间酶与底物的关系提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
集胞藻PCC6803(Synechocystis sp. PCC6803) 美国模式培养物集存库;大肠杆菌(Escherichia coli)DH10B、BL21(CE3) 日本TaKaRa公司;pET-30b(+)质粒 美国Novagen公司。
1.1.2 试剂与仪器
限制性内切酶BamHⅠ、XhoⅠ、NdeⅠ、EcoRⅠ、HindⅢ、T4 DNA连接酶、蛋白质Marker 加拿大Fermentas公司;Pfu DNA聚合酶、质粒DNA提取试剂盒及胶回收试剂盒 日本TaKaRa公司;DNA Marker 广州东盛生物科技有限公司;Ni-IDA蛋白纯化树脂 美国Novagen公司;胰蛋白胨、酵母粉、乳糖、IPTG、丙烯酰胺、甲叉双丙烯酰胺、四甲基二乙胺 美国Sigma公司;PCR仪iCycle、电泳装置 美国Bio-Rad公司;UV2300紫外分光光度计 上海天美科学仪器有限公司;其余试剂均为国产分析纯或生化试剂。
1.1.3 培养基
LB培养基:胰蛋白胨10g/L、酵母粉5g/L、NaCl 10g/L,调节pH 7.0;32Y培养基:酵母粉32g/L、胰蛋白胨8g/L、甘油0.5%、NaCl 100mmol/L、Tris-HCl 10mmol/L(pH7.6);M9培养基:Na2HPO430g/L、KH2PO415g/L、 NH4Cl 5g/L、葡萄糖2g/L、硫胺素500μg/L。
1.2 重组质粒的构建
1.2.1 引物合成
在Cyanobase数据库中(http://genome.kazusa.or.jp/cyanobase/ Synechocystis)获取slr1055、slr0688、slr1546、slr0857及其片段基因序列,采用Primer 5软件设计引物(表1)。引物由上海英骏生物技术有限公司广州分公司合成。

表 1 PCR扩增所用的引物Table 1 PCR primers used for DNA amplification
1.2.2 PCR扩增
采用改进的CTAB法提取集胞藻PCC6803基因组DNA,以其为模板进行PCR扩增。反应体系:0.5μL PrimeSTARTMHS DNA Polymerase、10μL PCR Buffer(Mg2+plus)、4μL dNTPs、1μL基因组模板,上下游引物各1μL(10μmol/L),ddH2O补足体积至50μL。反应条件:94℃、3min,98℃、10s,58℃、15s,72℃、2min,72℃、5min。反应30个循环,取5μLPCR产物,经1%琼脂糖凝胶电泳进行鉴定。
1.2.3 构建重组质粒
将PCR产物和pET-30b(+)载体经相应的内切酶酶切,回收目的基因和载体片段,经T4 DNA连接酶22℃、10min连接后再经16℃连接过夜,取连接产物,转化感受态E.coli DH10B。次日挑取单克隆,利用快速筛选法、PCR验证、质粒双酶切鉴定筛选阳性克隆,并送上海英骏生物技术有限公司广州分公司进行DNA测序,鉴定正确的质粒分别命名为pF1055(CG80-A/CG80-B)、pF1055△(CG80-A/Q7)、pF0688(CG92-A/CG92-B)、pF0688△(CG92-A/Q4)、pF1546(CG93-A/CG93-B)、pF1546△(CG93-A/Q5)、pF0857(Q6-A/Q6-B)、pF0857△(Q6-A/Q6)、pFRseA(CG94-A/CG94-B)。
1.3 集胞藻6803中S2P蛋白酶假定底物的诱导表达和表达产物的分离纯化
1.3.1 Slr1055及Slr1055△、Sll0688及Sll0688△、Slr1546及Slr1546△、Sll0857及Sll0857△和RseA(1~148)诱导表达
将鉴定正确的重组质粒p F 1 0 5 5、p F 1 0 5 5 △、pF0688、pF0688△、pF1546、pF1546△、pF0857、pF0688△、pFRseA均转化感受态E.coli BL21(CE3),铺至含50μg/mL卡那霉素(Kana)的LB培养皿上,次日,挑选单菌落,接种至5~10mL含有相应抗生素的LB液体培养基中,37℃培养过夜。按照1%接种量将过夜培养的菌液接种至10mL含相应抗生素的不同培养基(LB、32Y、M9)中,待菌液生长至A600nm至1.0左右时,加入IPTG或α-乳糖至不同的终质量浓度,不同温度下诱导表达过夜。取样进行SDS-PAGE分析,以诱导前的菌液作为对照,进行同样操作。
1.3.2 诱导表达产物的分离纯化
收集100mL诱导表达的菌体,加入10mL结合缓冲液(0.5mol/L NaCl、20mmol/L Tris-HCl、5mmol/L咪唑,pH7.9),冰浴超声裂解细胞(工作3s,间隔3s,功率250W)至澄清透明,4℃收集菌体,16100×g离心20min,收集上清经0.45μm滤膜过滤,调节pH值至7.9。用IDA His Bind树脂直接纯化上清中的目的蛋白,用不同浓度的咪唑溶液梯度洗脱,纯化产物经SDS-PAGE分析检测浓度和分子质量,纯化蛋白样品保存于-80℃备用。
2 结果与分析
2.1 重组质粒的构建
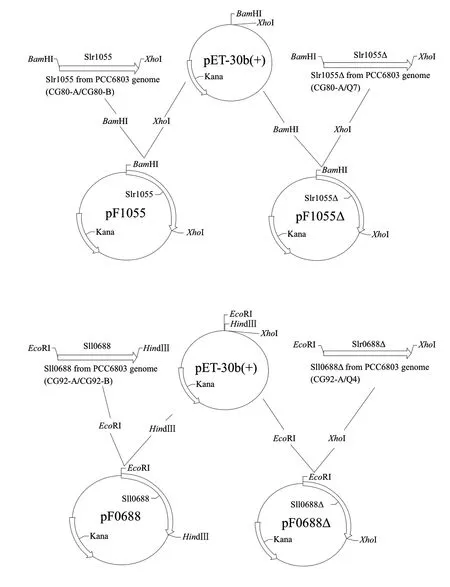
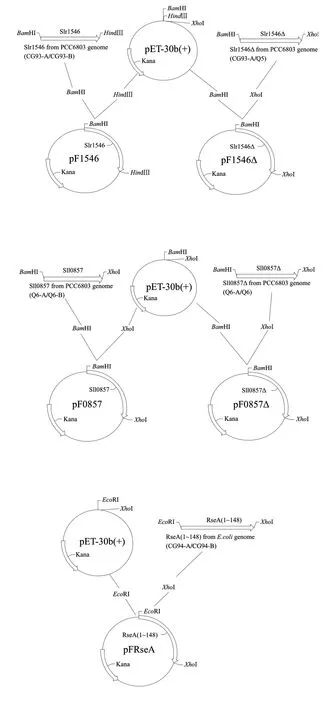
图 1 重组质粒构建流程图Fig.1 Flow chart of the construction of recombinant plasmids
以表1相应的引物从集胞藻PCC6803基因组中扩增出相应的目的基因并连接到pET-30b(+)载体中,构建流程见图1。用快速筛选法筛选阳性菌落进行PCR及酶切鉴定(图2)。鉴定正确的质粒进行了测序鉴定,确保目的片段正确插入pET-30b(+)中。
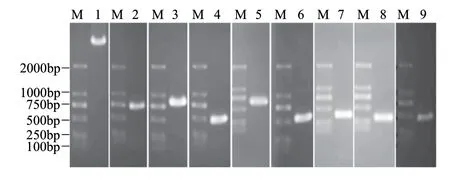
图 2 重组质粒PCR产物的鉴定Fig.2 Identifi cation of recombinant plasmids
2.2 集胞藻PCC6803中S2P假定底物诱导表达条件的优化
2.2.1 RseA重组蛋白表达条件优化
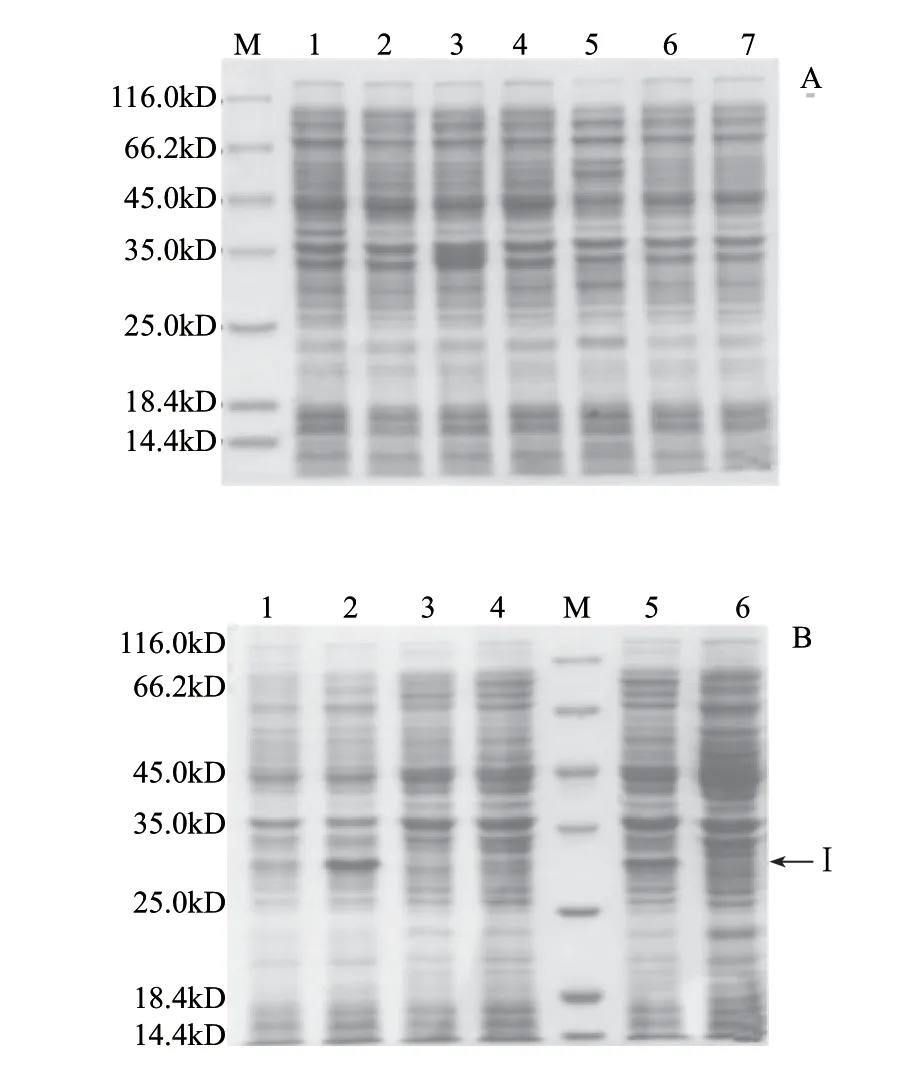
图 3 重组蛋白RseA的诱导表达Fig.3 Induced expression of putative substrates of RseA
由于大肠杆菌中S 2 P 蛋白酶R s e P 底物的R s e A (1~148)是大肠杆菌体内的蛋白,表达过程中容易被体内蛋白酶降解,故其诱导表达具有一定难度。实验通过对IPTG浓度、培养基及温度等条件的优化,成功诱导出RseA蛋白(图3A、B)。并得到RseA最佳诱导表达条件:32Y培养基中添加0.2mmol/L IPTG在22℃条件下诱导10h(图3B泳道2)。
2.2.2 Slr1546△重组蛋白表达条件优化
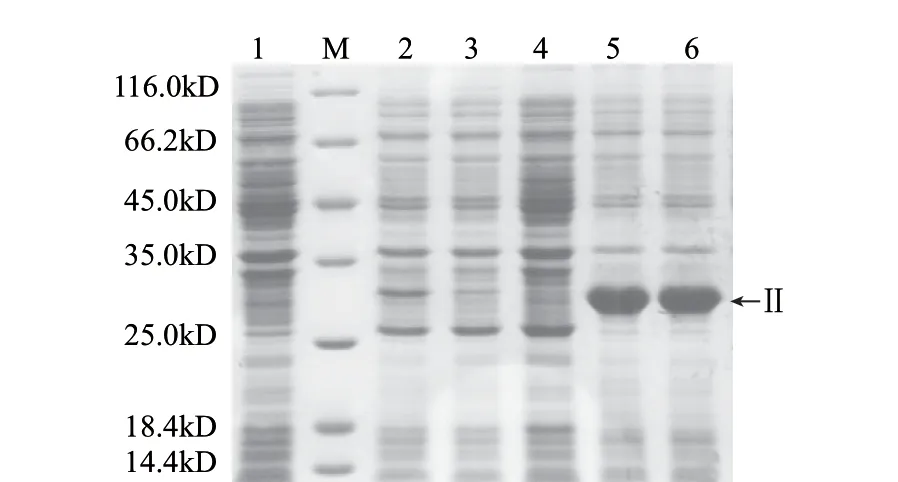
图 4 重组蛋白Slr1546Δ的诱导表达Fig.4 Induced expression of putative substrates of Slr1546Δ
由图4可知,诱导表达时间对Slr1546△重组蛋白的表达影响较大,最优表达条件为LB培养基中添加0.4mmol/L IPTG在37℃条件下诱导10h以上(泳道5、6)。
2.2.3 Sll0688△重组蛋白表达条件优化
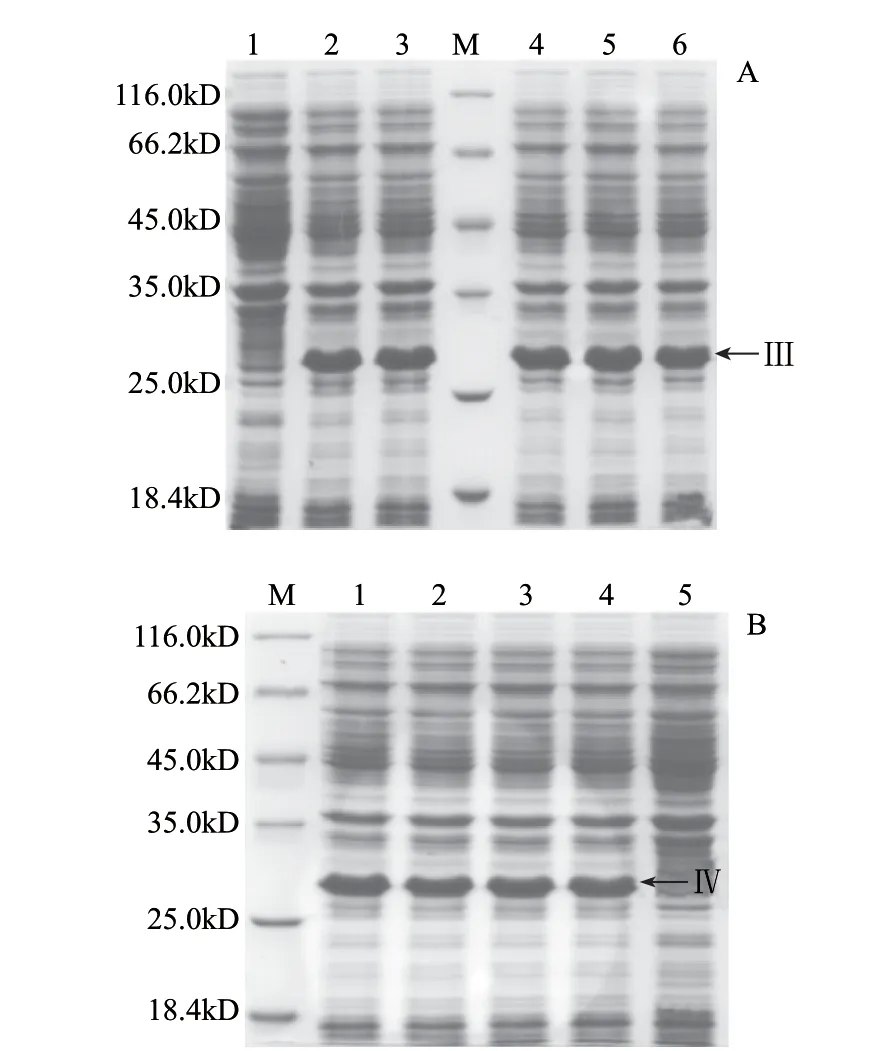
图 5 重组蛋白Sll0688Δ的诱导表达Fig.5 Induced expression of putative substrates of Sll0688Δ
由图5可知,在LB、32Y培养基中添加0.4mmol/L IPTG在37℃条件下诱导8h以上Sll0688△重组蛋白均可得到高效表达。
2.2.4 Sll0857与Sll0857△重组蛋白表达条件优化
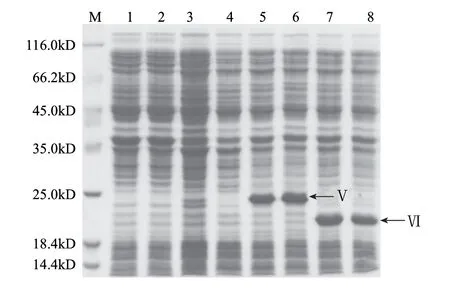
图 6 重组蛋白Sll0857及Sll0857Δ的诱导表达Fig.6 Induced expression of putative substrates of Sll0857 and Sll0857Δ
由图6可知,Sll0857 and Sll0857△重组蛋白诱导表达条件为:32Y培养基中添加0.4mmol/L IPTG在37℃条件下诱导8h以上。
2.2.5 Slr1546与Sll0688重组蛋白表达条件优化
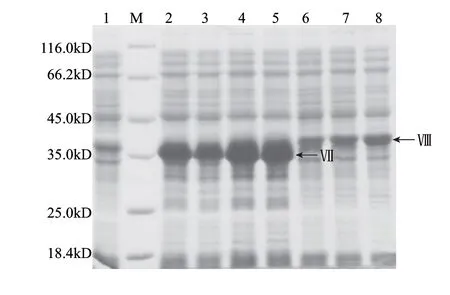
图 7 重组蛋白Slr1546及Sll0688的诱导表达Fig.7 Induced expression of putative substrates of Slr1546 and Sll0688
由图7可知,在32Y培养基中添加0.4mmol/L IPTG在37℃条件下诱导8h以上,Slr1546及Sll0688重组蛋白均能得到有效表达。
2.2.6 Slr1055与Slr1055△重组蛋白表达条件优化
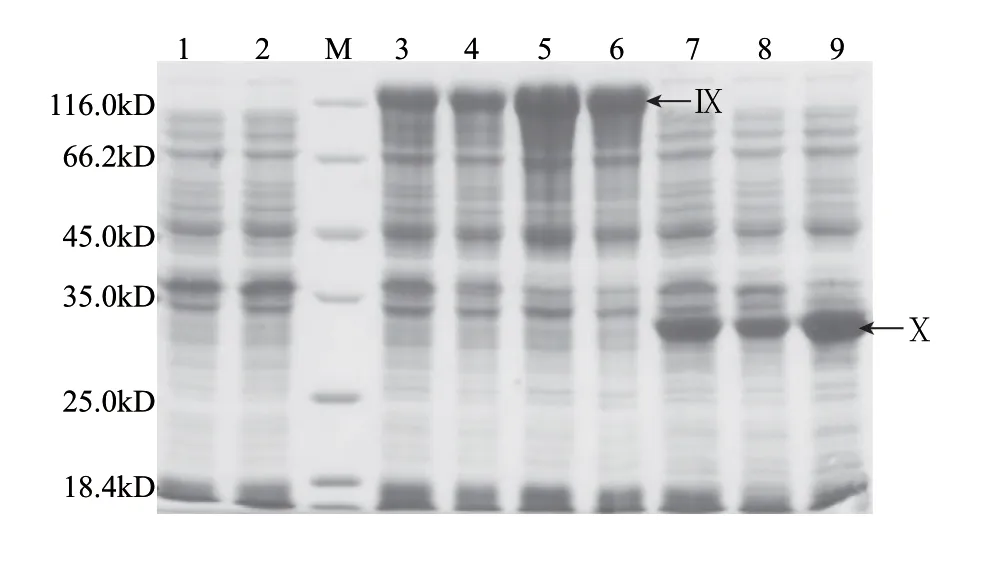
图 8 重组蛋白Slr1055及Slr1055Δ的诱导表达Fig.8 Induced expression of putative substrates of Slr1055 and Slr1055Δ
由图8可知,在32Y培养基中添加0.4mmol/L IPTG在37℃条件下诱导8h以上,Slr1055及Slr1055△重组蛋白均能得到有效表达。
2.3 S2P假定底物的诱导表达
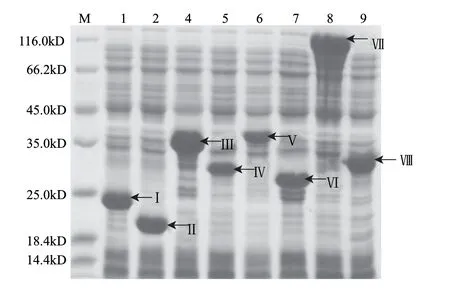
图 9 S2P假定底物的诱导表达Fig.9 Induced expression of putative substrates of site-2-proteases
由上述实验可知,成功诱导表达了各个假定底物:Slr1055及Slr1055△(1~232)、Sll0688及Sll0688△(1~152)、Slr1546及Slr1546△(1~174)、Sll0857及Sll0857△(1~101)。
2.4 集胞藻PCC6803中S2P假定底物的表达纯化
之前对△slr0643(slr0643缺失突变体)与野生型的弱酸胁迫响应差异进行了基因芯片分析[6],发现Slr0643很可能通过基因簇sll0856-sll0857-sll0858,控制Sigma因子(σH,Sll0856)的表达,即Slr0643/Sll0857/SigH通过S2P/antisigma factor/sigma factor 的级联信号转导模式调控酸胁迫下基因的转录[6]。因此首先重点纯化了Sll0857以及其片段Sll0857△,得到纯度较高的重组蛋白,如图10所示。
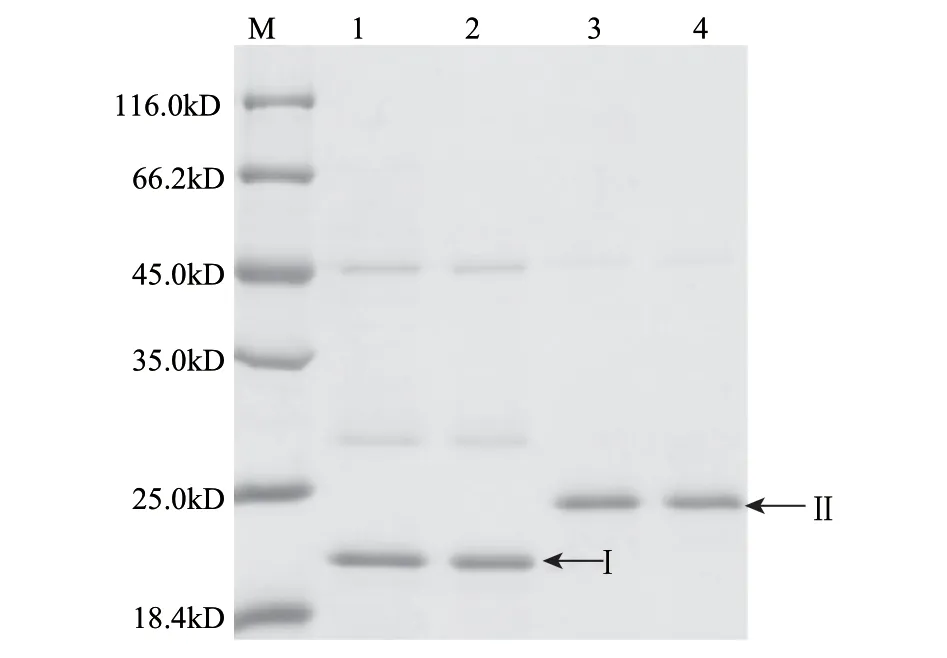
图 10 重组蛋白Sll0857、Sll0857Δ的表达纯化Fig.10 Purifi cation of Sll0857 and Sll0857Δ
而后用最优条件诱导表达,并纯化了几个可能的底物全长及片段:Slr1055及Slr1055△(1~232)、Sll0688及Sll0688△(1~152)、Sll1546及Sll1546△(1~174)、RseA,如图11所示。
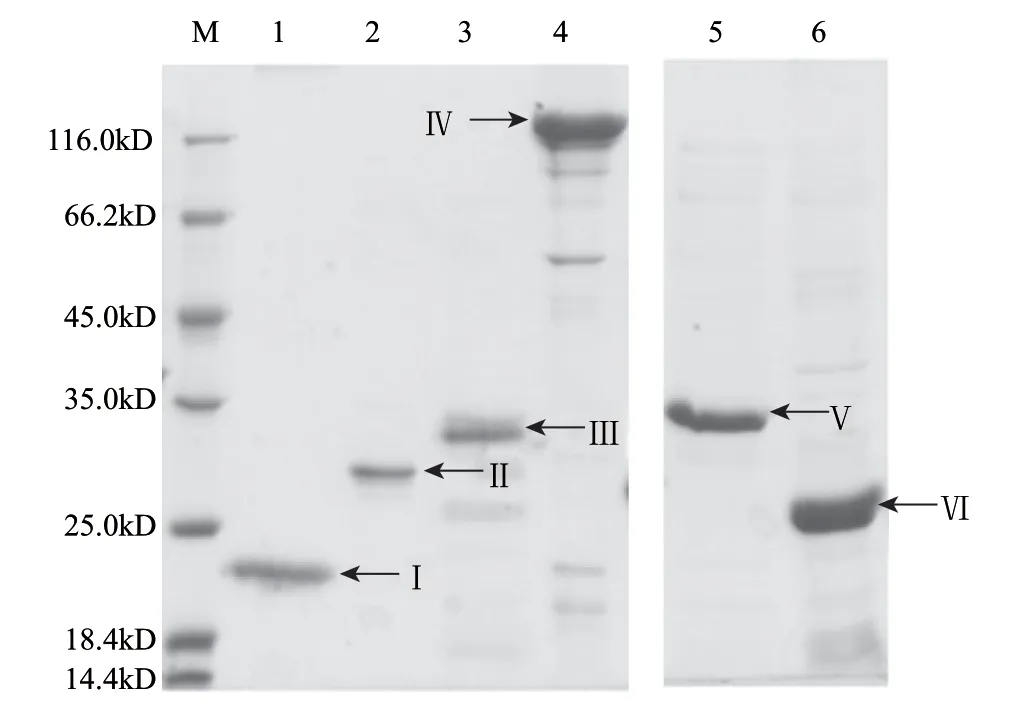
图 11 S2P假定底物的纯化Fig.11 Purifi cation of putative substrate of site-2-protease
3 讨 论
前期工作已经成功证实集胞藻PCC6803中的S2P蛋白酶Slr0643和Sll0862参与多种胁迫响应[14-16],但是揭开它们的具体机制有赖于找到S2P的底物。此前成功在体外重组表达了Slr0643及Sll0862,并揭示它们能在体外切割β-Casein[6]具有蛋白酶活性。本研究通过系统考察各个物种中S2P作用机理和底物特征,深入分析集胞藻PCC6803的9个σ因子及anti-σ因子,锁定了4对σ因子和anti-σ因子的组合:SigE-ChlH(Slr1055)[9]、SigI(Slr0687)-Sll0688、SigG(Slr1545)-Slr1546及SigH(Slr0856)-Sll0857。通过构建于pET载体,优化诱导表达条件,成功地获得8个S2P假定底物:包括全长的anti-σ因子及其截断的片段。
近年来,光合生物S2P的功能颇受关注。例如,AMOS1/EGY1介导了拟南芥应答铵盐胁迫的响应,并与脱落酸信号调控通路相关,参与维持铵盐胁迫下叶绿体的完整结构和功能[17]。但其具体的机理却有待揭开S2P的底物才能完整解释。依据其他生物体中S2P的研究结果,在正常生长条件下,σ因子被anti-σ因子束缚在膜上,无法识别并与RNA聚合酶的核心酶结合,故其无法调控相应基因的转录;当胁迫信号刺激启动S2P级联信号转导,anti-σ因子将先后被S1P和S2P剪切,释放所束缚的σ因子到核区,启动其调控的基因簇转录。迄今为止,锁定集胞藻PCC6803中的4对σ因子和anti-σ因子的组合,是光合生物研究中的首个关于S2P底物的研究。通过重组表达纯化4个anti-σ因子及其截短片段,下一步将在体外重构S2P与假定底物之间的酶切体系,考察酶与底物的相互关系。当然,集胞藻PCC6803中4个S2P蛋白酶:Sll0862、Slr0643、Sll0528、Slr1821均含有多个跨膜区域、导致其表达纯化非常困难。下一步实验将进一步优化表达纯化这4个S2P蛋白酶的条件,获取更多有活性的蛋白酶,来构建体外酶切体系,为阐释蓝藻体内S2P介导的级联信号转导机制提供进一步证据。
[1] ANGERMAYR S A, HELLINGWERF K J, LINDBLAD P, et al. Energy biotechnology with cyanobacteria[J]. Curr Opin Biotechnol, 2009, 20(3): 257-263.
[2] LOS D A, ZORINA A, SINETOVA M, et al. Stress sensors and signal transducers in cyanobacteria[J]. Sensors (Basel), 2010, 10(3): 2386-2415.
[3] IMAMURA S, ASAYAMA M. Sigma factors for cyanobacterial transcription[J]. Gene Regul Syst Bio, 2009, 3: 65-87.
[4] HEINRICH J, WIEGERT T. Regulated intramembrane proteolysis in the control of extracytoplasmic function sigma factors[J]. Res Microbiol, 2009, 160(9): 696-703.
[5] CHEN Gu, ZHANG Xu. New insights into S2P signaling cascades: regulation, variation, and conservation[J]. Protein Sci, 2010, 19(11): 2015-2030.
[6] 秦春燕, 张旭, 陈谷. 集胞藻PCC6803中S2P同源蛋白Slr0643及Sll0862金属蛋白酶活性的体外鉴定[J]. 微生物学报, 2012, 52(1): 130-135.
[7] ZHANG Xu, CHEN Gu, QIN Chunyan, et al. Slr0643, an S2P homologue, is essential for acid acclimation in the cyanobacterium Synechocystis sp. PCC 6803[J]. Microbiology, 2012, 158(Pt 11): 2765-2780.
[8] 曾小琳, 闻盼盼, 陈谷. 集胞藻PCC6803中S2P同源蛋白基因sll0862缺失突变株对热胁迫与氧化胁迫的响应[J]. 微生物学报, 2012, 52(5): 594-601.
[9] OSANAI T, IMASHIMIZU M, SEKI A, et al. ChlH, the H subunit of the Mg-chelatase, is an anti-sigma factor for SigE in Synechocystis sp. PCC 6803[J]. Proc Natl Acad Sci USA, 2009, 106(16): 6860-6865.
[10] LI Xiaochun, WANG Boyuan, FENG Lihui, et al. Cleavage of RseA by RseP requires a carboxyl-terminal hydrophobic amino acid following DegS cleavage[J]. Proc Natl Acad Sci USA, 2009, 106(35): 14837-14842.
[11] ALBA B M, LEEDS J A, ONUFRYK C, et al. DegS and YaeL participate sequentially in the cleavage of RseA to activate the sigma(E)-dependent extracytoplasmic stress response[J]. Genes Dev, 2002, 16(16): 2156-2168.
[12] AKIYAMA Y, KANEHARA K, ITO K. RseP (YaeL), an Escherichia coli RIP protease, cleaves transmembrane sequences[J]. EMBO J, 2004, 23(22): 4434-4442.
[13] GORDON E, HORSEFIELD R, SWARTS H G, et al. Effective highthroughput overproduction of membrane proteins in Escherichia coli[J]. Protein Expr Purif, 2008, 62(1): 1-8.
[14] 张旭. 集胞藻6803中蛋白酶Slr0643的功能分析[D]. 广州: 华南理工大学, 2012.
[15] 闻盼盼. 集胞藻6803中S2P同源蛋白的定位与功能初探[D]. 广州: 华南理工大学, 2012.
[16] 曾小琳. 集胞藻PCC6803中S2P同源基因sll0862缺失突变体的胁迫响应研究[D]. 广州: 华南理工大学, 2012.
[17] LI Baohai, LI Qing, XIONG Liming, et al. Arabidopsis plastid AMOS1/EGY1 integrates abscicic acid signaling to regulate global gene expression response to ammonium stress[J]. Plant Physiology, 2012, 160(4): 2040-2051.
