内含肽介导谷氨酰胺转胺酶酶原的活化
2013-08-07堵国成周哲敏
杜 坤,周 丽,堵国成,陈 坚,2,周哲敏,*
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122)
谷氨酰胺转胺酶(transglutaminase,TGase,EC 2.3.2.13)是一种能够催化酰基转移反应的酶。它可以催化谷氨酰胺残基的γ-羧酰胺基与各种酰基受体发生反应,实现蛋白质分子内、分子间发生交联,从而极大地改变蛋白质的性质[1]。因此谷氨酰胺转胺酶在食品工业有着广泛的应用[1],例如重组肉块,增强和改善食品的风味,延长某些食品的保质期等。另外谷氨酰胺转胺酶在生物医药、组织工程、纺织和皮革工业中也有着广泛的应用前景[2],例如修饰蛋白类药物以延长其半衰期,用于器官再造技术,增强羊毛类和蚕丝类纺织原料的韧性等。
目前,谷氨酰胺转胺酶的生产方法主要有2种:从动物组织中提取和利用微生物发酵法生产[3]。由于从动物组织中提取的TGase价格昂贵,限制了其应用,因而开发微生物发酵生产TGase(microbial tranglutaminase,MTG)的方法成为了研究热点。1989年,日本味之素公司首次在土壤中分离到MTG生产菌株茂原链轮丝菌Streptoverticillium mobaraense S-8112[4]。此后,新的TGase生产菌株不断被发现,包括链霉菌属的 Streptomyces netropsis[5]、Streptomyces hygroscopicus[6],芽孢杆菌属的Bacillus subtilis[7]、Bacillus circulans[8]等。至今,多个来源于链霉菌属(Streptomyces)的MTG已经在大肠杆菌、酵母、链霉菌及谷氨酸棒杆菌等宿主中成功表达[9],且大部分以酶原的形式(pro-MTG)。链霉菌来源的MTG在异源表达过程中存在两个问题:直接表达成熟酶基因,基本以包涵体的形式存在[10],且包涵体复性成本高,不利于工业化生产;pro-MTG需要蛋白酶活化,外加蛋白酶会增加MTG的分离纯化成本,同时外加蛋白酶可能会降解MTG以及其作用的底物[11]。因此需要探索简易、高效、廉价的MTG制备方法[12]。
蛋白质剪接是一个翻译后自催化加工过程,它不需要酶或其他辅因子的参与。在这个过程中,前体蛋白的内含肽(intein)被切离,其两侧的外显肽(extein)被连接在一起[13]。对Intein进行改造,可以阻断两端外显肽的连接过程,但不影响Intein的N端肽键或C端肽键的断裂。Ssp Dna B mini intein(SMI)是经过改造的微型内含肽,它在pH 6.0~7.5范围内可以实现C端肽键的高效断裂(N端断裂被阻断)[14]。该内含肽介导的蛋白质剪接技术已在蛋白质合成、分离纯化等领域被成功应用,尚未见其应用于酶原蛋白质的成熟过程。
本研究在pro区和MTG之间插入SMI,通过环境pH值的变化来控制MTG的成熟过程,并考察了内含肽的插入对于重组MTG结构和功能的作用。该酶原活化方法避免了添加外源蛋白酶所产生的副作用,具有一定的工业应用前景。
1 材料与方法
1.1 材料与试剂
吸水链霉菌(Streptomyces hygroscopicus) WSH03-13、大肠杆菌(Escherichia coli) BL21(DE3)、JM109、质粒pET22b(+)为本实验室保存;质粒pTWIN1 美国NEB公司。
限制性内切酶NcoⅠ、XhoⅠ、DpnⅠ、Primer STARTMHS DNA Polymerase 日本TaKaRa公司;金属镍亲和层析柱(HisTrap HP(1mL))、阳离子交换层析柱(HiTrap SP HP (1mL)) 美国GE公司;N-CBZ-Gln-Gly 美国Sigma公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 重组质粒构建
根据GenBank数据库中已公布的S.hygroscopicus WSH03-13的pro-MTG基因序列(GenBank登录号:HM231108)设计引物,以S. hygroscopicus WSH03-13总DNA为模版,PTG-up和PTG-down为引物(表1),扩增pro-MTG基因。将PCR产物用NcoⅠ、XhoⅠ进行双酶切,然后连接pET22b(+),构建载体pET-pro-MTG。以pTWIN1为模版,SMI-up和SMI-down为引物(表1),扩增SMI基因。SMI-up和SMI-down的5’端分别与pro区的3’端和MTG的5’端互补配对。以SMI的PCR产物作为引物,pET-pro-MTG为模板,进行全质粒扩增,将所获得PCR产物用DpnⅠ消化甲基化模版pET-pro-MTG后,转化入E. coli JM109中,得到重组质粒pET-proSMIMTG,并将该重组质粒转化E. coli BL21(DE3)表达重组酶。以上所有质粒均经过测序验证。
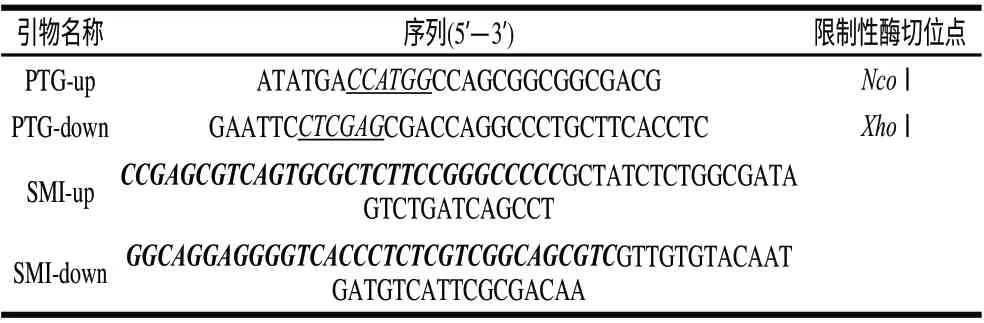
表 1 所涉及的引物Table 1 Primers used in this study
1.2.2 培养条件
TB培养基(蛋白胨12g/L、酵母粉24g/L、甘油4mL/L、KH2PO42.3g/L、K2HPO4·3H2O 16.4g/L)加入终质量浓度为葡萄糖4g/L、乙醇1%、氨苄青霉素50mg/L,将菌株E.coli BL21(DE3)/pET-proSMIMTG在该培养基中,37℃条件下培养至OD600nm达0.6,加入终浓度为0.8mmol/L IPTG,18℃条件下诱导24h。
1.2.3 SMI断裂时间的确定、蛋白纯化及周质空间蛋白的提取
收集E. coli BL21(DE3)/pET-proSMIMTG诱导表达后的菌体,在冰浴条件下超声破碎,1200×g离心10min,收集上清并将其pH值调至7.0,25℃条件下放置一定时间,使内含肽C端断裂,转化proSMIMTG为MTG。接着利用金属镍亲和层析柱HisTrap HP (1mL)和阳离子交换层析柱HiTrap SP HP(1mL)纯化目标蛋白,利用SDS-PAGE凝胶电泳来检测目标蛋白纯度。野生型MTG的纯化方法参照文献[6]。利用渗透压冲击法提取周质空间蛋白,方法参照文献[15]。
1.2.4 圆二色谱
将野生型和重组型的MTG用10mmol/L磷酸钾缓冲液(KPB)稀释至蛋白质质量浓度为0.2mg/mL。目标蛋白的圆二色谱通过MOS-450/AF-CD分光偏振计在25℃条件下测得,吸收池宽0.1cm,扫描波长为190~250nm。平均残基椭圆率[θ]=569.3×θ,θ为测得值,[θ]的单位为(deg·cm2)/dmol。
1.2.5 N末端氨基酸序列测定
采用SDS-PAGE垂直电泳,12%分离胶、5%浓缩胶;电泳缓冲液为Tris-甘氨酸缓冲液(pH8.3,含0.1% SDS);样品缓冲液为0.05mol/L pH8.0 Tris-HCl缓冲液(含2% SDS、5% β-ME、10%甘油和0.02%溴酚蓝);将经过金属镍亲和层析柱HisTrap HP (1mL)和阳离子交换层析柱HiTrap SP HP (1mL)纯化后的MTG样品溶于样品缓冲液中(终质量浓度为0.2mg/mL),于100℃中加热5min, 10000×g离心10min后上样。采用直流恒压电源;浓缩胶电压为60V,分离胶电压为140V,电泳时间为2~3h。电泳结束后,将蛋白胶进行转膜、染色、干燥后,由上海基康生物技术公司进行N末端氨基酸序列的测定。
1.2.6 酶学性质测定
以N-CBZ-Gln-Gly (0~30mmol/L)为底物,用比色法测定重组MTG酶活力。取40μL酶液,37℃预热1min,加入预热的底物(30mmol/L CBZ-Gln-Gly、100mmol/L NH2OH、10mmol/L还原型谷胱甘肽、50mmol/L Tris-HCl (pH 6.0),反应10min后加入40μL终止剂(1mol/L HCl、4%三氯乙酸、5% FeCl3·6H2O),10000×g离心10min,525nm波长处测定上清液的吸光度[6]。一个单位MTG酶活力的定义为:37℃时每分钟催化形成1μmol L-谷氨酸-γ-单羟基肟酸的酶量。测定动力学参数,通过Lineweaver-Burk曲线获得Km和Vmax值。
2 结果与分析
2.1 目标蛋白的表达
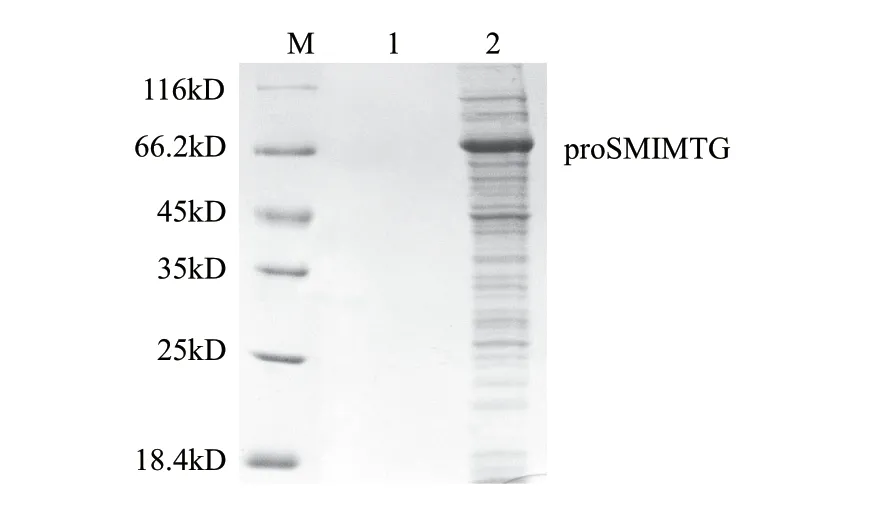
图 1 proSMIMTG的结果表达Fig.1 Expression of proSMIMTG
对E. coli BL21(DE3)/pET-proSMIMTG进行诱导表达,并将乙醇和葡萄糖加入培养基中,以此减少包涵体的形成[16]。由图1可知,重组蛋白proSMIMTG(pro-Intein-MTG)成功实现了可溶表达。大肠杆菌中,pelB信号肽可引导目标蛋白穿过细胞内膜,分泌到周质空间中,进而蛋白质可非特异性地渗漏到细胞外,实现胞外分泌表达。Liu Song等[17]报道,S. hygroscopicus WSH03-13来源的pro-MTG在pelB信号肽的引导下,可以实现胞外分泌表达。在本研究中,借助相同的信号肽,proSMIMTG或重组MTG未分泌到细胞外,而是在周质空间中积累(图2)。此外,在发酵的过程中可检测到MTG的活性,表明周质空间的pH环境可引起SMI发生C端断裂,导致MTG的产生,发酵结束时MTG酶活力为0.09U/mL(菌体浓度稀释至OD600nm为1.0时测得)。据报道,成熟的MTG在Lactococcus lactis体内能够使该菌的细胞壁变厚,使得即使是小分子的肽也不能进入该菌体内[18]。因此推测,发酵过程中非特异性激活的MTG因其交联蛋白的能力,导致大肠杆菌的外膜变厚,从而影响了proSMIMTG从周质空间渗漏到细胞外。
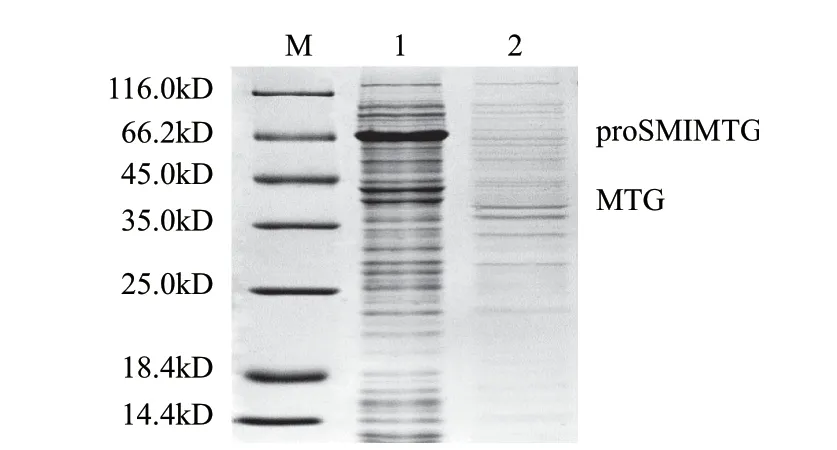
图 2 SDS-PAGE检测周质空间蛋白Fig.2 SDS-PAGE analysis of periplasmic proteins
2.2 SMI断裂时间的确定及目标蛋白的纯化
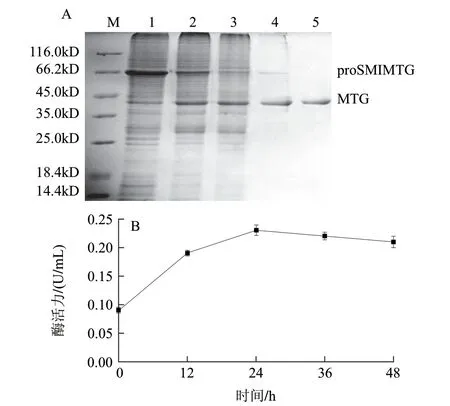
图 3 proSMIMTG断裂时间的确定及重组MTG的纯化Fig.3 Cleavage time of proSMIMTG and the purifi cation of recombinant MTG
SMI的C端外显肽的第1个氨基酸对于其C端断裂过程起着重要的作用。当第1个氨基酸为谷氨酰胺、天冬酰胺、亮氨酸、异亮氨酸、精氨酸、赖氨酸或者脯氨酸时,断裂过程被阻断。为其他氨基酸时则可以发生C端断裂[14]。MTG作为SMI的C端外显肽,且第1个氨基酸为天冬氨酸,因而可以实现SMI的C端断裂。调节细胞破碎上清液pH值至7.0并放置于25℃环境中,SDS-PAGE和酶活力测定显示,proSMIMTG可以在24h内通过SMI的C端断裂完全转化为MTG(图3),且最高酶活力可达0.23U/mL(菌体浓度稀释至OD600nm为1.0时测得)。该结果是在大肠杆菌内将pro区和MTG共表达所得酶活力的1.7倍[19]。
重组MTG经过亲和层析柱Histrap HP (1mL)(重组MTG的C端融合HisTag)和离子交换层析柱HiTrap SP HP (1mL)从放置24h的细胞破碎上清液中纯化获得。
2.3 重组型和野生型MTG的酶学性质

表 2 重组型和野生型MTG的酶学性质比较Table 2 Characterization of wild-type and recombinant MTG
通过比色法测定MTG的活性,研究内涵肽的插入是否影响重组MTG的酶活。由表2可知,重组型MTG的酶比活力为14.3U/mg,Km为69.4mmol/L。该结果和野生型相同。因而内含肽的插入对于MTG的活性没有影响。重组MTG的N末端氨基酸序列测定结果表明,proSMIMTG中SMI的断裂位点与理论断裂位点相同。
2.4 重组型和野生型MTG的二级结构比较
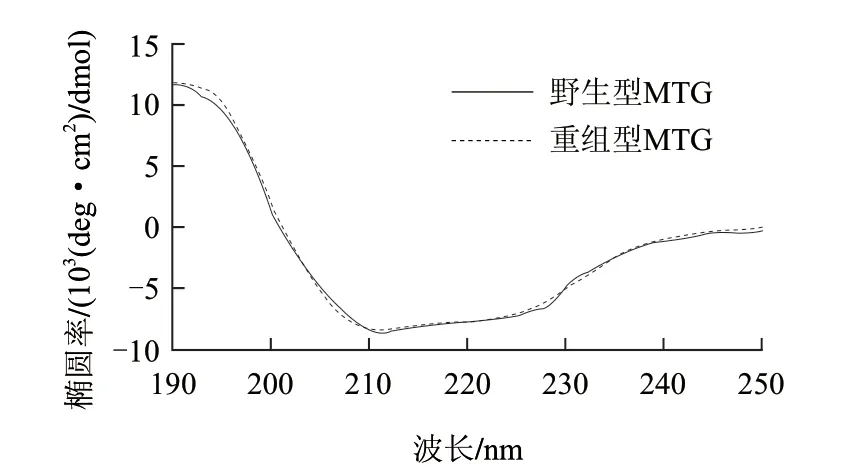
图 4 重组型和野生型MTG的圆二色谱Fig.4 Circular dichroism spectra of recombinant and wild type MTG
为了探究内含肽的插入对于MTG结构的影响,通过圆二色谱对重组型和野生型MTG的二级结构进行比较。实验结果(图4)和二级结构预测结果(表3)显示两者在二级结构上相近,因而可以推测重组型和野生型MTG的空间结构上相似。这表明内含肽的插入对于MTG的结构几乎没有影响。

表 3 重组型和野生型MTG的二级结构组成预测Table 3 Prediction of the secondary structure compositions of wildtype and recombinant MTG
3 讨 论
TGase广泛存在于动物、植物和微生物中,在生命体中发挥着重要的作用。动物中的TGase与血液凝固、伤口愈合、表皮角质化等生物现象有关,且参与信号转导、调节细胞分化、增值等多种功能[20]。植物中的TGase的具体功能还有待探究。微生物中的TGase则主要参与细胞壁的形成、菌丝体的分化等方面[21]。与其他来源的TGase相比,MTG具有不依赖于Ca2+,分子质量适中(23~45kD之间),热稳定性强,pH值稳定范围宽,底物谱广,反应速度快等优势[1]。MTG的生产现状是菌体先分泌出酶原,再利用蛋白酶活化获得MTG。无论是外源添加蛋白酶,还是将pro-MTG和蛋白酶共表达,都不可避免的需要将蛋白酶与MTG进行分离纯化,该过程会增加MTG的生产成本。另外,商品化的MTG在分离纯化过程中很难将蛋白酶完全去除[22],而蛋白酶存在降解MTG以及其作用的底物的可能,这也会限制MTG的应用。本研究通过在pro-MTG的pro区和MTG之间插入内含肽,使得MTG的活化过程变的简便、可控,酶活和圆二色谱结果进一步显示内含肽对于MTG的结构和性能几乎没有影响,更加显示了该方法的优越性。
将pro和MTG进行共表达,同样不需蛋白酶的活化,直接获得有活性的MTG[19,23]。而本研究中表达pro-Intein-MTG,降低了MTG的活性对宿主细胞的伤害,进而MTG的最终酶活力提高为pro和MTG共表达的1.7倍,达到0.23U/mL(菌体浓度稀释至OD600nm为1.0时测得)。同时,在发酵过程中已能检测到MTG的活性,因而MTG很可能因其交联蛋白质的特性对周质空间蛋白的功能产生影响,进而影响宿主的生长、目标蛋白的表达及目标蛋白的渗漏分泌,因此在发酵过程中抑制SMI的C端断裂活性或选用其他裂解调控更加严密的内含肽可能会进一步提高重组蛋白(pro-Intein-MTG)的表达量或实现其胞外分泌。
本方法对于其他酶原类蛋白酶的表达也有一定的借鉴意义。一般蛋白酶以酶原的形式(pro-enzyme)表达,并可以自发水解pro区实现自身的活化[24]。但是当蛋白酶不能够及时分泌到胞外,则有可能因为其水解蛋白质的能力对宿主的生长和蛋白表达产生影响,导致目标蛋白表达量过低。应用本研究方法,则可以控制酶原的成熟过程,避免上述问题,为目标蛋白的高水平表达提供可能。
[1] YOKOYAMA K, NIO N, KIKUCHI Y. Properties and applications of microbial transglutaminase[J]. Applied Microbiology and Biotechnology, 2004, 64(4): 447-454.
[2] ZHU Yang, TRAMPER J. Novel applications for microbial transglutaminase beyond food processing[J]. Trends in Biotechnology, 2008, 26(10): 559-565.
[3] FOLK J E. Transglutaminases[J]. Annual Review of Biochemistry, 1980, 49(1): 517-531.
[4] ANDO H, ADACHI M, UMEDA K, et al. Purification and characteristics of a novel transglutaminase derived from microorganisms[J]. Agricultural and Biological Chemistry, 1989, 53(10): 2613-2617.
[5] YU Yujen, WU Shihcheng, CHAN Hunghsiang, et al. Overproduction of soluble recombinant transglutaminase from Streptomyces netropsis in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2008, 81(3): 523-532.
[6] CUI Li, DU Guocheng, ZHANG Dongxu, et al. Purification and characterization of transglutaminase from a newly isolated Streptomyces hygroscopicus[J]. Food Chemistry, 2007, 105(2): 612-618.
[7] SUZUKI S, IZAWA Y, KOBAYASHI K, et al. Purification and characterization of novel transglutaminase from Bacillus subtilis spores[J]. Bioscience, Biotechnology, and Biochemistry, 2000, 64(11): 2344-2351.
[8] de BARROS SOARES L H, ASSMANN F, ZÁCHIA AYUB M A. Purification and properties of a transglutaminase produced by a Bacillus circulans strain isolated from the Amazon environment[J]. Biotechnology and Applied Biochemistry, 2003, 37(3): 295-299.
[9] ZHANG Dongxu, ZHU Yang, CHEN Jian. Microbial transglutaminase production: understanding the mechanism[J]. Biotechnology and Genetic Engineering Reviews, 2010, 26: 205-221.
[10] LIU Xiaoqiu, YANG Xiuqing, XIE Fuhong, et al. On-column refolding and purification of transglutaminase from Streptomyces fradiae expressed as inclusion bodies in Escherichia coli[J]. Protein Expression and Purifi cation, 2007, 51(2): 179-186.
[11] SOMMER C, HERTEL T C, SCHMELZER C E H, et al. Investigations on the activation of recombinant microbial protransglutaminase: in contrast to proteinase K, dispase removes the histidine-tag[J]. Amino Acids, 2012, 42(2/3): 997-1006.
[12] 刘松, 张东旭, 堵国成, 等. 微生物谷氨酰胺转胺酶的表达及分子改造研究进展[J]. 生物工程学报, 2011, 27(12): 1681-1689.
[13] PAULUS H. Protein splicing and related forms of protein autoprocessing[J]. Annual Review of Biochemistry, 2000, 69: 447-496.
[14] MATHYS S, EVANS T C, CHUTE I C, et al. Characterization of a self-splicing mini-intein and its conversion into autocatalytic N- and C-terminal cleavage elements: facile production of protein building blocks for protein ligation[J]. Gene, 1999, 231(1/2): 1-13.
[15] CHEN Yucheng, CHEN Li’an, CHEN Shujen, et al. A modified osmotic shock for periplasmic release of a recombinant creatinase from Escherichia coli[J]. Biochemical Engineering Journal, 2004, 19(3): 211-215.
[16] STECZKO J, DONOHO G A, DIXON J E, et al. Effect of ethanol and low-temperature culture on expression of soybean lipoxygenase L-1 in Escherichia coli[J]. Protein Expr Purif, 1991, 2(2/3): 221-227.
[17] LIU Song, ZHANG Dongxu, WANG Miao, et al. The pro-region of Streptomyces hygroscopicus transglutaminase affects its secretion by Escherichia coli[J]. FEMS Microbiol Lett, 2011, 324(2): 98-105.
[18] FU Ruiyan, CHEN Jian, LI Yin. Heterologous leaky production of transglutaminase in Lactococcus lactis significantly enhances the growth performance of the host[J]. Appl Environ Microbiol, 2005, 71(12): 8911-8919.
[19] LIU Song, ZHANG Dongxu, WANG Miao, et al. The order of expression is a key factor in the production of active transglutaminase in Escherichia coli by co-expression with its pro-peptide[J]. Microb Cell Fact, doi: 10.1186/1475-2859-10-112.
[20] AESCHLIMANN D, PAULSSON M. Transglutaminases: protein cross-linking enzymes in tissues and body fl uids[J]. Thrombosis and Haemostasis, 1994, 71(4): 402-415.
[21] CHEN Kangkang, ZHANG Dongxu, LIU Song, et al. Improvement of transglutaminase production by extending differentiation phase of Streptomyces hygroscopicus: mechanism and application[J]. Applied Microbiology and Biotechnology, 2012-12-19. (Epub ahead of print).
[22] SPOLAORE B, RABONI S, MOLINA A R, et al. Local unfolding is required for the site-specific protein modification by transglutaminase[J]. Biochemistry, 2012, 51(43): 8679-8689.
[23] YURIMOTO H, YAMANE M, KIKUCHI Y, et al. The pro-peptide of Streptomyces mobaraensis transglutaminase functions in cis and in trans to mediate efficient secretion of active enzyme from methylotropic yeasts[J]. Bioscience Biotechnology and Biochemistry, 2004, 68(10): 2058-2069.
[24] SHINDE U, INOUYE M. Intramolecular chaperones: polypeptide extensions that modulate protein folding[J]. Seminars in Cell & Developmental Biology, 2000, 11(1): 35-44.
