核桃蛋白源血管紧张素转化酶抑制剂的分离纯化
2013-08-07侯雅坤王建中
顾 欣,李 迪,侯雅坤,崔 洁,王建中,*
(1.北京林业大学生物科学与技术学院,北京 100083;2.林业食品加工与安全北京市重点实验室,北京 100083;3.河北化工医药职业技术学院,河北 石家庄 050026)
血管紧张素转化酶(angiotensin Ⅰ-converting enzyme,ACE)是肾素血管紧张素系统中的关键酶,它能催化血管紧张素Ⅰ转化成促血管收缩的血管紧张素Ⅱ,并且能使促进血管扩张的缓激肽失活[1]。ACE抑制剂的来源很多,最早的天然ACE抑制剂是从蛇毒液中发现的[2]。目前,食物源蛋白源的ACE抑制剂大致可以分为3类:动物来源、发酵食品来源和植物来源。动物蛋白源的ACE抑制剂主要由水产品蛋白和畜禽肌肉蛋白水解得到,如从沙丁鱼[3]、金枪鱼[4]、中国毛虾[5]、鲣鱼[6]、猪骨骼肌[7]水解物中都发现了具有新的氨基酸序列的ACE抑制肽。发酵食品来源的ACE抑制剂主要是通过乳酸菌发酵得到。Nakamura等[8]研究了发酵产品中发酵乳的抗高血压效应,该发酵乳是由常用的16种乳酸菌发酵制备而成。Nielsen等[9]发现来自于多种乳酸菌的蛋白酶水解乳蛋白也可释放出ACE抑制肽,这些乳酸菌大部分用于发酵乳制品的生产。Saito等[10]从清酒和酒糟中分离出9种ACE抑制肽,并通过实验探索了肽的结构特点。植物蛋白源来源广泛,价格低廉,因此成为制备ACE抑制肽的较好选择。早在1991年,Miyoshi等[11]就从天然α-玉米蛋白嗜热菌蛋白酶水解物中分离出ACE抑制作用的短肽。植物蛋白源ACE抑制剂以豆类为来源的研究较多。以大豆多肽为例,张国胜等[12]以大豆分离蛋白为原料,选用4种蛋白酶对大豆蛋白进行水解并比较水解产物对ACE的抑制效果,最终得到IC50值为0.846mg/mL的水解液。Shin等[13]从豆浆中分离一种三肽,并将该三肽连续注射SHR鼠,在多次注射后SHR鼠血压明显降低。许慧娇等[14]仅研究出核桃蛋白酶解物有一定的抑制ACE作用并未行进进一步的分离纯化。中国是核桃生产最大的国家,核桃制油后废弃了大量的核桃渣,采用核桃渣为原料开发核桃蛋白肽,原料非常丰富,价格低廉。本研究希望能利用核桃粕,分离纯化核桃蛋白水解物中的多肽,并通过体外测定ACE抑制活性的方法筛选,最终期望得到高活性的ACE抑制剂。
1 材料与方法
1.1 材料、试剂与仪器
核桃粕由河北晶果果业有限责任公司提供。
胃蛋白酶、马尿酰组氨酰亮氨酸(Hip-His-Leu,HLL)、血管紧张素转化酶(ACE)、Sephadex G-25葡聚糖凝胶 美国Sigma公司;乙腈、三氟乙酸、氢氧化钠、盐酸、磷酸氢二钠、磷酸二氢钠等均为国产分析纯。
CXG-1电脑层析柜 上海沪西分析仪器厂有限公司;Sephadex G-25 Medium柱(1.6cm×60cm) 美国Pharmacia公司;PPSQ-31A全自动蛋白/多肽序列仪 日本Shimadzu公司。
1.2 核桃蛋白的制备[15]
室温下将核桃粕粉用石油醚浸泡脱脂,反复几次至脱油彻底,置于通风处晾干,过80目筛,得到脱脂核桃粉,真空包装,于4℃条件下保存。
称取一定质量的脱脂核桃粕粉,加入适量去离子水,脱脂核桃粕粉与水液料比为12:1(V/m),超声细胞破碎处理30min。样品溶液保持反应体系温度为65℃,用1mol/L NaOH溶液调至pH9.0,提取4h后,终止反应,4000r/min离心20min,取上清液,用1mol/L HCl调节至等电点(PI)4.5进行酸沉,静置一段时间后,5000r/min离心15min,取沉淀,用去离子水洗沉淀至中性,迅速真空冷冻干燥,于-20℃保存。
1.3 核桃蛋白水解物的制备[16]
用胃蛋白酶对核桃蛋白进行水解,水解条件为:将10g核桃蛋白粉溶于200mL去离子水中,配制成液料比为20:1(V/m),用1mol/L HCl调至最适pH 3.0,加酶量为0.04g/g样品,并维持反应体系温度55℃,水解时间4h。水解之后,样品置于90℃水浴中灭酶30min。灭酶后将样品离心(5000r/min、20min,4℃),上清液调至pH7.0,冷冻干燥后于-20℃保存。
1.4 核桃蛋白水解物的分离纯化
1.4.1 超滤
胃蛋白酶水解物在4℃条件下经不同分子质量大小的超滤膜(截留分子质量:10000、5000D)获得具有不同分子质量的滤液,得到分子质量大小范围为0~5kD、5~10kD的滤液。将不同分子质量范围的滤液迅速真空冷冻干燥,并置于-20℃保存。
1.4.2 Sephadex G-25柱层析
具有高ACE抑制活性的冻干粉溶解在5mL 10mmol/L Tris-HCl(pH7.0,内含150mmol/L NaCl)中,并经脱气及0.22μm膜过滤处理,然后经CXG-1电脑层析柜进行层析纯化。流动相为:10mmol/L Tris-HCl(pH7.0,内含150mmol/L NaCl)。色谱柱条件:Sephadex G-25 Medium柱(1.6cm×60cm),流速为1mL/min,整个设备系统在4℃条件下进行。洗脱峰在280nm波长处进行检测并收集,其活性最高的组分收集液迅速进行真空冷冻干燥,并置于-20℃保存。
1.4.3 SuperdexTMPeptide 10/300 GL柱分离
凝胶过滤分离:高ACE抑制活性的冻干粉用20mmol/L PBS(pH7.0)缓冲液溶解到1mL,并经0.22μm微孔滤膜及脱气处理,然后经AKTA系统凝胶过滤纯化。
流动相为:20mmol/L PBS(pH7.0)。色谱柱条件:SuperdexTMPeptide 10/300 GL柱(10mm×300mm),流速为0.5mL/min。洗脱峰在280nm波长处进行检测并收集,其ACE抑制活性最高的组分收集液迅速进行冷冻干燥,并置于-20℃保存。
1.4.4 反相高效液相色谱(RP-HPLC)纯化
将最高活性组分收集液的冻干粉,溶解于流动相流动相A(V(三氟乙酸):V(水)为0.6:1)中,并经脱气过膜处理,然后经反相高效液相色谱柱进一步分离纯化。色谱柱条件:Zorbax SB-C18柱(4.6mm×250mm),流速为1.0mL/min。色谱柱先用流动相A平衡15min,之后用流动相B(0.05%三氟乙酸-乙腈)0~100%梯度洗脱,洗脱峰在波长214nm处进行检测,收集活性组分,冷冻干燥后,置于-20℃保存。
1.5 ACE抑制活性分析
ACE抑制剂活性测定[17]:色谱柱:C18柱(4.6mm× 250mm);检测波长:228nm;流动相:V(甲醇): V(水)=30:70,含体积分数0.1%的三氟乙酸;流速:1mL/min。
将一定量的样品溶于0.1mol/L、pH8.0、含0.3mol/L氯化钾的硼酸盐缓冲液(BBS)中,配制梯度质量浓度的样品溶液。取40μL样品溶液和20μL 0.1U/mL ACE的BBS溶液置于37℃恒温水浴中保温10min,加入100μL 5mmol/L HHL BBS作为底物,37℃条件下反应1h后加入50μL 1mol/L盐酸中止反应,冷却至室温,取20μL反应产物进样,通过HPLC 洗脱图谱定量马尿酸生成量,以马尿酸的生成量来判断样品的ACE抑制率。ACE抑制剂的IC50的计算采用侯亚坤[16]的方法。
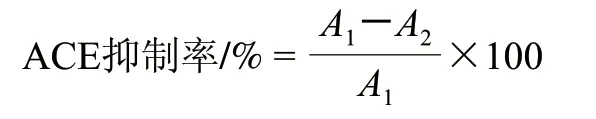
式中:A1为空白对照组中马尿酸的峰面积/(mAU·s);A2为加入样品组中马尿酸的峰面积/(mAU·s)。
1.6 N端氨基酸测序
纯化后的ACE抑制剂经过埃德曼降解后,通过PPSQ-31A全自动蛋白/多肽序列仪测定氨基酸序列。
1.7 体外模拟消化实验
纯化后的ACE抑制肽的模拟消化实验,按李华等[18]的方法稍加更改:模拟胃液:0.075g胃蛋白酶溶于10mL 0.1mo/L HCl溶液中;模拟肠液:0.05g胰蛋白酶与0.3g牛磺酸溶于35mL 0.1mol/L NaHCO3溶液中。
纯化后的ACE抑制剂配制成一定质量浓度,取15mL于0.2mL模拟胃液混合,用1moL/L HCl调至pH2,于37℃条件下消化,6h后加入1mL模拟肠液用1mol/L NaHCO3调节pH7.8,于37℃继续消化6h,反应结束后调pH值为中性,用截留分子质量1000D的超滤管离心(3000r/min、20min,4℃)除酶,所得滤液保存冻干并测定其ACE抑制率。
2 结果与分析
2.1 ACE抑制剂的分离纯化
为了获得核桃蛋白水解物,选取胃蛋白酶对其水解。以ACE抑制率作为分离筛选的判断标准。
胃蛋白酶按照所列出的条件对核桃蛋白进行水解,水解后将所得样品冷冻干燥,测定其(质量浓度为1mg/mL)ACE抑制活性,结果为20.79%,显示出胃蛋白酶水解物有一定的ACE抑制作用。Hyun等[19]研究发现,牛血清蛋白的蛋白酶水解物随着超滤截留的分子质量的减小,超滤物的ACE抑制活性逐渐升高。对胃蛋白酶水解液进行分子质量截留,超滤在4℃条件下进行,经过截留分子质量10kD超滤膜,去除蛋白酶与杂质,将滤液经过5kD的截留,对所得组分(0~5kD、5~10kD)分别测定其ACE抑制效果。所得结果,胃蛋白酶水解物0~5kD组分ACE抑制活性(IC50值为40.00μg/mL)较5~10kD组分ACE抑制活性(IC50值为126.34μg/mL)效果明显。对0~5kD组分进一步进行Sephadex G-25凝胶层析分离。具有ACE抑制剂活性的分子质量低于5kD的冻干粉末,通过Sephadex G-25 Medium柱分离纯化,洗脱峰在波长280nm处检测并收集测定ACE抑制活性。分离结果见图1,得到4个组分分别为P1、P2、P3、P4,各组分抑制ACE活性的IC50结果见图2。比较各组分ACE抑制效果,其中P3的结果较突出,其IC50值为0.02mg/mL。
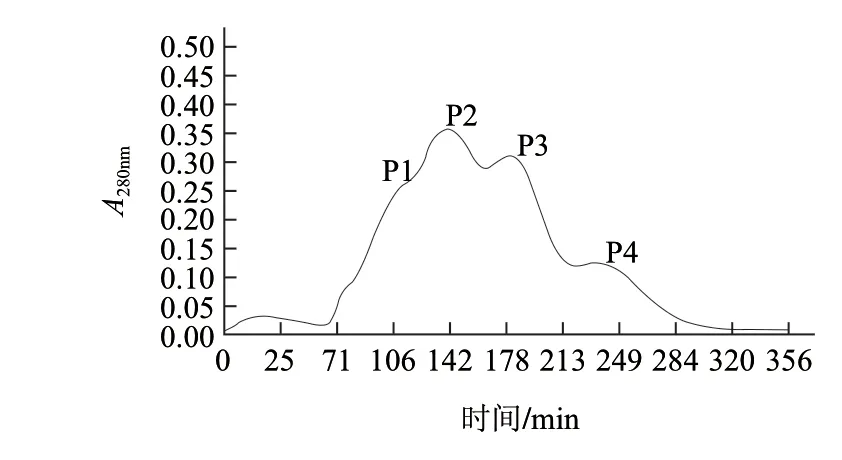
图 1 胃蛋白酶水解物(0~5kD)活性组分经Sephadex G-25分离谱图Fig.1 Separation of active components from walnut protein pepsin hydrolysate by Sephadex G-25 chromatography
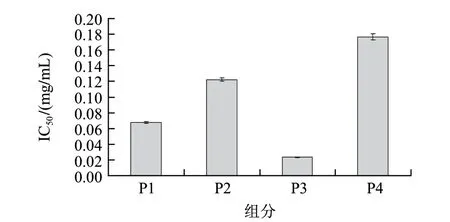
图 2 Sephadex G-25分离后所得胃蛋白酶水解物活性组分ACE抑制活性的IC50Fig.2 IC50 of the active components obtained by Sephadex G-25 chromatography
取Sephadex G-25分离纯化所得ACE抑制活性最高的P3组分,经SuperdexTMPeptide 10/300 GL凝胶过滤色谱进一步分离纯化分离结果见图3,得到3个组分P3-1、P3-2、P3-3,分别测定其ACE抑制活性,所得结果见图4,P3-3组分的ACE抑制效果较为突出其IC50为0.39μg/mL。
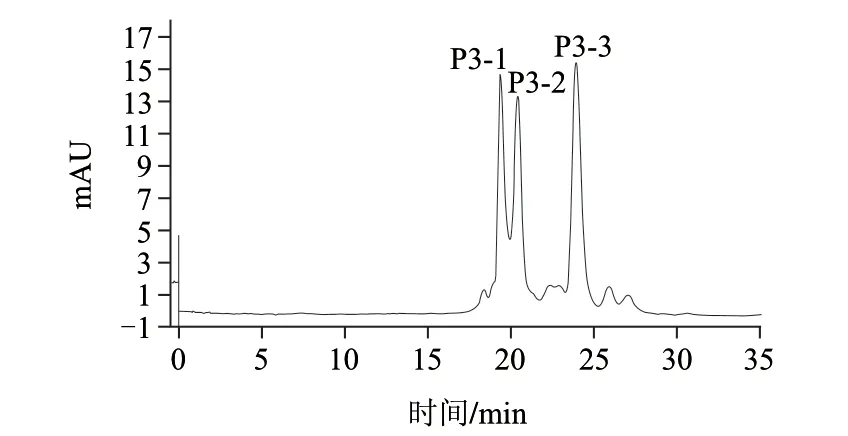
图 3 活性组分P3经Superdex™ Peptide 10/300柱分离谱图Fig.3 Chromatography profi le showing the separation of active component 3 (P3) on Superdex™ Peptide 10/300 column
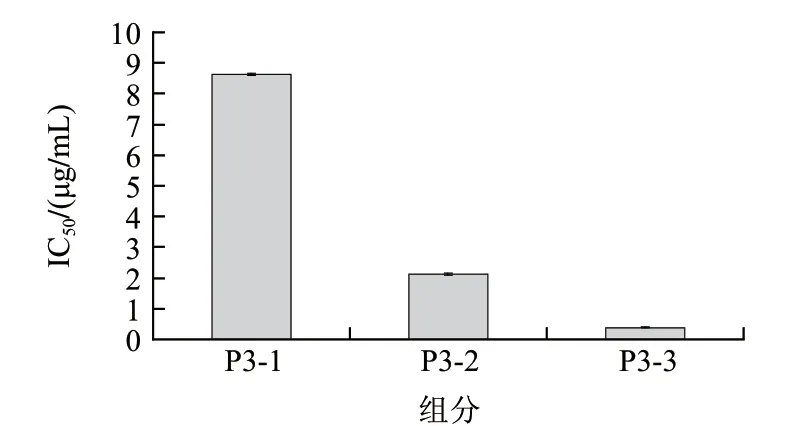
图 4 活性组分P3经Superdex™ Peptide 10/300柱分离后所得组分的ACE抑制活性的IC50Fig.4 IC50 of three fractions (P3-1, 2 and 3) of active component 3
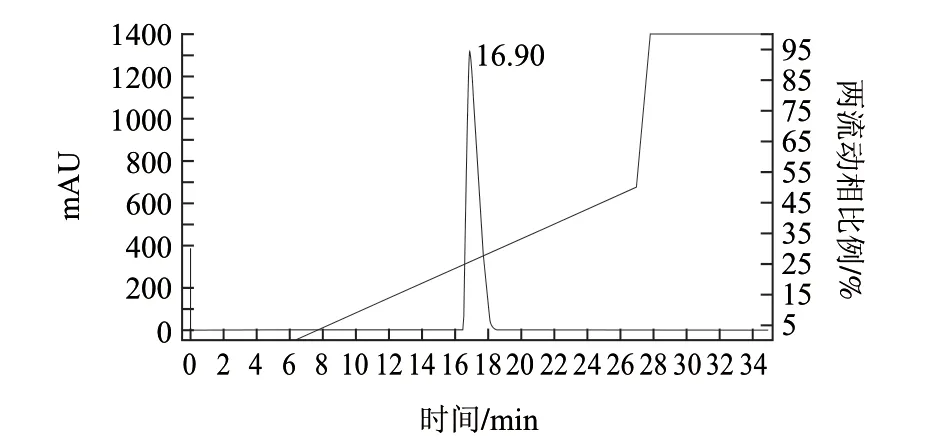
图 5 活性组分P3-3经过反相高效液相色谱Zorbax SB-C18柱纯化谱图Fig.5 Chromatography profi le showing the separation of P3-3 on Zorbax SB-C18 column
将P3-3溶解于流动相A中,利用反相高效液相色谱进行纯化,得到纯度较高的组分,分离结果见图5。测定其抑制ACE活性的IC50值为0.32μg/mL。
2.2 ACE抑制剂的结构分析
纯化后的ACE抑制剂的氨基酸序列为酪氨酸-谷氨酸-脯氨酸(YEP),其理论分子质量为407.43D。有研究表明天然的ACE抑制肽通常含有Pro、Lys以及一些芳香族氨基酸残基[20]。
2.3 体外模拟消化实验
模拟了胃液以及肠液的消化环境,经反相高效液相色谱纯化所得ACE抑制剂进行体外模拟消化实验。纯化后的ACE抑制剂消化前后的ACE抑制活性基本保持不变(纯化后的ACE抑制剂消化前ACE抑制的IC50值为0.32μg/mL,消化后ACE抑制的IC50值为0.36μg/mL)。结果表明,该抑制剂可以在体内消化环境中保持良好的稳定性及生物活性。
3 结 论
植物蛋白的天然成分对人类的疾病有着独特的功效并且没有人工合成药物的副作用[20],本实验选取核桃粕作为蛋白源,充分挖掘了核桃粕的升值内涵,解决了生产中大部分核桃粕蛋白利用率偏低的问题。选择内肽酶进行酶水解,其反应条件温,专一性强。胃蛋白酶为内肽酶,有效的防止水解过程中产生过多的氨基酸[21]。在进行分离纯化的过程中,黄家音等[22]提出利用分离原理不同的多种手段结合,所得到的目的产物将更纯。本研究采用超滤去除大分子蛋白和多肽、在凝胶过滤色谱Sephadex G-25和SuperdexTMPeptide 10/300基础上,又进行反相高校液相色谱纯化,获得IC50值为0.32μg/mL的高纯度高活性的ACE抑制剂 YEP。模拟消化实验结果表明该抑制剂在体内不会被进一步水解降低活性。ACE抑制剂可以通过合成的方式得到,利用合成的多肽,后期可以进行体内实验和动物实验,进一步验证其降血压能力,以及其他生物活性的测定。
[1] LI Guanhong, LE Guowei, SHI Yonghui, et al. Angiotensin-Ⅰ-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects[J]. Nutrition Research, 2004, 24: 469-486.
[2] FERREIRA S H. A bradykinin-potentiating factor (BPF) present in the venom of Bothrops jararaca[J]. British Journal of Pharmacology, 1965, 24(1): 163-169.
[3] KAWASAKI T, JUN C J, FUKUSHINA Y, et al. Antihypertensive effect and safety evaluation of vegetable drink with peptides derived from sardine protein hydrolysates on mild hypertensive, high-normal and normal blood pressure subjects[J]. Fukuoka Igaku Zasshi, 2002, 93(10): 208-218.
[4] KOHAMA Y, OKA H, KAYAMORI Y, et al. Potent synthetic analogues of angiotensin-converting enzyme inhibitor derived from tuna muscle[J]. Agricultural and Biological Chemistry, 1991, 55(8): 2169-2170.
[5] WU Jianping, ALUKO R E, MUIR A D. Purification of angiotensin I-converting enzyme-inhibitory peptides from the enzymatic hydrolysate of defatted canola meal[J]. Food Chemistry, 2008, 111(4): 942-950.
[6] YOKOYAMA K, CHIBA H, YOSHIKAWA M. Peptide inhibitors for angiotensin I-converting enzyme from thermolysin digest of dried bonito[J]. Bioscience Biotechnology and Biochemistry, 1992, 56(10): 1541-1545.
[7] ARUHARA K. Peptide inhibitors for angiotensin I-converting enzyme from enzymatic hydrolysates of porcine skeletal muscle proteins[J]. Meat Science, 2001, 57(3): 319-324.
[8] NAKAMURA Y, YAMAMOTO N, SAKAI K, et al. Purifi cation and characterization of angiotensin I-converting enzyme inhibitors from sour milk [J]. Journal of Dairy Science, 1995, 78(4): 777-783.
[9] NIELSEN M S, MARINUSSEN T, FLAMBARD B, et al. Peptide profiles and angiotensin-I-converting enzyme inhibitory activity of fermented milk products: effect of bacterial strain, fermentation pH, and storage times[J]. International Dairy Journal, 2009, 19(3): 155-165.
[10] SAITO Y, WANEZAKI K, KAWATO A, et al. Structure and activity of angiotensin I converting enzyme inhibitory peptides from sake and sake less[J]. Bioscience Biotechnology and Biochemistry, 1994, 58(10): 1767-1771.
[11] MIYOSHI S, ISHIKAWA H, KANEKO T, et al. Structures and activity of angiotensin-converting enzyme inhibitors in an alpha-zein hydrolysate[J]. Agricultural and Biological Chemistry, 1991, 55(5): 1313-1318.
[12] 张国胜, 孔繁东, 祖国仁, 等. 大豆蛋白抗高血压活性肽的研究[J]. 中国乳品工业, 2004, 32(8): 12-14.
[13] SHIN Z I, RINA Y U. His-His-Leu, an angiotensin I converting enzyme inhibitory peptide derived from Korean soybean paste, exerts antihypertensive activity in vivo[J]. Journal of Agricultural and Food Cchemistry, 2001, 49(6): 3004-3009.
[14] 许慧娇, 郝艳宾, 齐建勋, 等. 核桃蛋白酶解物体外抗氧化及降血压活性研究[J]. 农产品加工: 创新版, 2009(10): 38-42.
[15] 王丰俊, 杨朝晖, 马磊, 等. 响应面法优化核桃蛋白提取工艺研究[J]. 中国油脂, 2011, 36(3): 33-37.
[16] 侯雅坤. 核桃蛋白体外抗氧化活性及ACE抑制活性的研究[D]. 北京: 北京林业大学, 2012.
[17] WU Jianping, ALUKO R E, MUIR A D. Improved method for direct high-performance liquid chromatography assay of angiotensinconverting enzyme-catalyzed reactions[J]. Journal of Chromatography A, 2002, 950(1/2): 125-130.
[18] 李华, 刘通讯. 富血红素多肽吸收的模拟消化评价[J]. 食品工业科技, 2007, 28(4): 207-209.
[19] HYUN C K, SHIN H K. Utilization of bovine blood plasma proteins for the production of angiotensinⅠconverting enzyme inhibitory peptides[J]. Process Biochemistry, 2000, 36(1/2): 65-71.
[20] 鲁军, 任迪锋, 王建中, 等. 螺旋藻源血管紧张素转化酶抑制肽的纯化和鉴定[J]. 生物化学与生物物理学进展, 2010, 37(5): 568-574.
[21] 章超桦, 曹文红, 吉宏武, 等. 中国毛虾ACE抑制肽的初步研究[J]. 水产学报, 2005, 29(1): 97-102.
[22] 黄家音, 朱禹洁, 沈金玉. 降血压肽研究进展[J]. 食品发酵与工业, 2006, 33(6): 81-86.
