肾脏轻-重链沉积病
2013-08-07梁少姗曾彩虹
梁少姗 曾彩虹
病例摘要
病史 43岁男性患者,因“血压升高3年,尿检异常8月,肾功能不全1月余”于2012年8月入院。
3年前因头晕发现血压升高(最高180/90 mmHg),服硝苯地平等降压,未监测血压。8月前因颜面部及双下肢水肿于外院检查发现尿蛋白3+,隐血阴性,肾功能正常,予利尿治疗。2012-06-10查血清肌酐(SCr)87.5 μmol/L,白细胞(WBC)2.7×109/L,血红蛋白(Hb)101 g/L,血小板(PLT)86×109/L,予缬沙坦、双密达莫、利血生及呋噻米治疗,6 月29 日复查 SCr升至127.4 μmol/L,WBC、Hb较前上升,PLT正常,继续予缬沙坦、利血生等治疗。7月2日我院检查尿蛋白定量2.23 g/24h,尿沉渣红细胞计数9万/ml(多形型),血清白蛋白(Alb)43.5 g/L,SCr 109.6 μmol/L,空 腹 血 糖 6.94 mmol/l,Hb 105 g/L,予“雷公藤多苷”等治疗,8 月 7日复查尿蛋白定量3.05 g/24h,Alb降至33.4 g/L,SCr稳定,贫血加重、WBC下降,为进一步诊治入院。病程中无鼻衄、黑便、皮肤淤斑,无发热、骨痛、皮疹、关节痛,夜尿1次/晚。起病以来,患者精神可,体力正常,食欲及睡眠正常,体重无明显变化。
既往史及个人史 幼年曾患“脑膜炎”,已治愈。吸烟史10年(1包/d),夏天饮啤酒1~2瓶/d。
家族史 父亲患“膀胱癌、冠心病”,否认家族中同样疾病患者,否认家族性遗传病史。
体格检查 血压130/85 mmHg,体质量指数25.5 kg/m2。全身皮肤、黏膜无黄染,未见皮疹、皮肤淤点、淤斑。浅表淋巴结未触及。双侧眼睑无水肿。甲状腺不肿大。心、肺、腹无异常发现。双下肢轻度水肿。生理反射正常,病理反射未引出。
实验室检查
尿液 蛋白定量2.23~3.05 g/d,尿沉渣红细胞计数24万/ml(多形型),白细胞0~1/HP。尿C3 2 mg/L(正常值≤2.76 mg/L),α2巨球蛋白3 mg/L(正常值≤2.87 mg/L),视黄醇结合蛋白(RBP)1.6 mg/L(正常值≤0.5 mg/L),N-乙酰-β-D-氨基葡萄糖苷 酶 (NAG)18.6 U/(g·cr)[正 常 值 ≤16.5 U/(g·cr)],溶菌酶 <0.5 mg/L(正常值 <1.0 mg/L)。
血常规 Hb 85~105 g/L,WBC 3.3~3.6×109/L,中性粒细胞/淋巴细胞73%/18%,PLT 102~173×109/L。
血生化 Alb 30.9,球蛋白19.1 g/L,尿素氮15.2 mmol/L,SCr 109.6 μmol/L,尿酸 739 μmol/L,胱抑素C 1.34 mg/L,谷丙转氨酶18 U/L,谷草转氨酶18 U/L,三酰甘油4.67 mmol/L,总胆固醇6.40 mmol/L,电解质正常,OGTT试验:空腹血糖5.22 mmol/L,餐后 2h血糖 8.00 mmol/L,糖化血红蛋白5.1%。
免疫学 IgG 7.52 g/L,IgA 3.38 g/L,IgM 1.20 g/L。ANA、A-dsDNA、血抗体谱均阴性,cANCA、PR3-ANCA 阴性,pANCA 阳性 1∶20、MPO-ANCA 27.46 RU/ml。补体 C3 0.825 g/L,C4 0.296 g/L。乙肝两对半:HbsAb及 HBcAb阳性,HbsAg、HbeAb及HbeAg阴性,抗HCV-IgG阴性。
其他 尿κ轻链155.19 mg/L,λ轻链26.16 mg/L,κ/λ比值5.93,尿本周蛋白阴性。血 κ轻链26.17 mg/L,λ 轻链 146.37 mg/L,κ/λ 比值 0.18。免疫固定电泳图谱:见λ型IgA单克隆免疫球蛋白条带。
辅助检查
双肾B超 左:111 mm×46 mm×55 mm;右:110 mm×49 mm×55 mm,皮质回声正常,肾皮质厚度清楚,皮髓界限清楚,双肾轮廓规则,包膜连续完整。
肝、胆、胰、脾B超 (1)胆囊息肉,胆囊壁胆固醇结晶;(2)脾大。
血管超声 双侧颈动脉管彩色多普勒检查未见异常。
心脏超声 室间隔厚度11 mm,左心室内径42 mm,左室后壁厚度11 mm。LVEF:76%。左室舒张功能减低。
甲状腺B超、胸片及心电图无异常。
骨髓穿刺细胞学检查 第一次示增生性贫血骨髓像;第二次示浆细胞占5%。骨髓活检:穿刺活检血凝块中散在各种造血细胞,未见明确骨髓组织学图像。
肾活检病理
光镜 37个肾小球中5个球性废弃。余正切肾小球显著增大,系膜区重度增宽、呈结节状(图1A),偶见系膜溶解;肾小球毛细血管袢开放欠好,多处融合,袢内见泡沫细胞及透明滴;单个核细胞及中性粒细胞浸润 1~5个/球,囊壁偶见分层。PASM-Masson:节段肾小球结节不嗜银(图1B),节段外周袢分层,未见明确嗜复红物沉积(图1C)。肾小管间质慢性病变基础上合并急性病变,灶性小管萎缩、基膜增厚,未萎缩小管基膜亦增厚,增厚的肾小管基膜PAS强阳性,小灶性肾小管上皮细胞刷状缘脱落,管腔内偶见蛋白管型;间质灶性单个核细胞浸润,小灶性酸性粒细胞。小动脉偶见节段透明变性。
免疫荧光 IgA+++,弥漫分布于肾小球系膜区及线状沉积于毛细血管袢;IgA++,呈线状沉积于肾小管基膜(图 1D)。IgG、IgM、C3、C1q 阴性。Fibrin:1个肾小球节段毛细血管袢阳性。λ轻链++,弥漫分布于肾小球系膜区、呈线状沉积于肾小球毛细血管袢及肾小管基膜(图1E),血管壁阳性;肾小球、肾小管基膜、血管壁κ轻链均阴性。
肾组织刚果红染色、皮肤脂肪刚果红染色均阴性。
电镜 观察2个肾小球。肾小球系膜区重度增宽呈结节状,基膜样物质增多,挤压毛细血管致袢开放欠好,基膜厚约460~600 nm,节段系膜插入至内皮下致新的基膜形成,多处内皮细胞从基膜剥脱,内皮下区域显著增宽、疏松,有的内见细小脂性空泡,较多基膜内侧缘见连续的、细沙状、高电子密度的致密物沉积(图1F)。肾小球足细胞足突融合约60%~70%。肾小管基膜外侧缘亦见连续的、细沙状、高电子密度的致密物沉积(图1G)。
小结:肾小球结节样病变,结合免疫荧光染色,符合轻-重链沉积病(IgA-λ型)。
讨 论
中年男性患者,病程3年,临床表现中等量蛋白尿、少量镜下血尿、高血压、肾功能不全,伴贫血(正细胞性)、白细胞减低,免疫固定电泳见λ型IgA单克隆免疫球蛋白条带,血游离轻链比例异常(κ/λ比值0.18),骨髓细胞学检查浆细胞比例5%及增生性贫血。临床诊断符合意义未明的高丙种球蛋白血症(MGUS)伴肾脏损害。该患者接受肾活检以明确肾脏损害的类型。

图1 A:肾小球体积增大,系膜区重度增宽,呈结节状(PAS,×400);B:节段肾小球结节处不嗜银(↑)(PASM-Masson,×400);C:肾小球系膜区、内皮下未见嗜复红物沉积(Masson三色,×400);D:lgA+++,弥漫分布于肾小球系膜区,线状沉积于毛细血管袢,lgA++,线状沉积于肾小管基膜(IF,×200);E:λ轻链++,弥漫分布于肾小球系膜区,呈线样沉积于肾小球毛细血管袢及肾小管基膜(IF,×200);F:肾小球基膜内侧缘细沙状、高电子密度的致密物沉积(EM);G:肾小管基膜外侧缘细沙状、高电子密度的致密物沉积(EM)
肾活检病理诊断先从光镜特点入手,肾小球表现为结节样病变,多数结节大小均一,未见毛细血管袢明显瘤样扩张,节段结节不嗜银,不同于糖尿病肾病肾小球结节嗜银、大小不一的特点,临床亦无糖尿病,故不支持糖尿病肾病之诊断。肾组织刚果红染色阴性,亦排除肾淀粉样变性。免疫病理见肾小球和肾小管IgA染色阳性,提示异常物质在肾组织沉积。超微结构进一步观察发现,肾小球基膜内侧缘、肾小管基膜外侧缘细沙状、高电子密度的致密物沉积,高倍镜下无纤维丝状、晶格状、中空微管状或弯曲微管状等亚结构,从而排除免疫管状肾小球病和纤维性肾小球肾炎,这两种疾病沉积物在超微结构下分别为中空微管状和纤维丝状结构。根据光镜和超微结构特点高度提示单克隆免疫球蛋白沉积病(MIDD)。
MIDD是指肾组织异常单克隆性免疫球蛋白轻链和(或)重链沉积。根据沉积的组成不同分为三类:(1)轻链沉积病(LCDD),沉积成分为单克隆轻链,是最常见的类型;(2)轻-重链沉积病(LHCDD),沉积成分为单克隆轻链和重链;(3)重链沉积病(HCDD),沉积成分为单克隆重链。LCDD早在上世纪70 年代即有报道[1],1990 年,Buxbaum 等[2]提出LHCDD,而HCDD则在1993年才被认识[3]。
三种MIDD的光镜和超微结构特点相似,光镜下常表现为肾小球结节样病变,电镜下肾小球基膜内侧缘、肾小管基膜外侧缘见细沙状高电子密度的致密物沉积,必须与其他表现为结节样病变或单克隆IgG沉积的增生性肾小球肾炎相鉴别[4,5]。仅依据光镜和电镜病变特点难以区分MIDD类型,必须依靠免疫病理,同时行免疫球蛋白(即重链)和轻链染色。LCDD主要表现为单一κ或λ轻链线样沉积于肾小球基膜和肾小管基膜;HCDD表现为单一的单克隆免疫球蛋白IgG(γ重链)/IgA(α重链)/IgM(μ重链)线样沉积于肾小球基膜和肾小管基膜;LHCDD表现为单一的单克隆免疫球蛋白IgG(γ重链)/IgA(α重链)/IgM(μ重链)线样沉积于肾小球和肾小管基膜,同时单一κ或λ轻链线样沉积于肾小球基膜和肾小管基膜,无论何种类型,都可同时伴单克隆轻链和(或)单克隆重链肾小球系膜区和间质血管阳性。需强调的是单克隆轻链和(或)单克隆重链沿肾小球基膜和肾小管基膜呈“线样”沉积具有非常重要的诊断意义。
该患者光镜和电镜结果已提示为MIDD,免疫荧光轻链染色示λ轻链线样沉积于肾小球基膜和肾小管基膜,同时血管壁阳性,κ轻链阴性,结合光镜和电镜,符合LCDD(λ型)的诊断。但患者同时存在IgA阳性,其他免疫球蛋白IgG、IgM及补体成分C3、C1q均阴性。而且IgA以线样方式沉积于肾小球基膜和肾小管基膜,同时肾小球系膜区和血管阳性。提示肾组织除单克隆轻链沉积外,还存在单一免疫球蛋白IgA的沉积。目前肾组织IgA染色,采用的是针对α重链的抗体,IgA阳性也提示α重链沿肾小球基膜和肾小管基膜线样沉积。其他免疫球蛋白IgG和IgM染色分别针对其γ和μ重链,该患者IgG和IgM阴性,说明γ和μ重链阴性。当然也可采用直接针对重链的抗体,但前者实用方便。根据以上特点该患者诊断符合LHCDD(IgA-λ型)。
LHCDD的诊断必须光镜、电镜、免疫病理相结合。符合MIDD的光镜和电镜特点时,病理医生还必须关注其是否是线样沉积于肾小球基膜和肾小管基膜。肾组织轻链染色显示,16%~34%的IgA肾病患者为单一λ轻链阳性,其余为κ和λ轻链双阳性,但沉积部位仅局限于肾小球,肾小管阴性[6],故不能诊断为LHCDD。
在实际诊断工作中经常遇到IgG或IgA或轻链呈非连续的线样沉积于肾小球和部分肾小管基膜的情况,此时必须结合电镜结果,观察到肾小球基膜内侧缘和肾小管基膜外侧缘细沙样电子致密物沉积时,才能诊断LCDD、LHCDD或HCDD,否则不能诊断。因此电镜和免疫病理在MIDD的诊断中密不可分,缺一不可。
LHCDD属于MIDD的一种亚型,临床较罕见,由Buxbaum于1990年首次提出后[2],现报道约30余例,占自体肾活检的 0.6~ 6.9‰[7,8]。综合目前文献报道的LHCDD资料,患者多为中老年起病(表1),平均年龄51~63岁(范围41~77岁),男∶女约为2∶1~1,绝大多数患者出现肾病范围蛋白尿,可伴血尿,多数患者存在肾功能不全和高血压,部分患者补体C3下降。35例LHCDD患者中,重链和轻链分型组合以IgG-κ型最多共16例(占54.8%),IgG-λ型9例,IgA-κ型 3例,IgA-λ型 2例,5例无相关数据。
MIDD的发病机制仍不清楚,可能由异常单克隆免疫球蛋白沉积于肾组织,引起基质增加所致。有研究发现轻链的可变区,主要是补体决定区(CDR)1和3,少数CDR2和骨架区(FR)氨基酸被疏水性残基替代也与 LCDD的发病相关[9,10]。在HCDD(IgG型)患者中发现CH1缺失的γ重链[11],CH1和CH2结构域氨基酸序列异常的截短α重链[12]分泌,沉积于组织中形成 HCDD(IgA型)。而LHCDD则未见相应研究。
MIDD血清免疫固定电泳常见单克隆条带,LCDD/LHCDD单克隆条带的阳性率为80%~90%,HCDD为60%[13],多数患者与肾组织沉积类型一致,仅个别不一致。多数患者血和尿的游离轻链比例异常。部分患者继发于多发性骨髓瘤(MM)、意义未明的高丙种球蛋白血症(MGUS)、淋巴浆细胞样淋巴瘤。治疗上采取化疗和(或)造血干细胞移植,Nasr等[7]报道LHCDD人及肾存活时间分别是42月和36月。肾移植后LHCDD可复发[14]。
总之,该患者临床表现蛋白尿、少量镜下血尿,肾功能不全和高血压,血清免疫固定电泳见λ型IgA单克隆免疫球蛋白条带,结合光镜表现为肾小球结节样病变,免疫荧光染色IgA及单一λ轻链均呈线状沉积于肾小球血管袢及肾小管基膜,超微结构肾小球基膜内侧缘及肾小管基膜外侧缘细沙状、高电子密度的致密物沉积等特点,最终诊断为轻-重链沉积病(IgA-λ型)。本例是国内首例诊断为IgA-λ型LHCDD的患者。
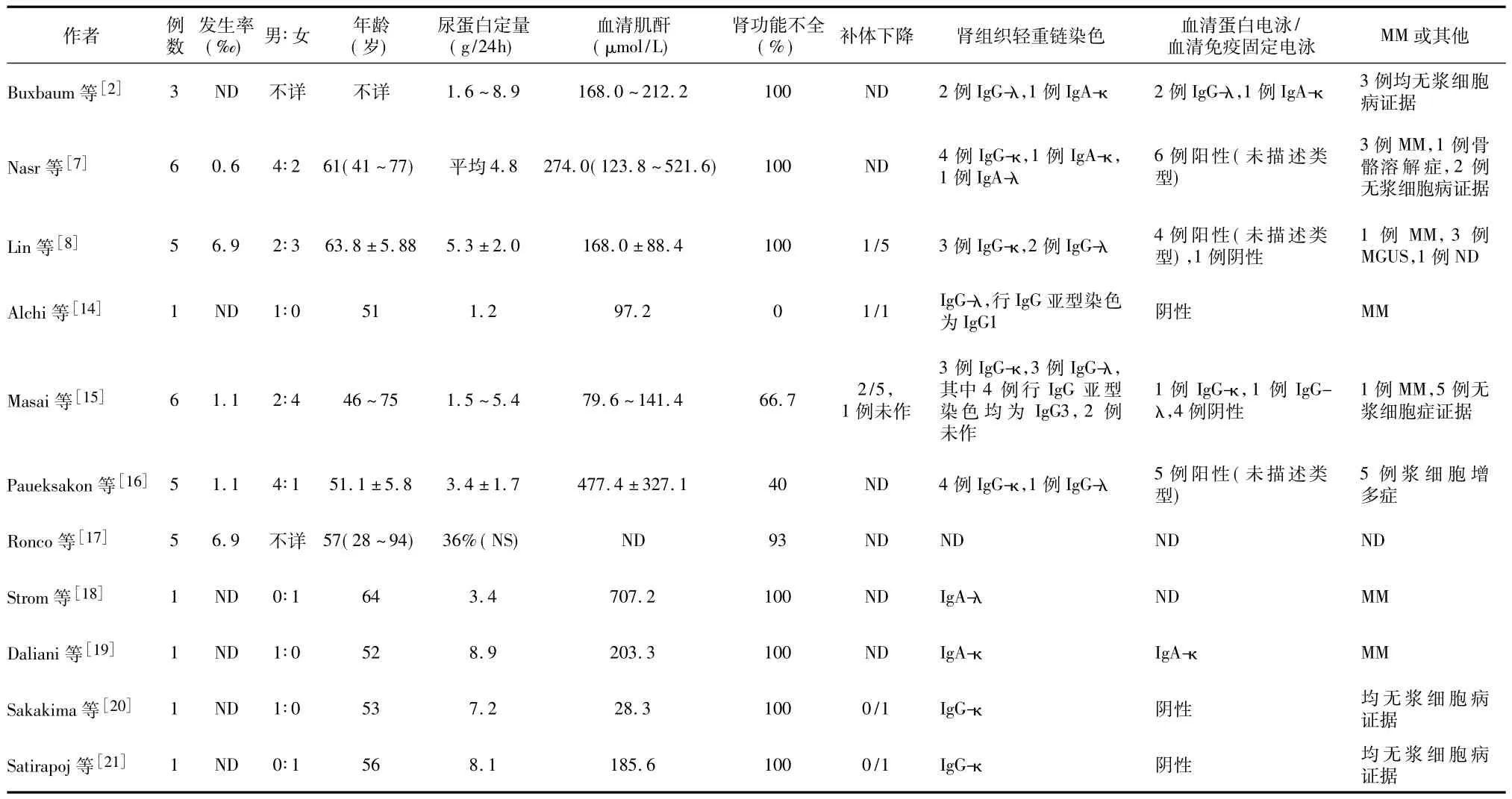
表1 轻-重链沉积病的临床特点及分型
1 Randall RE,Williamson WC Jr,Mullinax F,et al.Manifestations of systemic light chain deposition.Am J Med,1976,60(2):293-299.
2 Buxbaum JN,Chuba JV,Hellman GC,etal.Monoclonal immunoglobulin deposition disease:light chain and light and heavy chain deposition diseases and their relation to light chain amyloidosis.Clinical features,immunopathology,and molecular analysis.Ann Intern Med,1990,112(6):455-464.
3 Aucouturier P,Khamlichi AA,Touchard G,et al.Brief report:heavychain deposition disease.N Engl J Med,1993,329(19):1389-1393.
4 曾彩虹,朱小东.增生性肾小球肾炎伴晶格状结构的单克隆IgG沉积.肾脏病与透析肾移植杂志,2011.20(4):384-390.
5 曾彩虹,陈浩,范芸,等.单克隆IgG沉积的增生性肾小球肾炎.肾脏病与透析肾移植杂志,2012,21(5):401-407.
6 Haas M.Histology and immunohistology of IgA nephropathy.J Nephrol,2005,18(6):676-680.
7 NasrSH,ValeriAM,CornellLD,etal.Renalmonoclonal immunoglobulin deposition disease:a report of 64 patients from a single institution.Clin J Am Soc Nephrol,2012,7(2):231-239.
8 Lin J,Markowitz GS,ValeriAM,etal.Renalmonoclonal immunoglobulin deposition disease:the disease spectrum.J Am Soc Nephrol,2001,12(7):1482-1492.
9 Preud'homme JL,Aucouturier P,Touchard G,et al.Monoclonal immunoglobulin deposition disease:a review of immunoglobulin chain alterations.Int J Immunopharmacol,1994,16(5-6):425-431.
10 Decourt C,Touchard G,Preud'homme JL,et al.Complete primary sequences of two lambda immunoglobulin light chains in myelomas with nonamyloid(Randall-type)light chain deposition disease.Am J Pathol,1998,153(1):313-318.
11 Moulin B,Deret S,Mariette X,et al.Nodular glomerulosclerosis with deposition of monoclonal immunoglobulin heavy chains lacking C(H)1.J Am Soc Nephrol,1999,10(3):519-528.
12 Cheng IK,Ho SK,Chan DT,et al.Crescentic nodular glomerulosclerosis secondary to truncated immunoglobulin alpha heavy chain deposition.Am J Kidney Dis,1996,28(2):283-288.
13 Ronco,P,Aucouturier,P,Mougenot B.Monoclonal gammopathies:Multiple myeloma,amyloidosis,and related disorders//Schrier R.Diseases of the Kidney and Urinary Tract,8th ed.Philadelphia:Lippincott Williams & Wilkins,2006:1942-1976.
14 Alchi B,Nishi S,Iguchi S,et al.Recurrent light and heavy chain deposition disease after renal transplantation.Nephrol Dial Transplant,2005,20(7):1487-1491.
15 Masai R,Wakui H,Togashi M,et al.Clinicopathological features and prognosis in immunoglobulin light and heavy chain deposition disease.Clin Nephrol,2009,71(1):9-20.
16 Paueksakon P,Revelo MP,Horn RG,et al.Monoclonal gammopathy:significance and possible causality in renal disease.Am J Kidney Dis,2003,42(1):87-95.
17 Ronco P,Plaisier E,Mougenot B,et al.Immunoglobulin light(heavy)-chain deposition disease:from molecular medicine to pathophysiology-driven therapy.Clin J Am Soc Nephrol,2006,1(6):1342-1350.
18 Strøm EH,Fogazzi GB,Banfi G,et al.Light chain deposition disease of the kidney.Morphological aspects in 24 patients.Virchows Arch,1994,425(3):271-280.
19 Daliani D,Weber D,Alexanian R.Light-heavy chain deposition disease progressing to multiple myeloma.Am J Hematol.1995,50(4):296-298.20 Satirapoj B,Paueksakon P.A concurrence of light and heavy chain deposition disease and diabetic nephropathy.J Med Assoc Thai,2007,90(10):2204-2208.
