横纹肌溶解症与急性肾损伤
2013-08-07综述徐道亮审校
李 珺 综述 徐道亮 审校
横纹肌溶解症(RM)是多种病因引起的横纹肌损伤、破坏甚至崩解,导致肌细胞内容物等释放至血循环,包括肌红蛋白(myoglobin)、电解质及其他胞浆蛋白如肌酸磷酸激酶(CPK)、醛缩酶、乳酸脱氢酶(LDH),13%~50%的患者并发急性肾损伤(AKI)。
RM诱发的AKI约占全部AKI的7%~10%,其最常见的临床表现包括少尿、无尿、水电解质及酸碱代谢紊乱(脱水、高血钾、酸中毒、低血钙等),如不及时处理,患者可并发呼吸衰竭、弥散性血管内凝血甚至多器官功能衰竭等严重危并发症[1]。RM致死率与其病因及相应的并发症相关,因此文献报道的死亡率不一;重症监护病房(ICU)患者,RM合并AKI的死亡率远高于非合并AKI者[2]。因此,早期诊断、早期治疗对RM患者的肾脏病症预后及防治严重的全身并发症尤为重要。本文旨在对RM并发急性肾损伤的机制及诊治进展做一综述。
RM的病因及机制
造成RM的病因众多,一般可分为机械性因素和非机械性因素。
机械性因素包括:(1)创伤或压迫:车祸、工伤、地震等灾难性事件所致创伤后长期保持同一姿势如捆绑、长期卧床等;(2)肌肉血管栓塞或缺血:血栓、栓塞、钳夹血管、休克等;(3)肌肉持续收缩:训练等高强度运动、癫痫发作、持续哮喘、安非他明等药物致肌肉痉挛;(4)其他:电击伤、高热等[2]。
非机械性因素包括:(1)水电解质紊乱:低钾、低钙、低磷、低钠、高钠、高渗等;(2)内分泌疾病:糖尿病高渗昏迷、甲状腺功能减退症、快速纠正甲状腺毒血症所致相对的甲状腺功能减退;(3)药物及毒物:毒品、他汀类、酒精、哈夫病、毒蛇或昆虫咬伤;(4)感染:病毒、细菌感染;(5)多发性肌炎或皮肌炎;(6)基因缺陷所致代谢性肌病[2-4]。其中,水电解质紊乱、内分泌疾病、感染性疾病和药物是导致RM最常见的非机械性因素;感染性疾病(常见革兰氏阳性杆菌如肺炎链球菌及金葡菌败血症)合并RM常伴有高渗状态[4]。一些患者可同时存在导致横纹肌溶解的多种病因[5]。
RM并发AKI的高危因素
RM并发AKI的高危因素有:(1)高龄(>70岁);(2)脱水;(3)血尿酸≥6 mg/dl;(4)糖尿病高渗昏迷。高强度运动所致RM并发AKI的比率低于非运动因素所致[6]。
回顾分析发现,起病时血清CPK水平与发生AKI概率呈正相关;血清CPK<5000 U/L,并发AKI的概率小,血清 CPK>15 000 U/L者则易并发AKI[7]。但另有学者研究发现,血清 CPK水平对AKI的预测价值并不大[5,8];即使 CPK < 5000 U/L,但若同时存在脱水、酸中毒或脓毒血症时,也易发生AKI。尿肌红蛋白预测AKI的敏感度100%,特异度仅15%~88%[9]。
RM所致AKI的病理生理机制(图1)
RM引起AKI的主要机制包括:肾内血管收缩、管型形成致使肾小管阻塞和肌红蛋白直接诱导细胞毒性,这三种机制相互间有协同作用。如肾内血管收缩可降低肾小球滤过率,促进肾小管管型形成,加重肾小管缺血,进一步促进肌红蛋白对肾小管毒性作用。游离的肌红蛋白与Tamm-Horsfall蛋白相互作用形成管型,酸性尿及低血容量状态将加速上述进程,从而导致远端肾小管的阻塞,降低肾小球的滤过率,致使肾内血管收缩代偿性加强以增加肾小球滤过压。肌红蛋白诱导氧化应激反应及产生炎性介质,促进肾内血管收缩及肾小管的缺血。近年研究发现,低氧诱导转录因子家族在RM所致AKI中也起着重要作用。
肌红蛋白的毒性也是AKI重要的诱发机制,肌细胞释放肌红蛋白致活性氧(ROS)渗漏,产生氧自由基并引起细胞损伤。动物实验显示,肌红蛋白选择性降低大鼠肾脏的髓质血流及氧供,促进氧化应激损伤;此外,肌红蛋白本身具有类似过氧化酶的活性,可以直接导致脂质氧化及异前列烷(isoprostanes)的生成,参与肾小管损伤[8]。实验研究证实丙三醇(glycerol)肌肉注射的大鼠循环中血红蛋白水平升高,大鼠肾脏损伤类似人类RM所致的AKI。肌红蛋白的降解产物(血红蛋白及游离铁)可诱导产生羟基自由基,介导肾小管损伤,而去铁胺及谷胱甘肽可拮抗其致病作用;由此提示血红蛋白在RM所致的AKI中可能起着重要致病作用。因此,促进血红蛋白的降解对于防治肾脏损伤可能具有重要意义[12]。
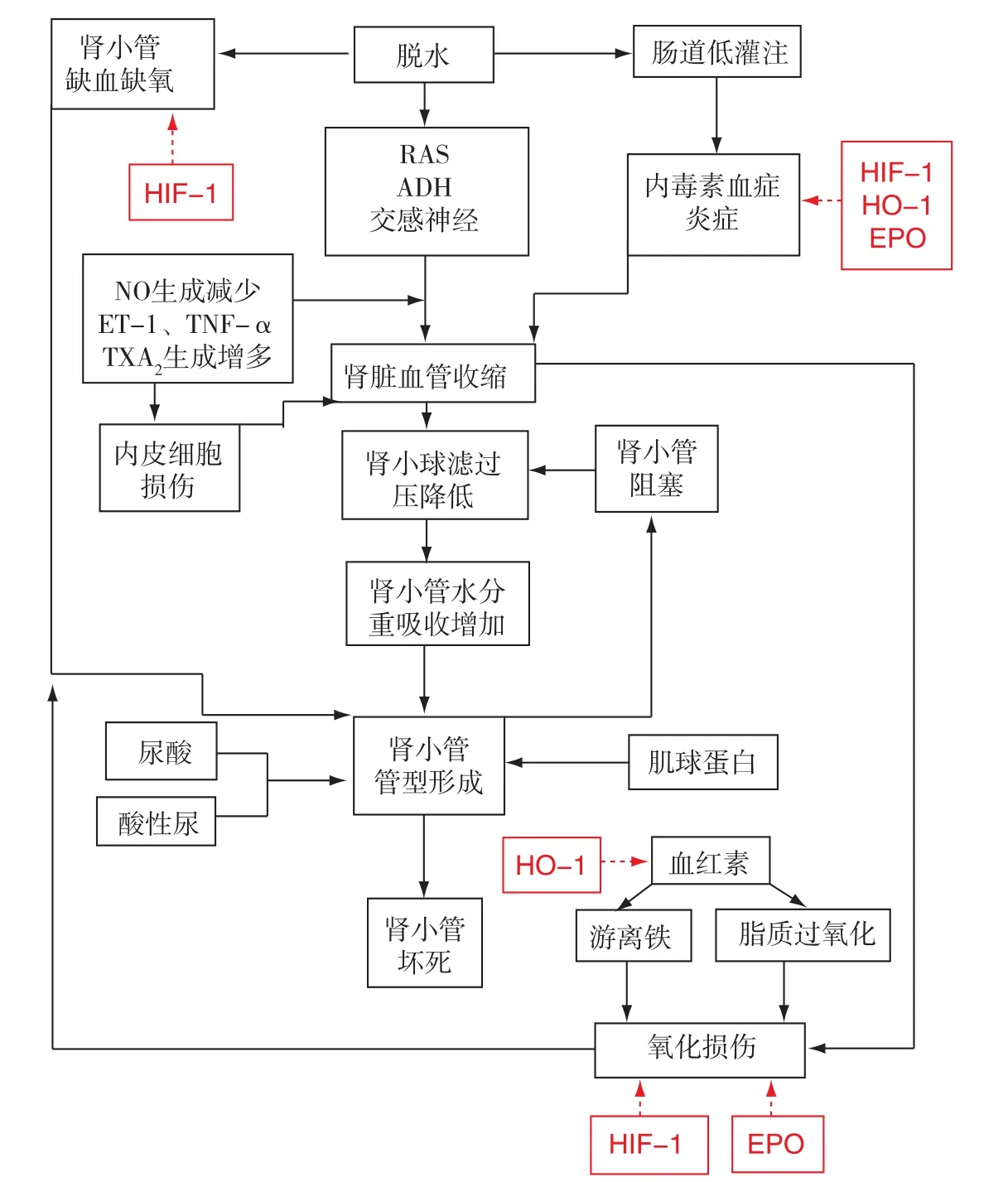
图1 横纹肌溶解症并发急性肾损伤的病理生理图示[10]
Mole等[13]低氧诱导因子(HIF)家族在 RM 所致AKI中可能起着重要作用。肾脏浓缩结构导致肾实质对氧的利用有限。髓质亨利袢升支粗段及近端小管S3段转运功能活跃、氧耗多,但局部供氧有限(髓质血供仅占肾脏血流量的10%,并且存在血氧分流,即髓袢降支动脉的氧分流至髓袢升支静脉),常处于低氧状态,易于受到缺氧损伤。近年研究发现,缺氧可上调HIF家族成员的表达,如HIF-1、血红素氧合酶-1(HO-1)、促红细胞生成素(EPO)等,参与RM所致的肾脏损伤。
已证实RM大鼠模型主要引起近端小管损伤。反映低氧的敏感标志物哌莫硝唑加和物(PIM)、HIF-1及HO-1在近端小管的表达上调,其分布呈时间和空间特异性;HIF-1在造模后3h开始活化,PIM在造模后 6h表达最强;HO-1和 HIF-1的降解酶——脯氨酸羟化酶(PHD)在造模后6h开始表达,且持续24h仍有低水平表达。此外,HIF-1可诱导调节肾脏间质细胞合成EPO,改善缺血性AKI的肾脏病变[12]。下面将简述HIF家族成员的生物学特性及其在RM所致AKI病变中的参与机制。
低氧诱导因子(HIF) HIF是α和β单亚位组成的异源性二聚体,根据α亚单位不同分为HIF-1α,HIF-2α 及 HIF-3α;HIF 的靶基因涉及多项生物学功能:调节血管活性物质、促进EPO核因子生成、促进血管生成、清除自由基、调节炎症、免疫反应和促进肿瘤生长等;其中HIF-1α与AKI病变关系密切。HIF-1α是对氧敏感的亚单位,缺氧可促进α亚单位的表达并使其稳定,与HIF-1β结合为二聚体,从而促进HIF-1活化。
HIF-1主要由脯氨酸羟化酶(PHDs),及冯希佩尔-林道蛋白(pVHL)调控。其中涉及一氧化氮(NO)介导的信息调节通路。高浓度NO可稳定HIF-1α,阻断PHD活性,降低HIF-1α的脯氨酸羟基化,从而使 pVHL与 HIF-1α解离,导致 HIF-1α聚集,与HIF-β结合为二聚体,促进HIF-1活化,诱导缺氧反应元件(HRE)相关靶基因活化,产生一系列生物学效应。反之,缺氧时,NO浓度降低,从而促使HIF-1α降解,使组织对低氧的耐受降低,加速缺氧所致损伤。RM所致AKI的大鼠模型,予以VHL或PHD抑制剂促进HIF-1活化,可耐受肾脏缺血及再灌注损伤[14]。然而HIF-1表达的诱导并非均为保护性作用,存在如促进肿瘤发生和生长、促进纤维化等潜在的负面作用;因此,应重新评估RM所致AKI的患者是否应予上调HIF-1的措施表达。
血红素氧合酶1(HO-1) HO-1是降解血红素的限速酶。HO-1可将血红素降解为游离铁、一氧化碳(CO)及胆绿素(BV)。此外,HO-1诱导铁蛋白合成并结合游离铁,从而阻断游离铁诱导的氧化应激损伤;CO可抑制内皮细胞凋亡,并具血管舒张活性及抗血小板聚集作用;BV可迅速经胆绿素还原酶作用转化为胆红素,具抗氧化活性;由此可见,HO-1不仅降解血红素,其代谢产物还具有抗氧化作用[15]。
动物实验证实,缺血性肾脏损伤时微粒体内的血红素浓度显著升高,并诱导HO-1基因的表达及酶活性水平的提高[16]。HO-1基因敲除小鼠(HO-1-/-)的肾脏皮质小管上皮可见游离铁沉积;肾脏脂质过氧化及蛋白质羰基化标志物的表达显著高于野生小鼠(HO-1+/+)[17]。HO-1-/-大鼠反复灌注血红蛋白,可诱导单核细胞趋化因子的表达上调及核因子(NF-κB)的活化,参与小管间质损伤[18]。个例报道,HO-1基因缺陷患者血循环中血红素水平显著升高,可见铁在肾脏沉积,并出现持续蛋白尿及血尿[19]。由此可见,HO-1有拮抗血红蛋白的肾脏的毒性。
金属卟啉是HO-1活性的竞争性抑制剂。其中锡-中卟啉(Sn-PP)在RM所致AKI大鼠模型中可抑制HO-1活性,从而加剧肾功能恶化(血肌酐水平上升);而氯化锡(SnCl2)可诱导肾小管上皮细胞表达HO-1,降低血红蛋白水平,改善肾脏的氧化应激损伤[15];由此进一步证实,HO-1可能通过降解游离的血红蛋白改善氧化应激、抗炎、抗凋亡和调节血管活性等机制,参与肾脏的保护作用[20]。
EPO EPO主要由肾间质的成纤维细胞合成,经EPO受体发挥生物学作用。EPO受体主要表达于肾脏近端小管、远端小管和集合管;亦发现EPO受体还在肾小球的系膜细胞和内皮细胞表达。实验研究显示,缺血、败血症、出血性休克、顺铂及放射物质所致AKI的动物模型中,EPO在肾脏的表达水平均显著降低,予以外源性EPO可诱导Caspase3、Bax和NF-κB的表达下调,从而减少肾小管上皮细胞的凋亡,促进肾小管上皮细胞修复,提高超氧化物歧化酶的水平、降低脂质过氧化及降低炎细胞浸润,从而改善肾脏损伤[21]。动物实验证实,重组EPO可抑制RM大鼠模型肾脏NF-κB和iNOS的活性,降低循环中CPK水平,改善肾脏病变及肾功能[22]。尽管目前多数研究数据源于动物模型,但已证实EPO能增加危重肾脏病患者中的抗病能力。
临床症状及诊断
临床症状 典型的RM症状包括肌肉症状和浓茶色尿。肌肉症状如:肌肉肿胀、疼痛、乏力和僵硬,严重者可出现受累肌群的瘫痪;最常累及腓肠肌、大腿及下背部;严重患者可并发AKI,出现少尿、无尿、水电解质及酸碱代谢紊乱,如得不到及时处理则进一步并发呼吸衰竭、弥散性血管内凝血甚至多器官功能衰竭等危及生命。创伤所致的RM常可出现低血容量休克和骨筋膜室综合症。RM的其他非特异症状包括恶心、呕吐、发热和精神症状等[2]。
横纹肌溶解症的诊断
肌酸磷酸激酶(CPK) 在肌肉损伤后2~12h内血清CPK开始升高,1~3d内达峰值,3~5d内逐渐下降。当其大于血清CPK正常值上限的五倍(>1000U/L)才可诊断。
肌红蛋白 尿隐血阳性但镜检未见尿红细胞,尿沉渣可见棕色色素管型,此时应高度提示肌红蛋白尿,其诊断敏感性约80%。肌红蛋白尿仅见于RM,但并非RM的必要诊断条件。因血清肌红蛋白代谢较快,其检测对RM诊断的敏感性低。
病理学诊断
肌肉活检 50%的RM可以无肌肉损伤的症状,但病理切片可见节段性的横纹肌纤维坏死、溶解,炎细胞浸润。
肾活检 肾活检并非诊断必须。然而,当患者长时间AKI不恢复、合并较多蛋白尿及存在严重的高血压时应争取行肾活检,明确是否存在其他肾脏疾病。
RM患者最常见的肾脏病理改变是急性肾小管坏死(ATN),组织学观察证实近端肾小管上皮细胞扁平、刷状缘脱落,重者肾小管上皮细胞坏死甚至肾小管基膜断裂,远端肾小管上皮细胞胞浆内见棕黄色的颗粒,可见肌红蛋白管型(采用免疫组化单克隆抗肌红蛋白抗体En Vision法染色证实)[23]。
影像学检查 B超、CT或MRI检查可以明确肌肉损伤的程度、范围和液化情况。血氧水平依赖性磁共振成像(BOLD-MRI)可明确AKI前期肾脏的髓质缺氧状况[24]。肌电图可提示肌源性损伤。
AKI的诊断 AKI的生物学标志物有利AKI的早期诊断,即包括血清胱抑素C(CysC)、血、尿中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、尿白细胞介素18(IL-18)和尿肾损伤分子-1(KIM-1)等[25]。
RM所致AKI的特点:(1)血清肌酐水平上升较快,尿素氮(BUN)与SCr的比率偏低;(2)尿钠排泄分数<1%,反映肾前性血管收缩及肾小管堵塞,但肾小管结构仍然完整;随病程进展,当发生缺血性或肾毒性ATN时,尿钠的排泄分数将会升高;(3)水电解质及酸碱代谢紊乱的特点:早期易发生低血容量休克,后期可出现血浆容量扩增;低钙血症是RM早期常见的并发症,恢复期则常发生高钙血症;电解质紊乱(包括高钾、高磷、高尿酸、高阴离子间隙性代谢性酸中毒和高镁)的程度往往反映RM合并AKI的严重度。
治 疗
水化治疗 RM所致的AKI早期因液体在受损的肌肉组织内潴留,常表现血容量不足;因此早期、充分水化是关键措施。
水化治疗所需补充液体的成分(碳酸氢钠或者生理盐水)尚存争议。目前认为,对CPK峰值高于30 000 U/L的患者,碳酸氢钠可能有效,但同时会加重低钙血症。由于输注大量生理盐水可能导致高氯性酸中毒,因此RM患者尤其伴酸中毒者,同时予生理盐水和碳酸氢钠的水化治疗较为合理[26]。治疗过程中必须监测尿pH值、血清碳酸氢钠水平、血钙和血钾水平;若碳酸氢钠治疗4~6h后尿pH值仍无上升趋势,或出现低钙血症的症状,则建议停碳酸氢钠,继续予生理盐水治疗[27]。
利尿治疗 目前对是否应用利尿剂(袢利尿剂、甘露醇)尚存争议。动物实验显示,袢利尿剂可以降低氧耗,改善髓质的氧供;但临床研究并无明确证据。目前尚无随机对照研究支持甘露醇,但多数专家仍建议应用甘露醇可防治AKI及缓解骨室筋膜腔压力。应用甘露醇时,必须控制其累积剂量(甘露醇>200 g/d或累积量>800g可导致渗透性肾病),且应密切监测血浆渗透压、渗透压间隙(血浆渗透压的实际值与计算值之差)和肾功能;如无利尿效果或渗透压间隙上升超过55mOsm/kg,则建议停用[28]。
纠正电解质紊乱 疾病初期,纠正高钾血症尤为重要。如无低钙症状或严重高钾血症,则可暂时不处理早期低钙血症。在应用含钙螯合剂降磷治疗时,应注意发生异位钙化的可能。
血液净化治疗 连续性血液净化治疗(CBP)不仅清除毒素、炎症介质、维持内环境稳定,还有助于清除肌红蛋白,预防AKI的发生。当RM并发AKI、严重高钾、酸中毒及容量负荷、严重创伤或合并多器官功能衰竭时,CBP是首选治疗方案。目前认为连续性静脉静脉血液滤过(CVVH)和连续性静脉静脉血液透析滤过(CVVHDF)模式对肌红蛋白的清除效果较好。
传统的间歇性血液透析模式对于肌红蛋白的清除并不理想。其难点包括:(1)透析膜对肌红蛋白的通透性。肌红蛋白分子量虽小,但因携带电荷及空间位阻效应,传统透析膜对肌红蛋白的筛漏系数约0.4~0.6,在体内环境下实际筛漏系数甚至降于0.1,因此采用高通透滤过膜或特异性肌红蛋白吸附膜更为理想。有研究显示,第一个24h CVVH治疗(超滤率 2~3 L/h)肌红蛋白的清除率可达56%~70%,随后肌红蛋白的清除效率降低,因此建议每6~8h更换滤过膜将有助于提高肌红蛋白的清除效果。个例报道应用高通量透析(孔径100 kD)时,肌红蛋白的筛漏系数可高达0.72[29]。②容积分布的限制。肌红蛋白主要分布在血液循环及肌肉组织中,横纹肌溶解时肌肉组织持续破坏致使肌红蛋白不断释放至循环中,这使得短时、间断的血透清除模式不能达到理想的治疗效果。因此CBP(CVVH或CVVHDF)的清除效果优于血浆置换和间歇性血液透析模式[30]。此外,为避免加重肌肉损伤,建议CBP治疗中应用枸橼酸盐行局部抗凝。[31]
治疗新方向
抑制肾内血管收缩 动物实验显示,L-精氨酸(NO前体)或吗多明(NO供体)可以提高肾脏的NO水平从而舒张肾内血管,血栓烷受体拮抗剂可拮抗F2-前列烷的肾血管收缩活性,这均对肾脏有保护作用,但其临床价值有待研究。
抑制氧化应激所致损伤 氧化应激损伤在RM所致AKI中起着重要作用。N-乙酰半胱氨酸(氧化反应的底物)、超氧化物歧化酶(自由基清除剂)及维生素(脂溶性抗氧化剂)的临床应用有待RCT试验行进一步评估。此外,动物实验显示,对乙酰氨基酚(APAP)通过还原肌红蛋白的高价铁从而改善RM所致AKI,这可能是未来新的治疗方向之一[27]。
促进HIF家族成员表达的药物 HIF降解酶的抑制剂促进肾脏表达HIF-1,粒细胞集落刺激因子诱导HO-1表达上调,这些均可增强肾脏对缺氧的预适应,有助肾脏保护[32]。临床研究发现,应用EPO的可显著改善重症创伤患者的预后,但相关机制有待进一步研究[33]。
其他 RM的动物模型显示,过氧化物酶体增殖体激活受体γ(PPAR-γ)激动剂可改善肾小管凋亡及坏死、降低氧化应激损伤、改善肾脏微循环和降低蛋白尿;同时还促进骨骼肌的葡萄糖转运,减少肌肉损伤[34]。因此,PPAR-γ激动剂可能对RM也存在潜在的干预作用。
RM并发AKI的预后
RM患者的预后与病因及合并症密切相关。血管病变所致RM,致死率高达32%;药物及酗酒所致RM,致死率仅为3.4%;细菌感染相关的RM,AKI发生率为57%,致死率约38%;病毒感染相关的RM,AKI发生率为34%,致死率约8%。多数 RM患者仅有轻度肾功能损伤,短时内肾功能迅速恢复正常,但肾功能损伤较重者血液透析时间甚至长达3 周[3,5,7]。
综上所述,RM有多种病因,非机械性病因并不少见。肌肉系统在水电解质紊乱的调节中起着非常重要的作用,尤其在合并AKI时更易出现危及生命的水电酸碱平衡紊乱及严重并发症;因此早期诊断、早期治疗对RM患者的预后具有重要意义。RM并发AKI或存在严重并发症时,CBP是首选的治疗措施。
1 Bagley W,Yang H,Shah K.Rhabdomyolysis.Intern Emerg Med,2007,2(3):210-218.
2 Shapiro ML,Baldea A,Luchette FA.Rhabdomyolysis in the intensive care unit.J Intensive Care Med,2012,27(6):335-342.
3 Ka T,Takahashi S,Tsutsumi Z,et al.Hyperosmolar non-ketotic diabetic syndrome associated with rhabdomyolysis and acute renal failure:a case report and review of literature.Diabetes Nutr Metab,2003,16(5-6):317-322.
4 Singh U,Scheld WM.Infectious etiologies of rhabdomyolysis:three case reports and review.Clin Infect Dis,1996,22(4):642-649.
5 Melli G,Chaudhry V,Cornblath DR.Rhabdomyolysis:an evaluation of 475 hospitalized patients.Medicine(Baltimore),2005,84(6):377-385.
6 Fernandez WG,Hung O,Bruno GR,et al.Factors predictive of acute renal failure and need for hemodialysis among ED patients with rhabdomyolysis.Am J Emerg Med,2005,23(1):1-7.
7 Veenstra J,Smit W,Krediet R,Arisz L.Relationship between elevated creatine phosphokinase and the clinical spectrum of rhabdomyolysis.Nephrol Dial Transplant,1994,9(6):637-641.
8 Visweswaran P,Guntupalli J.Rhabdomyolysis.Crit Care Clin.1999,15(2):415-428.
9 Rodríguez-Capote K,Balion CM,Hill SA,et al.Utility of urine myoglobin for the prediction of acute renal failure in patients with suspected rhabdomyolysis:a systematic review.Clin Chem,2009,55(12):2190-2197.
10 Vanholder R,Sever MS,Erek E,et al.Rhabdomyolysis.J Am Soc Nephrol,2000,11(8):1553-1561.
11 Holt S,Reeder B,Wilson M,et al.Increased lipid peroxidation in patients with rhabdomyolysis.Lancet,1999,353(9160):1241.
12 Rosenberger C,Goldfarb M,Shina A,et al.Evidence for sustained renal hypoxia and transient hypoxia adaptation in experimental rhabdomyolysis-induced acute kidney injury.Nephrol Dial Transplant,2008,23(4):1135-1143.
13 Mole DR,Ratcliffe PJ.Cellular oxygen sensing in health and disease.Pediatr Nephrol,2008,23(5):681-694.
14 Webb JD,Coleman ML,Pugh CW.Hypoxia,hypoxia-inducible factors(HIF),HIF hydroxylases and oxygen sensing.Cell Mol Life Sci,2009,66(22):3539-3554.
15 Nath KA,Haggard JJ,Croatt AJ,et al.The Indispensability of Heme Oxygenase-1 in Protecting against Acute Heme Protein-Induced Toxicity in Vivo.Am J Pathol,2000,156(5):1527-1535.
16 Akagi R,Takahashi T,Sassa S.Cytoprotective effects of heme oxygenase in acute renal failure.Contrib Nephrol,2005,148:70-85.
17 Nath KA,Vercellotti GM,Grande JP,et al.Heme protein-induced chronic renal inflammation:Suppressive effect of induced heme oxygenase-11.Kidney Int,2001,59(1):106-117.
18 Kanakiriya SKR,Croatt AJ,Haggard JJ,et al.Heme:a novel inducer of MCP-1 through HO-dependent and HO-independent mechanisms.Am J Physiol Renal Physiol,2003,284(3):F546-F554.
19 Morimoto K,Ohta K,Yachie A,et al.Cytoprotective role of heme oxygenase(HO)-1 in human kidney with various renal diseases.Kidney Int,2001,60(5):1858-1866.
20 Tullius SG,Nieminen-Kelhä M,Buelow R,et al.Inhibition of ischemia/reperfusion injury and chronic graft deterioration by a singledonor treatment with cobalt-protoporphyrin for the induction of heme oxygenase-1.Transplantation,2002,74(5):591-598.
21 Bernhardt WM,Eckardt KU.Physiological basis for the use of erythropoietin in critically ill patients at risk for acute kidney injury.Curr Opin Crit Care,2008,14(6):621-626.
22 Yang FL,Subeq YM,Chiu YH,etal.Recombinanthuman erythropoietin reduces rhabdomyolysis-induced acute renal failure in rats.Injury,2012,43(3):367-373.
23梁少姗,陈惠萍,张明超,等.运动性肌红蛋白尿引起的急性肾功能衰竭.肾脏病与透析肾移植杂志,2011,20(5):490-494.
24 Lu CH,Tsang YM,Yu CW,et al.Rhabdomyolysis:magnetic resonance imaging and computed tomography findings.J Comput Assist Tomogr,2007,31(3):368-374.
25 Mårtensson J,Martling CR,Bell M.Novel biomarkers of acute kidney injury and failure:clinical applicability.Br J Anaesth,2012,109(6):843-850.
26 Lameire N,Van Biesen W,Hoste E,Vanholder R.The prevention of acute kidney injury an in-depth narrative review Part 2:Drugs in the prevention of acute kidney injury.NDT plus2009;2(1):1-10.
27 Better OS,Abassi ZA.Early fluid resuscitation in patients with rhabdomyolysis.Nat Rev Nephrol,2011,7(7):416-422.
28 Karajaia V,Mansour W,Kellum JA.Diuretics in acute kidney injury.Minerva Anestesiol,2009,75(5):251-257.
29 Ronco C.Extracorporeal therapies in acute rhabdomyolysis and myoglobin clearance.Crit Care,2005,9(2):141-142.
30 Boutaud O,Moore KP,Reeder BJ,et al.Acetaminophen inhibits hemoprotein-catalyzed lipid peroxidation and attenuates rhabdomyolysis-induced renal failure.Proc Natl Acad Sci U S A,2010,107(6):2699-2704.
31张凯悦,徐 斌,吴丛业,等.局部枸橼酸联合小剂量低分子肝素抗凝在连续性肾脏替代治疗中的应用.肾脏病与透析肾移植杂志,2012,21(4):311-316.
32 Wei Q,Hill WD,Su Y,et al.Heme oxygenase-1 induction contributes to renoprotection by G-CSF during rhabdomyolysis-associated acute kidney injury.Am J Physiol Renal Physiol,2011,301(1):F162-F170.
33 Turaga KK,Sugimoto JT,Forse RA.A meta-analysis of randomized controlled trials in critically ill patients to evaluate the dose-response effect of erythropoietin.J Intensive Care Med,2007,22(5):270-282.
34 Yousefipour Z,HerculeH,TruongL,Oyekan A,NewazM.Ciglitazone,a peroxisome proliferator-activated receptor γ inducer,ameliorates renal preglomerular production and activity of angiotensin II and thromboxane A2 in glycerol-induced acute renal failure.J Pharmacol Exp Ther,2007,322(2):461-468.
