茶多酚对淀粉消化酶动力学的影响
2013-08-07柴艳伟张根义
柴艳伟,张根义
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122)
淀粉作为人类主要能量来源,其消化性与人体健康密切相关。淀粉消化性的测定主要分体外和体内两种方法,体外测定方法较多,其中Englyst法[1]采用双酶水解法,能够较准确地模仿淀粉消化的胃肠道内环境,常被用作一种简单快捷的淀粉消化性的体外测定方法。已有大量研究表明茶多酚(tea polyphenols,TPLs)具有许多生理活性,能影响多种慢性疾病的致病机制;另外,茶多酚能够显著抑制淀粉酶活性[2-5],如唾液淀粉酶、α-淀粉酶及葡萄糖苷酶等,降低葡萄糖的产生速率。近年来,茶多酚对淀粉的消化性和餐后血糖应答反应的影响也越来越多的受到关注。研究表明,茶多酚能通过氢键作用和疏水相互作用与酶结合,从而改变酶的构象,影响酶的活力[6]。也已有大量研究表明,茶多酚对α-淀粉酶有强烈的抑制作用,但是有关茶多酚对淀粉葡萄糖苷酶影响的研究较少。本文主要目的是通过研究茶多酚对猪胰α-淀粉酶和淀粉葡萄糖苷酶(产自Rhizopus mold)两种酶的动力学影响,测定茶多酚的存在是否影响含有茶多酚等酚类物质的食品体系中淀粉的体外消化特性,以期为食品工业中淀粉消化性测定提供一定的参考。
1 材料与方法
1.1 材料与仪器
普通玉米淀粉(烘干后使用) 市售;茶多酚 杭州和田生物技术有限公司;猪胰α-淀粉酶(PPA) EC 3.2.1.1,VI-B型,19.6U/mg,Sigma公司;淀粉葡萄糖苷酶EC 3.2.1.3 产自Rhizopus mold,21100U/g,无锡诺维信酶制剂公司;EnzChek®Ultra Amylase Assay Kit E33651 Molecular Probes公司;HK法葡萄糖测定试剂盒 爱尔兰Megazyme公司;乙腈、三氟乙酸 色谱纯,国药集团化学试剂有限公司;其余试剂 分析纯,国药集团化学试剂有限公司。
SpectraMax M5酶标仪 美国Molecular Devices公司;F-7000型荧光光谱仪 日本日立公司;1200高分离度快速液相色谱仪 美国安捷伦科技有限公司;恒温水浴振荡器,离心机等。
1.2 实验方法
1.2.1 茶多酚基本组成成分的测定 利用高效液相以四种单体的标准品作对照,对茶多酚样品的成分进行测定。采用紫外检测器,Hypersil BDS C18柱,柱温25℃,检测波长280nm,流动相为乙腈-水(含一定体积分数的三氟乙酸)溶液,梯度洗脱,流动相流速为1.0mL/min。
1.2.2 茶多酚对猪胰α-淀粉酶(PPA)动力学的影响 采用EnzCheck®α-淀粉酶试剂盒(E33651)测定猪胰α-淀粉酶的酶活。
最大抑制率与IC50的测定:向96 孔板中加入100μL的200μg/mL DQ-淀粉溶液,然后加入100μL的α-淀粉酶与茶多酚的混合液,使最终体系中α-淀粉酶的浓度为5mU/mL(最适酶浓度范围),茶多酚的浓度分别为0~25μg/mL,在37℃避光保温30min(最适反应时间)后,采用F-7000荧光仪测反应产物的荧光强度。空白对照中不加α-淀粉酶,实验中所用溶剂均为1×缓冲液(MOPS 0.05mol/L,pH 6.9)。抑制率按下式计算:

式中,A为不加茶多酚组扣除相应不加酶空白对照的荧光值,B为添加茶多酚组扣除相应不加酶空白对照的荧光值。
抑制类型的测定:不同浓度的DQ-淀粉(0~100μg/mL)与5mU/mL α-淀粉酶和16μg/mL茶多酚在37℃避光保温30min后,测反应产物的荧光强度,相应的空白对照不加α-淀粉酶。以1/[DQ-淀粉](mg/mL)为横坐标,以1/[V]为纵坐标做Lineweaver-Burk曲线进行动力学分析,判断茶多酚对α-淀粉酶的抑制类型。
1.2.3 茶多酚对淀粉葡萄糖苷酶动力学的影响 普通玉米淀粉(normal corn starch,NCS)作底物时需经过95℃水浴糊化20min,麦芽糖可直接溶于水中,配成一定浓度的溶液,置于37℃水浴中保温备用。
茶多酚对淀粉葡萄糖苷酶(amylodlucosidase,AMG)催化活性的影响:将预热到37℃的不同浓度茶多酚与淀粉葡萄糖苷酶的混合液加入到已经预热至37℃的底物中,使得最终体系中的酶浓度为4U/mL。准确反应3min后,用无水乙醇灭活(乙醇最终浓度为90%),经3000r/min离心20min后取上清液采用HK-试剂盒测定体系中的葡萄糖浓度。
酶促动力学常数测定:在4mg/mL茶多酚存在的情况下(对照组不加茶多酚),不同浓度的底物与4U/mL的酶准确反应3min后,用无水乙醇灭活,经3000r/min离心20min后取上清液测定体系中葡萄糖浓度。
不同浓度茶多酚对AMG荧光光谱的影响:用pH4.6的醋酸缓冲液分别配制一定浓度的淀粉葡萄糖苷酶溶液与茶多酚溶液,两者按不同比例混合,使得最终体系中酶浓度4U/mL,茶多酚浓度分别为0、0.01、0.05、0.1mg/mL,茶多酚与酶在37℃作用3min后,测定其荧光光谱。Ex为282nm,Em为300~400nm,Ex与Em的狭缝都为5nm。
1.2.4 茶多酚对Englyst法淀粉体外消化的影响 茶多酚对Englyst法中混合酶的影响:取2mL预热到37℃的25mg/mL淀粉糊化液(95℃水浴中糊化20min)置于试管中,然后加入0.5mL预先与不同浓度茶多酚已混合均匀的混合酶液(α-淀粉酶3800U/mL,AMG 13U/mL),对照组不添加茶多酚。上述反应液在37℃水浴中160r/min振荡反应5min后取100μL的上清液加入900μL无水乙醇灭酶后,经3000r/min离心20min,采用HK试剂盒测定上清液的葡萄糖含量。
不同浓度茶多酚对淀粉消化的影响:将500mg的普通玉米淀粉及玻璃珠置于三角瓶中,同时加入20mL醋酸钠缓冲液(pH=5.2),混合均匀后在95℃水浴中糊化20min,转入37℃水浴,待温度恒定后加入5mL已预热到37℃的混合酶液(α-淀粉酶3800U/mL,淀粉葡萄糖苷酶13U/mL),其中茶多酚组的混合酶液预先加入不同量的茶多酚并混合均匀,使得最终体系中茶多酚的浓度为淀粉浓度的10%和25%。上述反应液在37℃水浴中以160r/min分别振荡反应20、40、60、120min后取100μL的上清液加入900μL无水乙醇灭酶后,经3000r/min离心20min,采用HK试剂盒测上清液的葡萄糖含量。
2 结果与讨论

图1 茶多酚样品HPLC吸附曲线Fig.1 HPLC profile of tea polyphenols
经HPLC检测分析,实验中所用茶多酚的四种单体的含量如下:EGC占14.81%、EGCG占48.75%、EC占5.09%、ECG占9.28%,四种单体的含量总和为77.93%,此外还含有咖啡碱等少量其他物质。
2.1 茶多酚对α-淀粉酶动力学的影响
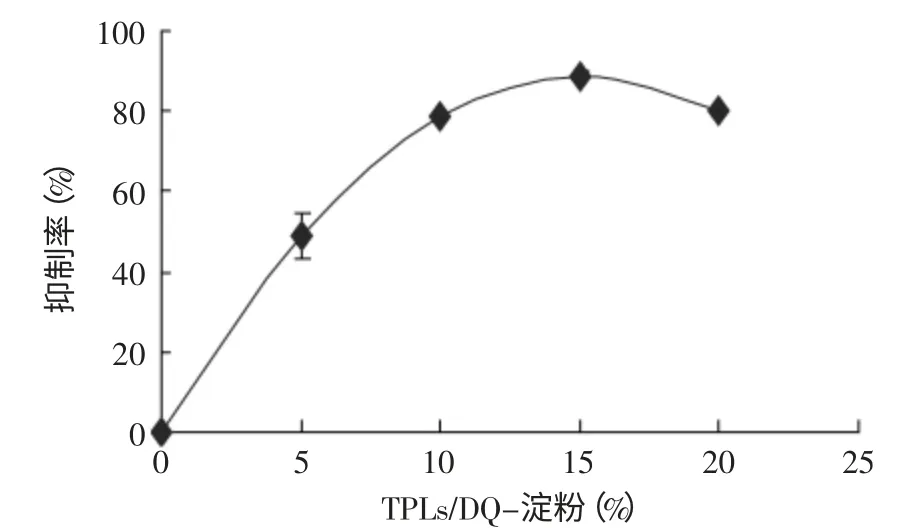
图2 TPLs对猪胰α-淀粉酶抑制率的测定Fig.2 The inhibition profile of PPA activity by TPLs
所用EnzCheck®α-淀粉酶试剂盒(E33651)中含有一种被BODIPY荧光染色剂标记的淀粉衍生物-DQTM-淀粉,荧光染色剂与淀粉连接后其荧光被猝灭。淀粉酶能有效的降解该淀粉衍生物,随着淀粉被消化,荧光染色剂同时被释放,反应释放的荧光强度与淀粉酶的酶活力成正比。之所以使用该试剂盒是因为其具有快速高效、灵敏度高、操作方便等优点;并且,相比传统的测定淀粉酶活力的DNS法来说,该试剂盒的测定结果不受茶多酚等具有还原性的物质的影响,测定结果更准确。
如图2所示,茶多酚对α-淀粉酶的催化活性具有明显的抑制作用。随着茶多酚的浓度增加,其对α-淀粉酶的抑制效果也明显增加。在茶多酚的浓度达到15%(TPLs/DQ-淀粉)时,对α-淀粉酶的催化活性抑制率达到最大值88%。当茶多酚浓度继续增加时,其对酶活力的抑制效果不再增加。除此之外,还采用Michaelis-Menten动力学模型对抑制类型进行了研究。图3采用双倒数作图法,以1/[DQ-淀粉](mg/mL)为横坐标,以1/[V]为纵坐标做Lineweaver-Burk曲线,结合米氏方程计算得到:添加茶多酚后α-淀粉酶的Vmax由1666.7min-1降低到1333.3min-1,Km没有发生变化,为67.3μg/mL,由此判断茶多酚对α-淀粉酶的抑制作用属于非竞争性抑制,与文献报道的结果一致[3-4,7]。

图3 TPLs对PPA的抑制动力学曲线(Lineweaver-Burk双倒数图)Fig.3 The Lineweaver-Burk plot between enzyme reaction rate and substrate concentration of DQ starch for PPA
2.2 茶多酚对淀粉葡萄糖苷酶动力学及荧光光谱的影响
决定蛋白质具有荧光特性的三种最主要的氨基酸分别为色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe),三者的荧光强度比通常为100∶9∶0.5,所以通常可以认为蛋白质的荧光特性主要由其结构中的色氨酸(Trp)经激发后产生的。通过测定加入茶多酚前后酶蛋白溶液的荧光强度的变化,可以推测出茶多酚与酶蛋白溶液的相互作用的情况以及酶蛋白构象的变化[8]。
如图4所示,以282nm为激发波长,淀粉葡萄糖苷酶在338nm处具有最大发射波长。当加入茶多酚后,随着茶多酚浓度的增加,淀粉葡萄糖苷酶的荧光强度随之降低,在茶多酚达到0.1mg/mL时,淀粉葡萄糖苷酶荧光强度已接近完全猝灭;但茶多酚加入并未改变淀粉葡萄糖苷酶的最大发射峰的波长。茶多酚对淀粉葡萄糖苷酶的荧光猝灭的结果表明,茶多酚能与淀粉葡萄糖苷酶产生相互作用,改变淀粉葡萄糖苷酶的构象,使暴露在外的色氨酸数目减少,进而使得淀粉葡萄糖苷酶发生荧光猝灭。

图4 TPLs对淀粉葡萄糖苷酶的荧光猝灭效应的影响Fig.4 Quenching of fluorescence spectra of AMG by TPLs
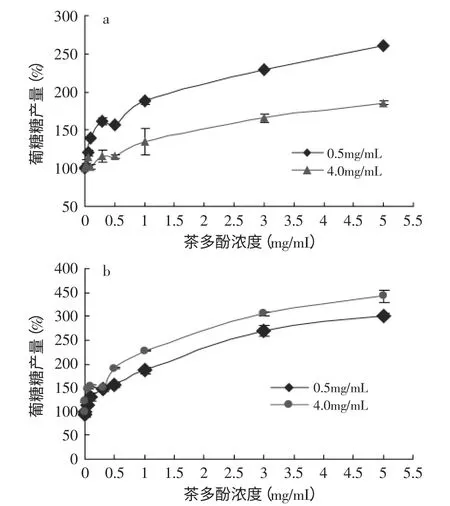
图5 TPLs对淀粉葡萄糖苷酶催化活性的影响Fig.5 Effects of TPLs on amyloglucosidase activity in different substrate systems
淀粉体外消化实验中,α-淀粉酶与淀粉葡萄糖苷酶同时加入到淀粉糊化液中,对其进行消化,因此,淀粉葡萄糖苷酶除了水解由α-淀粉酶消化淀粉产生的麦芽糖以消除麦芽糖对PPA的产物抑制作用,同时也对淀粉进行水解。如图5所示,在不同底物存在的体系中,TPLs对淀粉葡萄糖苷酶的催化活性都具有明显的促进作用。随着TPLs的浓度增加,其对淀粉葡萄糖苷酶的促进效果也明显增加。在TPLs的浓度达到3mg/mL时对酶活性的促进效果的增幅减缓。另外,从图5中还可以看出,底物浓度不同时,TPLs对淀粉葡萄糖苷酶的催化活性的促进程度也存在差别;且这种差别与底物的种类也有关系。已有研究表明,茶多酚中的羟基和没食子酰基能与酶中的极性基团形成氢键,另外,茶多酚中的疏水性没食子酰基能与酶中疏水性的氨基酸通过疏水相互作用结合。茶多酚通过氢键与疏水相互作用与酶蛋白结合后,从而显著的影响酶的催化活性,这种影响与化合物的分子结构和浓度、酶蛋白的氨基酸组成及构型等密切相关[5]。表1中数据表明不论是以麦芽糖做底物还是以普通玉米淀粉做底物,添加TPLs后淀粉葡萄糖苷酶的的Vmax都没有发生变化,Km减小,即添加茶多酚后,茶多酚与淀粉葡萄糖苷酶结合,使酶的构象发生变化,从而增加了酶与底物的亲和力。这与图4中的数据得出的结论相吻合。

表1 淀粉葡萄糖苷酶的动力学参数Table 1 Kinetic parameters of amyloglucosidase activation by TPLs
与其他已报道的的研究不同,本文中使用的淀粉葡萄糖苷酶是由Rhizopus mold霉菌产生的,以往的文献多采用哺乳动物中的葡萄糖苷酶来进行研究。大多数相关文献报道茶多酚能有效抑制哺乳动物的葡萄糖苷酶催化活性,如小鼠小肠中的α-葡萄糖苷酶等[4,6];而从图5可以看出,TPLs对由Rhizopus mold产生的淀粉葡萄糖苷酶的活性具有明显的促进作用。由此可见,来源不同的酶,相同的物质与其相互作用的情况也存在差异[9]。另外,考虑到Rhizopus mold是真菌,真菌通常与与植物共生,而酚类化合物是植物中常见的物质,推测可能Rhizopus mold与哺乳动物的生存环境不同,两者产生的葡萄糖苷酶的结构存在差异,从而使得TPLs对两种酶的催化活性的影响也截然不同。
2.3 茶多酚对Englyst法淀粉体外消化的影响
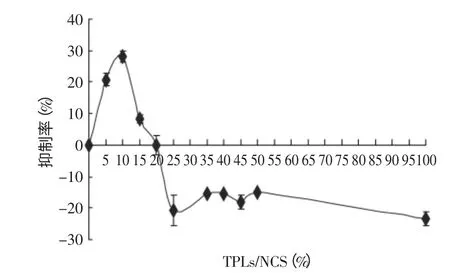
图6 TPLs对Englyst法双酶催化活性的影响Fig.6 The inhibition profile of TPLs on dual enzyme reaction
Englyst法是测定淀粉体外消化性最常用的一种方法,胰α-淀粉酶与产自真菌的葡萄糖苷酶则是该方法中常用的两种酶。图6即为Englyst法中茶多酚对两种酶影响的情况,其中抑制率表示添加茶多酚后葡萄糖生成量的变化值与淀粉对照组葡萄糖生成量的比值。从图6中可以看出,在茶多酚浓度较低时,茶多酚对混酶的催化活性存在抑制作用,当茶多酚浓度达到12.5%(TPLs/NCS)时,抑制效果最佳,抑制率达30%;当茶多酚浓度超过20%(TPLs/NCS)时,茶多酚对淀粉的消化反而起到促进作用,最大促进率为20%。由此可见,不同浓度茶多酚对Englyst中混酶体系的影响不同,并非单纯的抑制或者促进,与茶多酚的浓度密切相关。如图7所示,分别选取茶多酚的两个代表浓度:10%(TPLs/NCS)与25%(TPLs/NCS),测定了茶多酚对Englyst法淀粉体外消化性的影响。与对照组比较,添加10% TPLs组生成葡萄糖的浓度较低,淀粉的消化受到抑制;添加25%TPLs组生成葡萄糖的浓度相对较高,促进了淀粉的消化。这是因为不同浓度的茶多酚对混酶产生的作用不同,从而对淀粉消化的影响也不同。由此可见,茶多酚等酚类物质存在时,对淀粉酶的催化活性存在影响[10-11],进而对Englyst法测定淀粉的消化性结果存在一定的影响,所以在使用体外方法测定酚类物质存在的淀粉食品的消化性时,应当对酚类物质对淀粉酶的影响予以考虑,以保证测定结果的准确性。
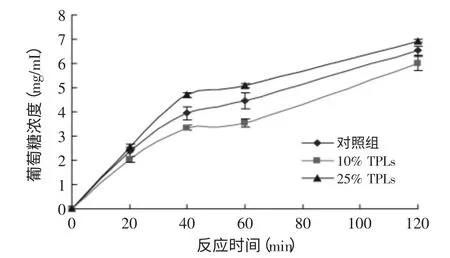
图7 不同浓度TPLs对Englyst法淀粉酶解曲线的影响Fig.7 The starch digestion profile by dual enzymatic Englyst methods affected by TPLs with different concentrations
3 结论
3.1 15%(TPLs/DQ-淀粉)的TPLs对α-淀粉酶的抑制效果最佳,抑制率达88%,抑制类型属于非竞争性抑制。
3.2 TPLs可使淀粉葡萄糖苷酶发生荧光猝灭,对淀粉葡萄糖苷酶具有明显的促进作用,添加茶多酚后淀粉葡萄糖苷酶的Vmax不变,Km减小。
3.3 12.5%(TPLs/NCS)TPLs对Englyst法混酶体系的抑制效果最佳,抑制率达30%;TPLs浓度超过20%(TPLs/NCS)时,TPLs对混酶反而起促进作用,最大促进率为20%。
3.4 与对照组比较,添加10%TPLs组淀粉的消化受到抑制;添加25% TPLs组淀粉消化则被促进。
[1] Englyst H N,Kingman S M,Cummings J H. Classification and measurement of nutritionally important starch fractions[J]. Eur J Clin Nutr,1992,46(2):S33-S50.
[2] 王文君,姚江武,陶涛.红茶和绿茶多酚对猪胰腺α-淀粉酶抑制效果的动力学研究[J]. 口腔医学研究,2008,25(4):442-446.
[3] HaraYukihiko,Honda Miwa. The inhibition of a-amylase by tea polyphenols[J]. Agric Biol Chem,1990,54:1939-1945.
[4] Young-in Kwon,Emmanouil Apostolids,Kalidas Shetty.Inhibitory potential of wine and tea against α-amylase and aglucosidase for management of hyperglycemia linked to type 2 diabetes[J]. Journal of Food Biochemistry,2008,32:15-31.
[5] Qiang He,Yuanping Lv,Kai Yao. Effects of tea polyphenols on the activities of a-amylase,pepsin,trypsin and lipase[J].Journal of Food Chemistry,2006,101:1178-1182.
[6] Koh L W,Wong L L,Loo Y Y. Evaluation of different teas against starch digestibility by mammalian glycosidases[J]. J Agric Food Chem,2010,58(1):148-154.
[7] Grussu D,D Stewart,G J McDougall,Berry Polyphenols.Inhibit α-Amylase in Vitro:Identifying Active Components in Rowanberry and Raspberry[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2324-2331.
[8] 陈国珍,黄贤智,许金钩,等. 荧光分析法[M]. 第2版. 北京:科学出版社,1990:123.
[9] Oki T,Matsui T,Osajima Y. Inhibitory effect of alphaglucosidase inhibitors varies according to its origin[J]. J Agric Food Chem,1999,47(2):550-553.
[10] Wang H,Du Y-J,Song H-C. α-Glucosidase and α-amylase inhibitory activities of guava leaves[J].Journal of Food Chemistry,2010,123(1):6-13.
[11] Bhandari M R,Jong-Anurakkun N,Hong G. α-Glucosidase and α-amylase inhibitory activities of Nepalese medicinal herb Pakhanbhed(Bergenia ciliata,Haw.)[J].Journal of Food Chemistry,2008,106(1):247-252.
