碱性H2O2预处理棉籽壳酶法生产低聚木糖的研究
2013-08-07侯丽芬孙向阳丁长河
侯丽芬,孙向阳,丁长河
(1.郑州旅游职业学院,河南郑州450009;2.郑州牧业工程高等专科学校,河南郑州450011;3.河南工业大学,河南郑州450052)
低聚木糖是功能性低聚糖的一种,具有很强的促双歧杆菌增殖能力,在促进人体自身健康、传统食品工业的高新技术改造、廉价农副产品的高附加值转化等方面发挥重要作用。随着人们对低聚木糖的功能性认识的提高,低聚木糖的应用范围会越来越广,它的市场需求也将逐年增加,发展前景十分广阔[1]。木聚糖为生物大分子,在自然状态多与其他成分如木质素复合存在。木质素被认为是酶降解植物细胞壁的限制因子[2-4],并且现已证实木聚糖与木质素是通过共价键连接的,其具体连接方式为:木聚糖的阿拉伯糖残基和葡萄糖醛酸残基同木质素的苯环通过共价键连接在一起[5-7]。在酶法生产低聚木糖的过程中,与木聚糖结合的成分会妨碍木聚糖酶的活性中心与木聚糖的接近,影响木聚糖的水解效果,进而影响低聚木糖的生成速度和最终产品的得率。因此在进行木聚糖的水解之前,必需对原料进行处理以削弱木聚糖与其他成分之间的结合力,从而大大提高酶解生产低聚木糖的效率。本研究以棉籽壳为原料,在碱性H2O2条件下对棉籽壳进行处理,通过木聚糖酶降解木聚糖制备低聚木糖,以期为有关低聚木糖生产与开发研究提供参考。
1 材料与方法
1.1 材料与设备
棉籽壳 产地河南省省民权县,已经粉碎成直径2mm及以下的颗粒,水分:9.2%,灰分:3.4%;木聚糖酶 BR,Novozymes;3,5-二硝基水杨酸、乙腈 为分析纯;其他试剂 为化学纯。
Gel Plate F 254硅胶板 Merck公司;紫外可见分光光度计 上海尤尼柯有限公司。
1.2 实验方法
1.2.1 碱性H2O2预处理条件的优化 称取一定量的原料,加入10倍体积,pH11.5(4mol/L NaOH调)H2O2溶液。
1.2.1.1 碱性H2O2的浓度 碱性H2O2预处理棉籽壳:30℃条件下预处理12h;实验浓度选择0.5%、1.0%、1.5%、2.0%、2.5%、3.0%和4.0%。
1.2.1.2 碱性H2O2预处理时间 碱性H2O2预处理棉籽壳:碱性H2O2浓度2.5%,30℃条件下;预处理选择时间为4、6、8、10、12、24h。
1.2.1.3 碱性H2O2预处理温度 碱性H2O2预处理棉籽壳:碱性H2O2浓度2.5%,预处理12h;预处理选择温度:30、40、60、80、100℃。
上述预处理之后,用清水洗至洗出液呈中性,烘干,待用。
1.2.2 酶解参数的选择和酶解效果的测定
1.2.2.1 底物的浓度 选择0.05mol·L-1,pH5.8的柠檬酸缓冲溶液为底物的浸泡液。固定加酶量为原料重量的3.0%,酶解时间为24h。棉籽壳为底物其料液比:1∶10、1∶15、1∶20、1∶25、1∶30(W/V)。
1.2.2.2 加酶量和酶解时间 棉籽壳底物固液比:1∶15(W/V)的前提下,选择加酶量为底物重量的1%、2%、3%、4%和5%;在每个加酶量条件下选取酶解时间:0、0.5、1、2、4、8、12、24h。
1.2.3 样品中木聚糖含量的测定 500mg待测样品置于研钵中,加入72%(W/W)的硫酸,研磨1h至样品完全呈均匀乳状,将研磨的乳浆状物全部转入容量瓶中并定容。充分混合均匀后,滤纸过滤,清液用地衣酚-盐酸法测定总糖含量(mg),按下式计算木聚糖含量。
木聚糖含量(%)=测定总糖含量×250×0.88/500×100
1.2.4 可溶性木聚糖的测定 地衣酚-盐酸法。取出提取液若干,加蒸馏水进行稀释至1mL,然后,加入3mL 0.1%的三氯化铁、0.3mL的1%的地衣酚溶液,加入2mL的蒸馏水,在试管振荡器上摇匀,沸水浴30min,冷却,580、670nm测其吸光度。计算两者吸光度的差值,代入差值方程,计算其含量。
木聚糖提取率(%)=可溶性木聚糖含量/原料×100
木聚糖的水解率(%)=酶解后所测得溶液中的木聚糖含量(地衣酚-盐酸法×0.88)/原料中木聚糖含量×100。
1.2.5 还原糖的测定[8]采用3,5-二硝基水杨酸(DNS)法,具体方法如下:取出提取液若干,加蒸馏水稀释,然后加DNS试剂,摇匀,沸水浴15min后,立即加入40%的酒石酸钾钠,摇匀,冷却10min,在540nm下测其吸光度,代入标准方程,计算其含量。
1.2.6 糖液中的成分组成确定方法 薄层层析法(TLC)[9]。选择乙腈和水为展开剂,乙腈∶水=85∶15;显色剂选择用5%的硫酸甲醇溶液。样品上样量为1.4~4.0μL,展开时,薄层层析板没入展开剂5mm左右,两次展开。显色剂润湿后置于130℃烘箱中烘5min左右。
2 结果与讨论
2.1 碱性H2O2预处理各因素的确定
碱性H2O2去除不同原料中木质素的效果对于pH的依赖性较强,据有关报道最适pH为11.5~11.6,如果在碱性更强的条件下其木质素的去除率基本上保持不变[10-12]。因此,碱性H2O2溶液的pH确定为11.5。
2.1.1 H2O2浓度的确定
2.1.1.1 不同H2O2浓度对木聚糖含量的影响 选择不同的H2O2浓度,30℃条件下预处理12h,棉籽壳的木聚糖含量变化如图1所示。
经不同浓度的H2O2处理后的棉籽壳木聚糖含量,在0%~1.0%范围内增幅较大,在1.0%~2.5%范围内,木聚糖含量较为稳定,而在2.5%~4.0%范围内,木聚糖含量又有较大的增幅。这可能是由于棉籽壳中木质素含量较高(17.4%),一部分木质素在较低的H2O2浓度范围内(0%~1.0%)就可以除去,而另一部分需要更高的H2O2浓度(2.5%~4.0%)才能去除掉。
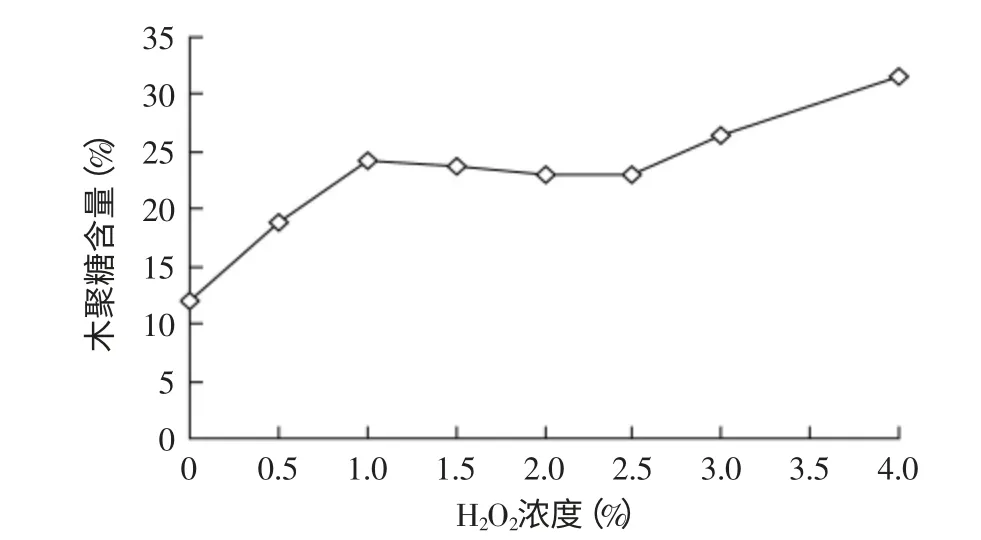
图1 不同浓度H2O2处理棉籽壳的木聚糖含量的影响Fig.1 Effect of cottonseed husk treated with different concentration H2O2 on xylan content
2.1.1.2 不同H2O2浓度对酶解效果的影响 经过不同浓度H2O2预处理后的棉籽壳加木聚糖酶(3%),酶解相同时间(8h),其相对应的木聚糖提取率和还原糖含量如图2所示。由图2中可以看出,木聚糖提取率和还原糖含量随着H2O2浓度的增大而升高。图2中棉籽壳的木聚糖提取率和还原糖含量在H2O2浓度为2.0%时,是速率增加的转折点;在此点之后其增加速率均减慢。
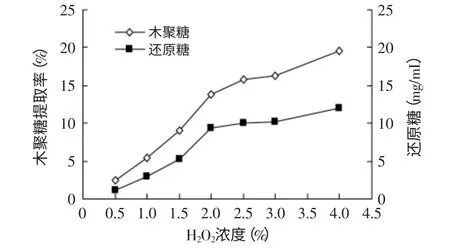
图2 不同H2O2浓度对棉籽壳酶解效果的影响Fig.2 Effect of concentration of H2O2 on the effects of enzymatic hydrolysis of cottonseed husk
经过碱性H2O2预处理后的棉籽壳在不同浓度条件下的木聚糖水解率如图3所示。H2O2浓度在0.5%~2.5%范围内时,棉籽壳的水解率随着H2O2浓度的增加而增加,且木聚糖水解率增加幅度较大,而在2.5%之后,木聚糖水解率随着H2O2浓度的增加而降低。棉籽壳的水解率在H2O2浓度为2.5%时最大,因此预处理棉籽壳的H2O2浓度选为2.5%。

图3 不同H2O2浓度对棉籽壳木聚糖水解率的影响Fig.3 Effect of concentration of H2O2 on cottonseed husk xylan hydrolysis rate influence
2.1.2 H2O2预处理时间的确定 不同预处理时间对棉籽壳木聚糖含量的影响如图4所示。不同预处理时间处理后的棉籽壳木聚糖含量随着处理时间的延长而提高,提高的幅度越来越小。但是随着预处理时间的延长预处理后的棉籽壳颜色较淡,对于后期的低聚木糖糖液的纯化工艺较为有利。本实验根据原料颜色的变化程度而选择预处理时间为12~14h。

图4 预处理时间对棉籽壳木聚糖含量的影响Fig.4 Effect of pretreatment time on cottonseed husk xylan content
2.1.3 预处理温度的确定 碱性H2O2预处理温度对棉籽壳木聚糖含量的影响如图5所示。随着H2O2预处理温度的不断升高,预处理后的棉籽壳木聚糖含量也渐渐提高,但是其木聚糖含量的升高幅度不大。出现这一现象可能是由于棉籽壳本身含有较多的木质素(17.4%),使得木聚糖在碱性条件下很难溶出,其木聚糖含量随着木质素等物质的去除而略有增大。因此,碱性H2O2预处理温度对棉籽壳木聚糖含量影响不大。实际生产中为了节省能耗、降低成本,碱性H2O2预处理温度选择30℃。
碱性H2O2法预处理条件经单因素实验选为:浓度2.5%,时间12~14h,温度30℃。在此条件下预处理得到的棉籽壳木聚糖含量31.7%,这对于木聚糖的提取率是非常重要的。
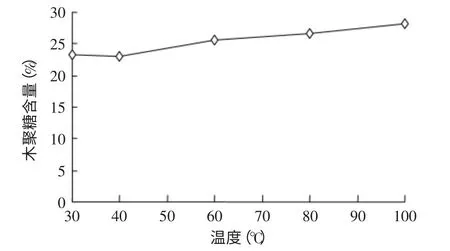
图5 预处理温度对棉籽壳木聚糖含量的影响Fig.5 Effect of pretreatment temperature on cottonseed husk xylan content
2.2 预处理后原料酶解条件的研究
2.2.1 底物浓度的确定 预处理后的棉籽壳在不同的料液比下,水解反应24h得到的木聚糖糖提取率和总还原糖如图6所示。
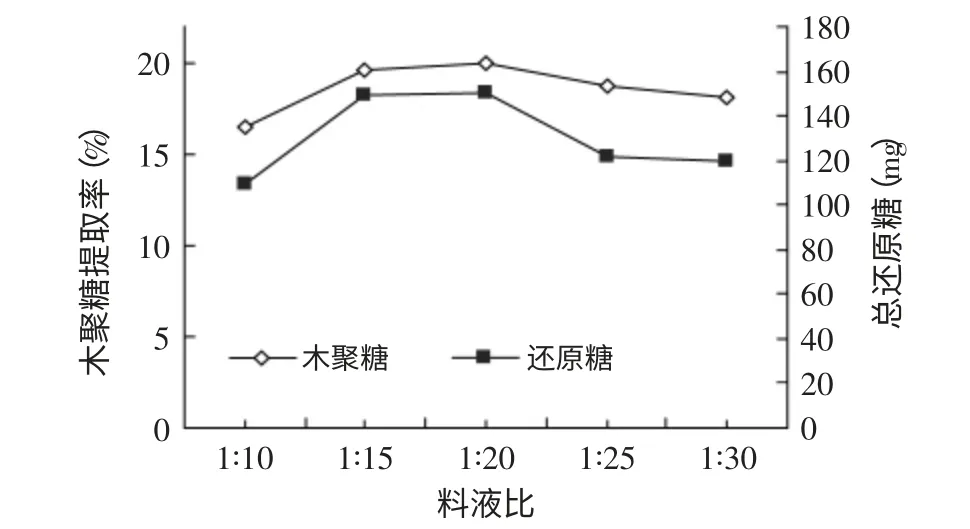
图6 料液比对棉籽壳木聚糖提取率和还原糖总量的影响Fig.6 Effect of the ratio of solid to liquid on cottonseed husk xylan extraction rate and total reducting sugar content
从图6可以看出,当料液比为1∶20的条件下,木聚糖的提取率和还原糖总量达到最高20.0%和150.2mg。当料液比1∶20到1∶30时,木聚糖的提取率和还原糖总量均降低,这可能是因为在低底物浓度时,底物中含有的可被有效水解的木聚糖组分较少,因此影响其最终得到的糖化率和还原糖含量。底物浓度对酶促反应具有很大的影响,当底物浓度远远小于Km值时,酶反应速度与底物浓度成线性关系,提高底物浓度可以提高反应速度。从生产的角度来考虑,底物浓度高对生产成本的降低有好处。棉籽壳在料液比为1∶15和1∶20条件下,木聚糖的提取率和还原糖总量很接近,分别达到19.6%、149.6mg和20.0%、150.2mg,因此,为了降低实际生产成本,选择底物浓度固液比1∶15比较合适。
2.2.2 加酶量和酶解时间的确定 棉籽壳选择在加酶量1%、2%、3%、4%和5%(相对于棉籽壳干物料)基础上反应0~24h,所得到的木聚糖提取率和还原糖含量如图7、图8所示。木聚糖的提取率和还原糖的含量随着加酶量的增加而增加。棉籽壳在加酶量1%、2%、3%、4%和5%基础上反应24h时,其木聚糖提取率和还原糖含量分别为7.5%、15.9%、18.3%、19.7%、22.1%和5.9、9.6、10.1、10.8、10.8mg·mL-1。在加酶量达到5%时,酶解所得到棉籽壳的木聚糖水解率为69.8%,而加酶量为3%时,酶解所得到的棉籽壳木聚糖水解率是57.8%,比加酶量5%时水解率低12.0%。
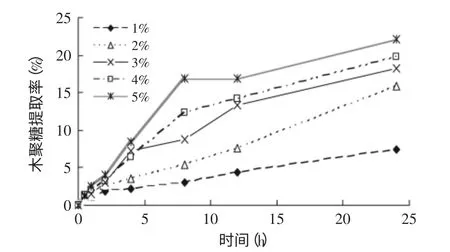
图7 棉籽壳在不同加酶量、不同水解时间下的木聚糖提取率Fig.7 Extraction rate of xylan of cottonseed husk in different enzyme concentration,hydrolysis time

图8 棉籽壳在不同加酶量、不同反应时间下的还原糖含量Fig.8 Reducing sugar content of cottonseed husk in different enzyme,different reaction time
虽然加酶量在5%时得到的棉籽壳木聚糖提取率非常高,但是棉籽壳加酶量5%与3%得到的还原糖含量仅相差0.7mg·mL-1。另外,由于商业酶价格较为昂贵,所以根据图7、图8加酶量与木聚糖提取率和还原糖增加的趋势选择加酶量为3%。
2.2.3 酶解液薄层层析色谱图(TLC) 棉籽壳加酶量3%的酶解效果TLC图见图9,从图9可以看出,对照低聚木糖标样,随着酶解时间的延长生成的木二糖越多,但是单糖的含量并没有明显的增加。另外,如果在反应24h基础上让反应继续进行,可能会在50℃这样一个微生物比较容易生长的环境下糖液被污染,而且酶解时间过长势必增加生产周期也不利于提高生产效率,因此,木聚糖酶的酶解时间可以选为24h。

图9 木聚糖酶(3%)酶解棉籽壳的TLC图(s为低聚木糖标样)Fig.9 Xylanase(3%)enzymatic hydrolysis of cottonseed husk TLC diagram
3 结论
碱性H2O2法预处理条件为:浓度2.5%,时间12~14h,温度30℃。在此条件下预处理得到的棉籽壳木聚糖含量31.7%。另外,在料液比1∶15的浓度下,加酶量为3%,50℃(木聚糖酶的最适温度)酶解24h时,棉籽壳的木聚糖提取率和水解率为18.3%和57.8%。
棉籽壳是农业纤维废弃物,利用棉籽壳制备功能性低聚木糖,在资源利用、环境保护以及促进产业化结构调整等方面均具有重要意义。本研究通过碱性H2O2对棉籽壳进行处理,木聚糖酶降解木聚糖制备低聚木糖,达到了较理想的提取率和水解率,为有关低聚木糖生产与开发研究提供了参考。
[1] 肖凯军,李娜. 不同原料酶法制备低聚木糖的研究及成分分析[J]. 中国食品添加剂,2010(4):71-76.
[2] Lequart C,Nuzillard JM,Kurek B,et al. Hydrolysis of wheat bran and straw by an endoxylanase:production and structural characterization of cinnamoyl-oligosaccharides[J]. Carbohydrate Research,1999,319:102-111.
[3] Zillox C,Debeire P.Hydrolysis of wheat straw by a thermostable endoxylanase:Adsorption and kinetic studies[J]. Enzyme and Microbial Technology,1998,22:58-63.
[4] Zillox C,Debeire P,Reis D,et al. Immunolocalization of a purified xylanase during hydrolysis of wheat straw stems [J].International Journal of Plant Sciences,1997,158:769-777.
[5] Chesson A,Gordon AH,Lomax JA. Substituent groups linked by alkali -labile bonds to arabinose and xylose residues of legume,grass and cereal straw cell walls and their fate during digestion by rumen microorganisms[J]. J Sci Food Agric,1983,34:1330-1340.
[6] Eriksson OD,Goring AI,Lindgren BO. Structural studies on the chemical bonds between lignins and carbohydrates in spruce wood[J]. Wood Sci Technol,1980,14:267-279.
[7] Das NN,Das SC,Sarkar,et al. Lignin-xylan ester linkage in mesta fiber[J]. Carbohydrate Research,1984,129:197-207.
[8] Bailey MJ,Biely P,Poutanen K. Interlaboratory testing of methods for assay of xylanase activity[J]. J Biotechnol,1992,23:257-270.
[9] Jiang ZQ,Deng W,Zhu YP,et al. The recombinant xylanase B of Thermotoga maritiama is highly xylan specific and produces exclusively xylobiose from xylans,a unique character for industrial applications[J]. J Mol Cat B Enzymatic,2004,27:207-213.
[10] Gould JM. Alkaline peroxide delignification of agricultural residues to enhance enzymatic saccharification[J]. Biotechnology and Bioengineering,1984,26:46-52.
[11] Gould JM. Studies on the mechanism of alkaline peroxide delignification of agricultural residues[J]. Biotechnology and Bioengineering,1985,27:225-231.
[12] Gould JM,Jasberg BK,Dexter LB,et al. High-fiber,noncaloric flour substitutes for baked foods. Properties of alkaline peroxide-treated ligninocellulose[J]. Cereal Chemistry,1989,66:201-205.
