耕作措施对土壤水热特性和微生物生物量碳的影响
2013-08-02何文清严昌荣刘恩科
庞 绪,何文清,* ,严昌荣,刘恩科,刘 爽,殷 涛
(1.中国农业科学院农业环境与可持续发展研究所,北京 100081;2.农业部旱作节水农业重点开放实验室,北京 100081)
土壤微生物是土壤有机质和养分循环转化的动力,土壤微生物量是土壤养分转化过程中一个重要的活性库或源,对土壤碳、氮、磷等养分的有效性及在陆地生态系统的循环产生深刻的影响。土壤微生物生物量碳(SMBC,也称土壤微生物量碳)被用作评价土壤肥力和土壤质量早期变化的有效指标[1-3]。国内外研究表明:农田生态系统中土壤微生物量碳的变化直接或间接地受温度和水分两大环境因子的控制,由于不同耕作措施输入的有机质数量不同和对土壤的扰动程度不同,改变了土壤的温度、水分环境因素和土壤物理性质,进而影响到土壤微生物量碳含量及其在各土层中的分布,Sugihara等研究表明土壤含水量是土壤微生物量碳季节变化的主要限制因子[4],而Ross在新西兰的草地和牧场上的研究表明土壤水分与土壤微生物生物量之间呈负相关,土壤水分和温度短期的波动会影响微生物生物量中碳含量[5]。Verburg等发现较高土壤温度下微生物活性增强[6],Domisch等则得到相反的结论,当土壤温度较高时,泥炭土壤中微生物生物量碳呈降低趋势[7],Arunachalam等研究表明土壤微生物群体在温度和湿度较低时较小,在雨季达到峰值[8]。国内就不同耕作措施下土壤微生物量碳在作物生育期间动态变化与其环境因子关系研究较少[9-12],研究耕作措施对土壤微生物量碳的影响对于土壤管理具有重要意义。为此本试验依托国家旱农试验基地自2003年4月开始的保护性耕作长期定位试验,对长期采用不同耕作措施后土壤的微生物量碳的动态变化以及土壤水热动态变化进行了研究,旨在为北方旱区农业耕作技术的有效运用提供科学参考依据。
1 材料与方法
1.1 试验设计
试验设在农业部寿阳旱作农业重点野外科学观测试验站,位于山西省寿阳县宗艾镇,地理位置为北纬37°51',东经113°05',海拔1130 m,属中纬度暖温带半湿润偏旱大陆性季风气候,年平均温度7.4℃,年降雨量474 mm,年蒸发量1 714 mm。保护性耕作长期定位试验始于2003年一直到2011年。土壤为褐土,轻壤。
试验设3个耕作处理:(1)全量秸秆还田(ASRT),作物收获后,利用机械将全部秸秆直接翻耕到0—20 cm的土壤中,次年春天机械浅耙镇压后人工播种,秸秆量为300—400kg/666.7m2左右;(2)免耕秸秆覆盖,作物收获后,将全部秸秆直接覆盖在农田表面,翌年春天人工免耕播种;(3)常规耕作,作物收获后将全部秸秆移出,然后在冬前进行机械深翻,深度为20 cm左右,第2年春天机械浅耙镇压后人工进行播种。
每个处理设置3次重复,小区面积为10 m×8 m=80 m2。一年一熟,种植作物为春玉米,品种为强盛31号,施纯氮75kg/hm2,P2O575kg/hm2,所有肥料均作为基肥在播种时施入,2011年5月1日播种,2011年10月9日收获。
1.2 取样方法
分别在玉米苗期、拔节期、灌浆期、成熟期进行田间取样,用土钻按0—5、5—10、10—20、20—30、30—40、40—50、50—60 cm层次采集土壤,每个小区各层行间随机采集5点混匀,3次重复。土样带回实验室除去植物残体和石块过2 mm筛,于小于4℃冰箱中储存或直接测定土壤微生物量碳。
1.3 测定项目与方法
1.3.1 土壤微生物量碳的测定
土壤微生物量碳采用Jorgensen和Mueller[13]及Vance等[14]的氯仿熏蒸K2SO4浸提法,浸提液中的微生物量碳采用K2Gr2O7加热氧化,FeSO4滴定法。每个土样重复3次测定,称取相当于烘干土重20 g湿土,放入100 mL的小烧杯中,连同盛有60 mL左右无酒精氯仿的小烧杯(里面放入少量抗暴沸磁片),一起放入真空干燥器内,真空干燥器底部加入少量水和稀碱(1 mol/L NaOH)。用真空泵抽成真空,使氯仿沸腾,并持续3 min,关闭真空干燥器的阀门,将真空干燥器放入25℃的暗室中,保持24 h。熏蒸结束取出氯仿,除尽干燥器底部的碱,再用真空泵反复抽气,直到土壤闻不到氯仿味为止。然后加入80 mL 0.5 mol/L K2SO4提取液保持土水比为1∶4,在往复式震荡其中震荡(300r/min)提取30min,迅速用中速滤纸过滤,滤液立即测定。在熏蒸开始时,取等量的土壤用80ml 0.5 mol/L K2SO4溶液浸提。土壤微生物量碳Bc(mg/kg)=Ec/Kc,式中Ec为熏蒸和未熏蒸土壤K2SO4浸提液的碳含量差值,Kc为转化系数等于0.38[14-15]。
1.3.2 土壤有机碳的测定
土壤样品在干燥通风处自然风干,前处理后研磨过100目筛,用重铬酸钾容量法测定有机碳含量[16]。
1.3.3 土壤温度的测定
采用HIOKI3633温度仪连续测定土壤埋深5、15cm和25cm处土壤温度,每30min测定1次,数据采集仪自动记录,所得数据按不同层次平均。
1.3.4 土壤水分的测定
土壤含水量使用时域反射仪(TDR)测定,每 15d 测定1 次,测定深度分别为:20、40、60、80、100、120、140、160、180cm,每次降雨以后加测1次。
作物生育期内土壤贮水量根据如下公式计算:

式中,H为土壤贮水量,单位为mm,Qi为第i层土壤体积含水量,用(%)表示,hi为第i层土壤厚度,单位为cm,i为测土壤体积含水量时的层序,i从 1到 9分别表示土壤深度为 0—20,20—40,40—60,…,160—180 cm。
1.3.5 土壤紧实度的测定
土壤紧实度采用SC900土壤紧实度仪(美国)测定2.5、5、7.5、…、45cm处土壤紧实度。
2 结果与分析
2.1 不同耕作措施下土壤水分、温度、紧实度动态变化
2.1.1 不同耕作措施下土壤水分动态
免耕覆盖与全量还田处理均明显的提高不同深度的土壤含水量(图1)。在玉米生育区内,土壤含水量呈上升趋势,前期(5—6月份)降雨较少土壤含水量低,后期(7—9月份)降雨量多土壤水分含量高,尤其是7月份降雨量144mm、9月份降雨量110mm。除灌浆期表层土壤水量大于底层以外,其余各时期,表层土壤都低于底层,这主要是旱区总降雨量少土壤表面蒸发的结果,免耕覆盖与秸秆还田可以有效的减少土壤表面蒸发提高表层土壤含水量。在降雨较少的播前与苗期(5—6月份),免耕覆盖与秸秆还田处理0—180 cm土壤水贮量显著高于常规耕作处理。
免耕覆盖处理显著提高了耕层(0—20 cm)土壤含水量,播前和苗期较常规耕作平均提高了17%,这有助于玉米的出苗,在拔节、灌浆至成熟期比常规耕作提高了20%以上,特别是灌浆期比常规耕作提高了30%。全量还田处理下耕层(0—20 cm)由于翻耕而疏松,秸秆分散在该土层,较常规耕作土壤含水量高,但保水效果低于免耕覆盖处理。在20—100 cm土层范围内,全量还田处理下土壤含水量在播前、苗期、拔节期和成熟期明显大于免耕覆盖处理。
2.1.2 不同耕作措施下土壤温度动态变化
不同耕作措施显著影响土壤的温度,尤其在玉米前期。3种耕作措施下表层5、15cm以及耕层下25cm处日平均温度的变化趋势大体相同,且与气温之间的变化情况一致,前期温度低,随着生育期递进开始升高,到后期又降低(图2)。在苗期表层不同耕作措施对土壤温度的影响差异达到显著水平,5cm处常规耕作处理日平均温度最高,达19.44℃,全量还田处理次之,为18.76℃,免耕覆盖最低,为18.12℃,免耕覆盖和全量还田处理平均温比常规耕作分别低1.32℃和0.69℃,15cm处免耕覆盖和全量还田比常规耕作分别低1.34℃和0.9℃,25 cm处免耕覆盖和全量还田处理比常规耕作分别低1.57℃和0.19℃,因此在苗期免耕覆盖与全量还田处理有“降温效应”。随着生育期的推进,大气温度升高各处理间差异逐渐变小,拔节期、灌浆期各处理之间没有显著性差异。到成熟期大气温度开始降低,各耕作处理之间差异又开始变大,此时全量还田处理具有一定的“增温作用”。

图1 不同耕作措施下土壤含水量变化Fig.1 Soil volumetric moisture content under different tillage practice
2.1.3 不同耕作措施下土壤紧实度变化
土壤的紧实度是反映土壤物理性质的一个重要指标,也是土壤微生物量一个重要的影响因素。研究结果显示(图3),不同耕作措施下不同层次和不同时期土壤紧实度存在较大的差异。播前,耕层(0—20cm)土壤紧实度以免耕覆盖处理最高,平均为1240 kPa,全量还田与常规耕作分别为350 kPa和540 kPa,随着土壤深度的增加,土壤紧实度逐渐增加,在20—45cm土层,全量还田与常规耕作处理土壤紧实度均较表层土壤明显增大,常规耕作处理最高,为1 800 kPa。玉米生育期内,耕层(0—20cm)土壤紧实度大小依次为,免耕覆盖>常规耕作>全量还田,20—45 cm表现为常规耕作>全量还田>免耕覆盖。玉米收获时,耕层(0—20cm)土层紧实度仍以免耕覆盖处理最高,但是处理间差异不显著,20—45cm土壤紧实度表现为常规耕作>全量还田>免耕覆盖。
因此免耕覆盖措施对土壤紧实度的影响主要表现在表层,对深层的土壤结构是具有一定的改善作用,常规耕作措施主要是表层土壤的疏松措施较多,故表层土壤紧实度较小,深层土壤紧实度由于压实而增高。
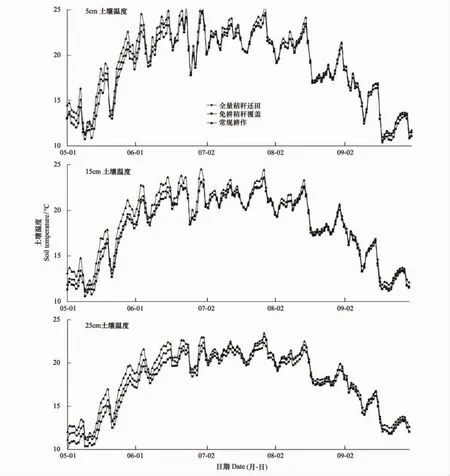
图2 不同深度土壤温度动态变化(2011)Fig.2 Soil temperature dynamics at 5 cm,15cm and 25cm depths(2011)
2.2 不同耕作措施对土壤有机碳的影响
土壤有机碳是土壤系统中重要的功能物质,具有稳定和改善土壤结构、调节土壤持水性,减少土壤侵蚀,为作物提供碳源,提高产量的功能。研究结果显示(表1),不同耕作措施下土壤有机碳含量表现出一定规律性。不同层次间有机碳含量差异明显,0—20 cm土层内,NTSM处理下有机碳含量随着土层深度增加逐层递减,ASRT和CT处理下SOC在0—20cm内无显著差异,20cm以下逐层递减。与CT处理相比,0—5cm内,ASRT处理下SOC含量提高3.6%,NTSM显著提高24.8%;5—10 cm内,NTSM处理下SOC含量显著提高15.3%,ASRT处理下增加4.2%,NTSM处理下SOC含量显著高于ASRT处理;10—20cm内,ASRT处理下SOC含量提高5%,NTSM处理下SOC含量显著提高10%。20—60cm内,3种处理下SOC含量趋于一致,无显著差异。

图3 不同耕作措施对土壤紧实度的影响Fig.3 The soil compaction in different tillage treatments
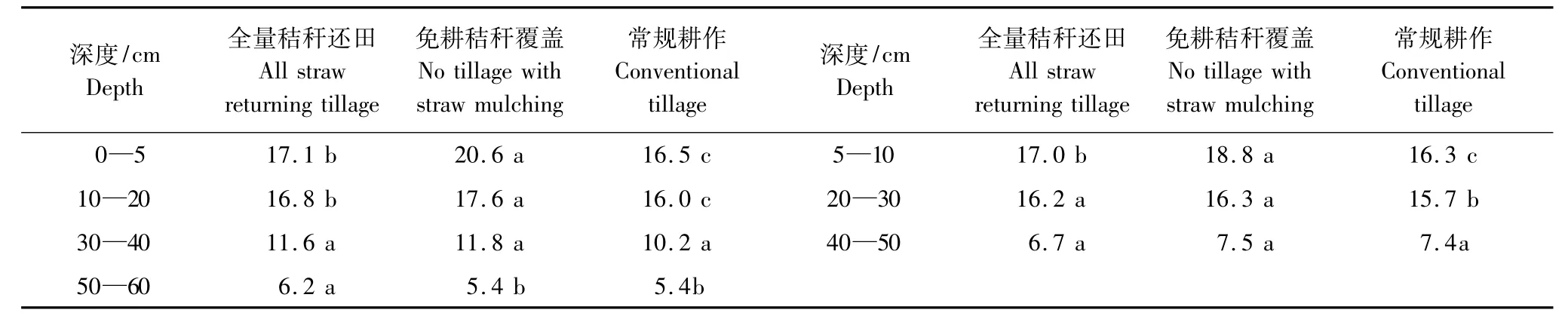
表1 不同耕作措施对土壤有机碳含量的影响Table 1 Effect of tillage practices on soil organic carbon/(g/kg)
2.3 不同耕作措施下土壤微生物量碳的变化
土壤微生物量碳的多少反映了土壤同化和矿化能力的大小,是土壤活性大小的标志。土壤微生物量碳对不同的耕作制度表现极为敏感[17-18]。研究结果表明(表2),所有处理的土壤微生物量碳在玉米生育期内皆表现出相似的变化规律,即随着生育期的推进,土壤微生物量碳首先迅速上升,在玉米生育高峰期即拔节期达到高峰,然后逐渐下降趋于平缓。不同耕作措施下土壤微生物量碳随土壤深度呈递减的趋势。
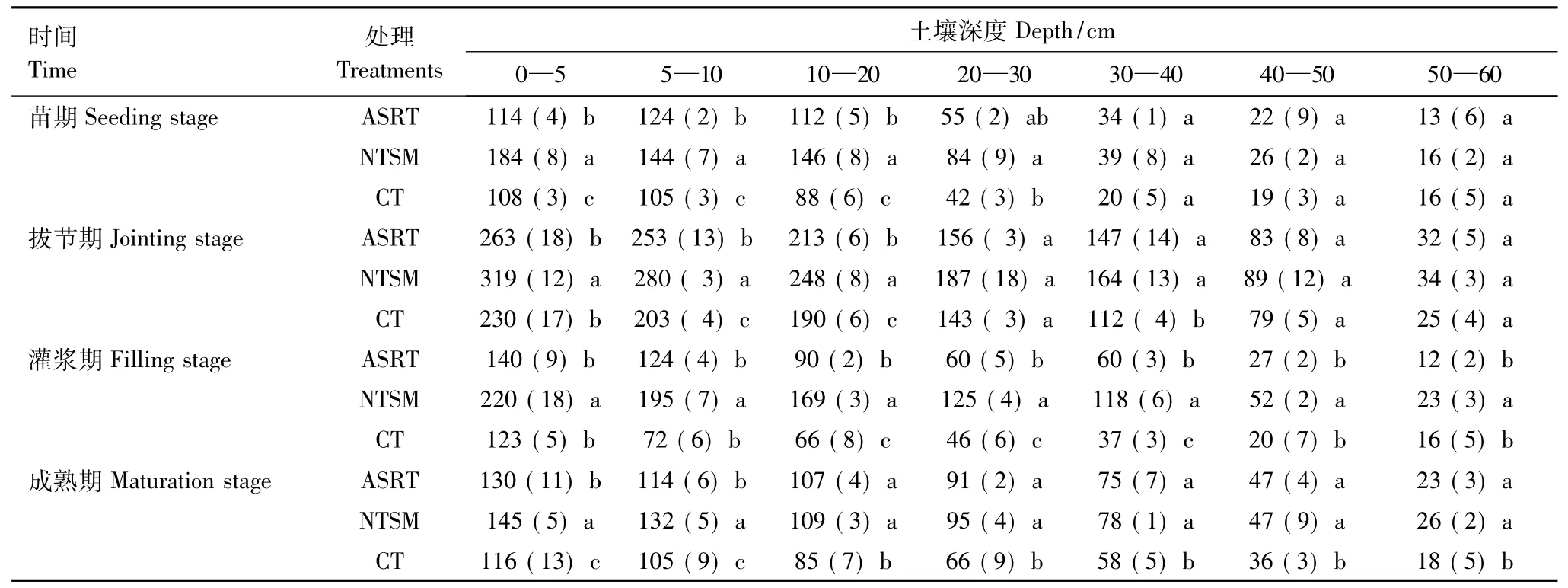
表2 不同耕作措施下的土壤微生物量碳/(mg/kg)Table 2 Soil microbial biomass under different tillage
耕层(0—20 cm)免耕覆盖处理各生育期显著高于传统耕作与全量还田处理,全量还田处理显著高于传统耕作处理;20 cm以下土层在苗期与拔节期各处理之间差异不显著,在灌浆期免耕覆盖显著高于全量还田与传统耕作,全量还田与传统耕作之间无显著差异,在成熟期免耕覆盖与全量还田处理无显著差异,两个处理均显著高于传统耕作处理。
不同耕作处理显著影响土壤微生物量碳的含量与分布,免耕覆盖处理下土壤表层微生物量碳在苗期、拔节期、灌浆期、成熟期分别比传统耕作处理高70%、40%、85%和30%,全量还田处理分别比传统耕作处理高出10%、20%、15%和15%,总体上不同耕作处理在耕层对土壤微生物量碳影响显著,耕层以下影响不显著。
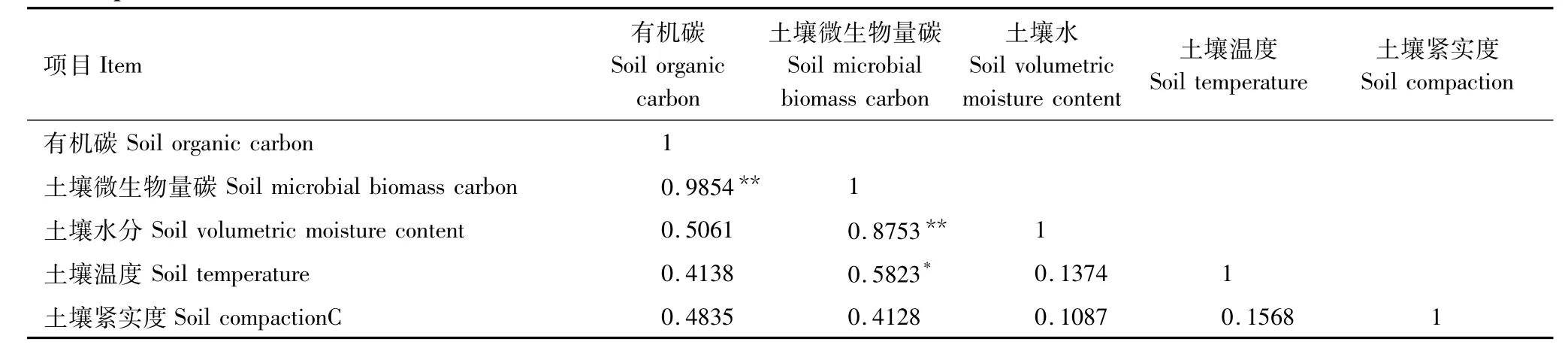
表3 土壤微生物量碳、有机碳、水分、温度、紧实度之间相关分析Table 3 Correlation between soil microbial biomass carbon and soil organic carbon,soil volumetric moisture content,soil temperature and soil compaction
3 讨论
免耕覆盖与全量还田处理可显著提高各土壤层次的体积含水量,起到明显的蓄水保墒作用,在玉米前期降雨量少有助于玉米的生长,在生育后期随降雨的增多,免耕覆盖与全量还田储存更多的土壤水。免耕覆盖能够提高土壤含水量,主要是由于免耕秸秆覆盖,在作物播种期可以减少表层水分蒸发,显著增加表层土壤含水量,起到明显的保水保墒作用。但随着生育进程的推进,作物覆盖度增加,蒸腾作用在蒸散量中占据主导地位,秸秆覆盖的抑蒸效果逐渐减弱,这时也是降雨最多的时期(7—9月),免耕覆盖处理蓄水能力较常规耕作显著高,这是因为免耕覆盖由于其土壤结构较好,有利于土壤上下层的水流运动和气体交换,而常规耕作处理深层土壤紧实度较大,蓄水性能低[19]。不同耕作措施对温度的影响主要体现在前期,免耕覆盖与全量还田处理在玉米前期有显著的“降温效应”,全量还田在后期大气温度降低后具有“增温作用”。免耕覆盖处理在玉米苗期平均降低1.32℃,全量还田处理降低0.69℃,其原因可能是秸秆覆盖能在土壤表面形成一道物理阻隔层,拦截和吸收太阳辐射,阻碍土壤与大气间的水热交换,土壤温度日变化平缓。土壤温度的降低可能会降低土壤矿化,有利于有机质积累,但是温度的降低不利于微生物的生存。
在农业生态系统中,土壤微生物量碳在作物生育期内动态变化主要受环境条件(干湿、气温)和植物生长等因子的综合影响。植物和微生物的许多生命活动需要水分的参与,微生物产生的胞外酶和有机物的扩散都需要在液相中进行,因此当含水量低时会降低微生物的移动导致微生物量的减少,而当土壤含水量过高时,土壤大孔隙则会充满水,此时氧气的扩散就会受到抑制不利于微生物的活动也会降低微生物的量。有不少研究者曾尝试将土壤水分与土壤微生物量之间的关系数量化。李香真沿着水分梯度采集了蒙古高原不同草原类型表层土壤样品144个,分析了土壤微生物量C、N含量及其与年平均温度和降雨量的关系,结果表明蒙古高原草原土壤微生物量碳与降雨量表现出了很好的相关性[20]。微生物的生命活动都是由一系列生物化学反应组成的,而这些反应受温度影响又极其明显,故温度成了影响微生物生长繁殖的重要因素之一,土壤中微生物需要的温度范围在25—34℃之间,因此土壤温度影响有机质的积累与分解,养分的转化和水气运动等。但有关温度对微生物生物量碳影响的结论各不相同[21],Verburg等发现较高土壤温度下微生物活性增强[6],Domisch等则得到相反的结论,当土壤温度较高时,泥炭土壤中微生物生物量碳呈降低趋势[7],Joergensen等认为,除土壤温度的间接作用外(如影响植物生长),只有当其处于较低(低于6℃)或较高(35℃以上)的情况下,才会对土壤微生物生物量产生大的影响,成为土壤微生物活动的主要限制因子,引起微生物生物量碳的大幅度下降[22]。本研究中,微生物量碳与水分的相关性极显著,因此可以说免耕覆盖与全量还田处理显著提高土壤水分有助于土壤微生物量碳含量的提高。土壤微生物量碳与温度的相关性显著(表3),表明土壤微生物量碳随土壤温度升高而变大。土壤微生物量随季节性变化与有机物的供应和植物生长状况及温、湿等环境因素有关,多年免耕覆盖使表层土壤紧实度增加,致使玉米在耕层的根系更加发达。
各生育期免耕覆盖的表层土壤微生物量碳都高于传统耕作,是由于土壤微生物以异养型种群为主,其生命活动过程需要消耗一定的能量,免耕不扰动土层,植物残体主要积累在表土层中,相应地可供微生物维持生命活动的能量充足。同时连续免耕使土壤耕层变浅,植物根系多集中分布于表土层,根的残茬及大量的低分子量的根系分泌物也加剧了土壤微生物的繁衍,使其生命活动旺盛,土壤微生物量碳与土壤水分、温度之间存在显著的相关性(表3)。而传统耕作条件下,土壤受到频繁扰动,通气性增加,土壤团聚体易遭破坏,微生物与有机物的接触面增大,从而使土壤原有有机质矿化分解,相应地土壤微生物量碳也较低。全量还田处理经过翻耕处理秸秆均匀分散在耕层,能够提高表层的有机质含量而且比传统耕作保水效果高,土壤微生物量碳高,这与前人研究结果基本一致[23-27]。土壤微生物量碳在整个生育期的动态变化是:首先迅速上升,在玉米生育高峰期(拔节期)达到最高峰,然后开始下降,成熟期趋于平缓,与前人研究相似在拔节期土壤温度也是整个生育期最高时段[28],土壤含水量也是伴随着降雨量急剧升高,环境因子的改善与土壤微生物量碳的增加表现出一致性。土壤微生物量碳的动态变化同样与作物生长有着一定关系,随着玉米生育期的推进土壤微生物量碳急剧增加,土壤微生物量碳在拔节期达到高峰期正是玉米生育的旺盛时期,该时期是土壤释放易吸收可利用养分最多时期,又是作物吸收养分最多时期,微生物量碳的增加有利于碳和氮的转化与循环。玉米生育后期,根系的分泌物和死亡的根是微生物丰富的能源物质,微生物量碳维持在一定的水平上。
4 结论
免耕覆盖与全量还田处理显著提高土壤含水量,与常规耕作相比表层土壤体积含水量在玉米苗期、拔节期、灌浆期和成熟期分别高出18%、22%、29%、21%和3%、10%、12%、13%,具有保水保墒的作用。土壤温度随大气温度变化在拔节期达到生育期内最高温度随后开始下降,苗期不同耕作措施对土壤温度的影响达到显著水平,其中免耕覆盖具有降温作用,5 cm处免耕覆盖、全量还田与常规耕作处理土壤温度依次为:18.12、18.76℃和19.44℃,免耕覆盖和全量还田处理平均温度比常规耕作分别低1.32℃和0.69℃。土壤微生物量碳在整个生育期动态变化是:首先迅速上升,在玉米生育高峰期(拔节期)达到最高峰,然后开始下降,成熟期趋于平缓;免耕覆盖与全量还田处理下玉米各生育期土壤表层微生物量碳显著高于常规耕作,在苗期、拔节期、灌浆期和成熟期分别比常规耕作高出70%、40%、85%、30%和10%、20%、15%、15%。微生物量碳与水分的相关性极显著,免耕覆盖与全量还田处理能显著提高土壤水分,从而有助于土壤微生物量碳含量的提高。土壤微生物量碳与温度的相关性显著,表明土壤微生物量碳随土壤温度升高而增加。
[1]Gary D B,Mary K T,Francis R,Marie-Claude M,Martin W.Microbial and biochemical soil quality indicators and their potential for differentiating areas under contrasting agricultural management regions.Soil Biology and Biochemistry,2004,36(11):1785-1792.
[2]Liu Z F,Fu B J,Liu G H,ZhuY G.Soil quality:concept,indicators and its assessment.Acta Ecologica Sinica,2006,26(3):901-913.
[3]Ren T Z,Grego S.Soil bioindicators in sustainable agriculture.Scientia Agricultura Sinica,2000,33(1):68-75.
[4]Sugihara S,Shinya F,Method K,Takashi K.Effect of land management and soil texture on seasonal variations in soil microbial biomass in dry tropical agro ecosystems in Tanzania.Applied Soil Ecology,2010,44(1):80-88.
[5]Ross D J.Soil microbial biomass estimated by the fumigation-incubation procedure:seasonal fluctuation and influence of soil moisture content.Soil Biology and Biochemistry,1987,19(4):397-404.
[6]Verburg P S J,Dam V D,Hefting M,Tietema A.Microbial transformation of C and N in a boreal forest floor as affected by temperature.Plant and Soil,1999,208(2):187-197.
[7]Domisch T,Finer L,Lehto T,Smolander A.Effect of soil temperature on nutrient allocation and mycorrhizas in Scots pine seedlings.Plant and Soil,2002,239(1):173-185.
[8]Arunaehalam A,Arunaehalam K.Influence of gap size and soil properties on microbial biomass in a subtropical humid forest of north-east India.Plant and Soil,2000,223(1):185-193.
[9]Chen Y,Chen B,Zhang J,Zhang R Z.Effects of no-tillage on soil microbial biomass carbon.Ecology and Environment,2008,17(6):2370-2373.
[10]Song Q H,Li F M,Liu H S,Wang J,Li S Q.Effect of plastic film mulching on soil microbial biomass in spring wheat field in semi-arid loess area.Chinese Journal of Applied Ecology,2003,14(9):1512-1516.
[11]Sun J,Liu M,Li L J,Liu J H,Zhang X J.Influence of non-tillage and stubble on soil microbial biomass and enzyme activities in rain-fed field of Inner Mongolia.Acta Ecologica Sinica,2009,29(10):5509-5514.
[12]Zhang L H,Huang G B,Zhang R Z.Effect of No-tillage on soil microbial biomass C,N and P in rain-fed agriculture.Gansu Agr.Sci.and Techn,2006,12(1):3-6.
[13]Joergensen R G,Mueller T.The fumigation-extraction method to estimate soil microbial biomass:Calibration of the kEN value.Soil Biology and Biochemistry,1996,28(1):33-37.
[14]Vance E D,Brookes P C,Jenkinso D S.An Extraction method for measuring soil microbial biomass C.Soil Biology and Biochemistry,1987,19(6):703-707.
[15]Wu J.Measurement of soil microbial biomass C by fumigation-extraction-an automated procedure.Soil Biology and Biochemistry,1990,22(8):1167-1169.
[16]Bao S D.Soil and Agricultural Chemistry Analysis.Beijing:Agriculture Publication,1999:30-35.
[17]Wang Y,Shen Q R,Shi R H,Huang D M.Soil microbial biomass and its ecological effects.Journal of Nanjing Agricultural University,1996,19(4):45-51.
[18]Wu J S,Xiao H A.Measuring the gross turnover time of soil microbial biomass C under incubation.Acta Pedologica Sinica,2004,41(3):401-407.
[19]Liu S,He W Q,Yan C R,Liu Q,Effects of different tillage management on soil physical properties in dryland.Agricultural Research in the Arid Rreas,2010,28(2):65-70.
[20]Li X Z,Qu Q H.Soil microbial biomass carbon and nitrogen in Mongolian grassland.Acta Pedologica Sinica,2002,39(1):97-104.
[21]Contin M,Corcimaru S,De Nobili M,Brookes P C.Temperature changes and the ATP concentrations of the soil microbial biomass.Soil Biology and Biochemistry,2000,32(8):1219-1225.
[22]Joergensen R G,Brookes P C,Jenkinson D S.Survival of the microbial biomass at elevated temperatures.Soil Biology and Biochemistry.1990,22(8):1129-1136.
[23]Govaerts B,Mezzalama M,Yusuke U,Ken D,Luna-Guido M,Vankerck K,Deckers J.Influence of tillage,residue management,and crop rotation on soil microbial biomass and catabolic diversity.Applied soil ecology,2007,37(1/2):18-30.
[24]Ahl C,Joergensen R G,Andeler E K,Meyer B,Woehler V.Microbial biomass and activity in silt and sand loams after long-term shallow tillage in central Germany.Soil and Tillage Research,1998,49(1/2):93-104.
[25]Gosai K,Arunachalam A,Kumar B D.Tillage effects on soil microbial biomass in a rainfed agricultural system of northeast India.Soil and Tillage Research,2010,109(2):68-74.
[26]Alvear M,Rosas A,Rouanet J L,Borie F.Effect of three soil tillage systems on some biological activities in an Ultisol from southern chile.Soil and Tillage Research,2005,82(2):195-202.
[27]Zhang J,Yao Y Q,Jin K,LU J J,Wang C H,Wang Y H,Li J H,Ding Z Q.Change of SMBC and SMBN under conservation tillage on sloping dryland.Journal of Soil and Water Conservation,2007,21(4):126-129.
[28]Song R,Wu C S,Mu J M,Jiang Y.Dynamic changes of soil microbial biomass carbon and soil enzyme activities during growth of Corn.Journal of Jilin Agricultural University,2001,23(2):13-16.
参考文献:
[2]刘占锋,傅伯杰,刘国华,朱永官.土壤质量与土壤质量指标及其评价.生态学报,2006,26(3):901-913.
[3]任天志,Grego S.持续农业中的土壤生物指标研究.中国农业科学,2000,33(1):68-75.
[9]陈英,陈蓓,张军,张仁陟.免耕覆盖对土壤微生物量碳的影响.生态环境,2008,17(6):2370-2373.
[10]宋秋华,李凤民,刘洪升,王俊,李世清.黄土区地膜覆盖对麦田土壤微生物体碳的影响.应用生态学报,2003,14(9):1512-1516.
[11]孙建,刘苗,李立军,刘景辉,张星杰.免耕与留茬对土壤微生物量C、N及酶活性的影响.生态学报,2009,29(10):5509-5514.
[12]张丽华,黄高宝,张仁陟.旱作条件下免耕对土壤微生物量碳、氮、磷的影响.甘肃农业科技,2006,12(1):3-6.
[16]鲍士旦.土壤农化分析,第三版,北京:中国农业出版社,1999:30-35.
[17]王岩,沈其荣,史瑞和,黄东迈.土壤微生物量及其生态效应.南京农业大学学报,1996,19(4):45-51.
[18]吴金水,肖和艾.土壤微生物量碳的表观周转时间测定方法.土壤学报,2004,41(3):401-407.
[19]刘爽,何文清,严昌荣,刘勤,不同作措施对旱地农田土壤物理特性的影响.干旱地区农业研究,2010,28(2):65-70.
[20]李香真,曲秋皓.蒙古高原草原土壤微生物量碳氮特征.土壤学报,2002,39(1):97-104.
[27]张洁,姚宇卿,金珂,吕军杰,王聪慧,王育红,李俊红,丁志强.保护性耕作对坡耕地土壤微生物量碳、氮的影响.水土保持学报,2007,21(4):126-129.
[28]宋日,吴春胜,牟金明,姜岩.玉米生育期内土壤微生物量碳和酶活性动态变化特征.吉林农业大学学报,2001,23(2):13-16.
