氟化物对家蚕血液羧酸酯酶及全酯酶活性的影响
2013-08-02阮成龙李姣蓉付巧娟杜文华李冠楠隆耀航
米 智,阮成龙,李姣蓉,付巧娟,杜文华,李冠楠,隆耀航,朱 勇
(西南大学生物技术学院,重庆 400716)
近年来随着工农业的发展,陶瓷、砖瓦、磷肥、炼铝、水泥、玻璃、火力发电和金属冶炼等部门排放以氟化物为主的大气污染给蚕桑生产带来的危害越来越大。氟化物是一类原生质毒剂,研究表明,氟化物随桑叶进入蚕体累积于消化液、肠壁和体壁等处,通过消化管进入血液,在血液和组织中与蛋白质结合,抑制生长发育,出现氟中毒症状[1]。氟中毒能损害中枢神经系统,内分泌系统及心、肝、肾等,并引起生物酶学改变和免疫功能改变[2]。
酯酶是昆虫体内一种重要的代谢酶,属于水解酶,具有广泛的底物专一性。一方面杀虫剂对酯酶活性有抑制作用,另一方面酯酶可对某些杀虫剂进行代谢[3-4]。羧酸酯酶(Carboxylesterase,CarE,EC3.1.1)是一种解毒水解酶。能够与进入昆虫体内的有机磷杀虫剂快速结合,将杀虫剂在到达靶标作用位点之前阻隔或降解,降低杀虫剂对昆虫的毒害,使昆虫产生抗性[5-6]。CarE能够催化酯类和酰胺类化合物水解,在神经递质的传递过程中起重要作用[7]。在抗性昆虫中,CarE活性的提高主要是由基因扩增使得表达量的增加(量变)或催化效率提高(质变)所引起的[8-11]。传统方法主要通过单个基因的克隆、表达和突变分析等,来研究基因在抗性形成中的作用[12-15]。
本试验通过研究家蚕添食NaF后血液中全酯酶和CarE的活性变化,为从生理生化水平上阐明家蚕对氟化物的代谢机制提供参考。
1 材料与方法
1.1 试验材料
家蚕耐氟品种T6、敏感品种734,由中国农业科学院蚕业研究所提供,西南大学生物技术学院家蚕遗传育种室保存。按照常规方法饲养到5龄起蚕时,对照组喂食清水浸泡11 min后自然晾干的新鲜桑叶,试验组分别用50、100、200、400 mg/kg NaF溶液浸泡11 min后自然晾干的桑叶饲养[16],每隔8 h添食1次,每天添食3次。试验采用平行设计,每组设3个重复。从5龄起蚕第1—7天每天分别取各组幼虫的血液样品。
1.2 家蚕血液酶液的制备
将蚕体表用蒸馏水擦洗处理后,并用吸水纸擦干,使蚕体弯曲,用无菌剪刀剪其腹足让血液滴入放有少许苯基硫脲的预冷离心管中,在0—4℃,5000r/min离心15min,取上清液用0.04mol/L pH7.0的PBS稀释50倍作为酶液,放置于-70℃冰箱内备用。
1.3 测定方法
1.3.1 羧酸酯酶标准曲线的制作
取 7 个干燥洁净的试管依次分别加入 1×10-4mol/L α-萘酚 0、0.2、0.4、0.8、1.2、1.6、2.0 mL,对应加0.04mol/L pH7.0 磷酸缓冲液 6.0、5.8、5.6、5.2、4.8、4.4、4.0mL,然后分别加入显色剂(1% 固蓝 B 盐(需避光保存)和5%SDS按2∶5混合,现配现用)1mL,摇匀后30℃水浴保温30 min,在600 nm处测定OD值,重复3次,以OD600的平均值为纵坐标,α-萘酚的浓度为横坐标,绘制标准曲线。所得方程为:y=30.99x-0.008,R2=0.999。
1.3.2 家蚕血液羧酸酯酶活性测定
参照Van Aspern[17]的方法适当修改后进行,每个样品重复测定3次。2500μL 3×10-4mol/L的α-醋酸萘酯溶液(含1×10-4mol/L毒扁豆碱)和500 μL工作酶液(20 μL酶液和480 μL 0.04mol/L pH 7.0 PBS)混合,在30℃水浴中反应30min后,加入500 μL显色剂后,摇匀,静置15min,待溶液变成稳定的蓝色后,用分光光度计在600nm处测OD值。根据30min内生成的α-醋酸萘酚的毫摩尔数表示酶的活性(μmol/mL α-萘酚)。
1.3.3 家蚕血液全酯酶活性测定
同羧酸酯酶测定方法[17]基本一样,只是在α-醋酸萘酯溶液中不加毒扁豆碱溶液。
1.4 数据统计
试验数据使用Excel软件对CarE和全酯酶活性做柱状图分析;运用SPSS17.0软件对CarE和全酯酶的活性采用Duncan方法进行多重比较,比较的显著水平为P=0.01。
2 结果与分析
2.1 氟化物对家蚕血液CarE活性的影响
2.1.1 相同暴露浓度下的时间效应关系
整体上来看,734、T6各浓度NaF处理组的前3d CarE活性都很平稳,734的400mg/kg NaF处理组在第2天酶活性上升的幅度较大,其余各浓度处理组在第2天稍有上升;T6的100mg/kg NaF处理组在第2天呈上升趋势,其余各浓度处理组在第2天略呈下降趋势。在后4d内734各浓度NaF处理组的CarE活性变化范围较大,第4天的酶活性均高于前3d的,且对照组、100、400mg/kg NaF处理组均出现了峰值;第5天的50mg/kg NaF处理组的酶活性仍上升,200mg/kg NaF处理组的酶活性略呈下降趋势,其余各组下降幅度较大;最后2d内,对照组、200、400mg/kg NaF处理组呈上升趋势,50mg/kg NaF处理组在第6天下降,第7天上升,100mg/kg NaF处理组呈平缓的下降趋势。T6各处理组的CarE活性与734相比较平稳,对照组在第6天的CarE活性最高,达12μmol/mL,其余时间段均小于8μmol/mL;50mg/kg NaF处理组在4-6d内呈下降趋势,第7天活性又上升;100mg/kg NaF处理组在第4天活性最高,最后3d活性很平稳,约3μmol/mL;200mg/kg NaF处理组在4—5d的酶活性较平稳,在6—7d时酶活性上升,且达最大值;400mg/kg NaF处理组在4—7d内CarE活性一直很平稳,在2—5μmol/mL之间波动。
2.1.2 同一暴露时间内的浓度效应关系
添氟处理1d后,734随着添氟浓度的增加,CarE活性呈先降后升再降的变化趋势,而T6呈先降后升的趋势;添氟处理2d后,734CarE活性随着添氟浓度的增加呈先降后升的趋势,T6的100mg/kg NaF处理组的活性稍高于其他处理组,其余各组的活性均很相近;添氟处理3d后,734的400mg/kg NaF处理组的CarE活性显著低于其他处理组,其余各组的活性很平稳,T6的50mg/kg NaF处理组低于其他各处理组;添氟处理4d后,734各处理组的变化范围较大,呈“W”型,T6的2个高浓度添氟组的酶活性低于其余3个处理组;添氟处理5d后,734各处理组的变化仍很大,呈“M”型,且50mg/kg NaF处理组的酶活性最高,T6添氟组的酶活性低于对照组,100mg/kg NaF处理组的酶活性最低;添氟处理6d后,734呈现先降后升再降的趋势,且400mg/kg NaF处理组的酶活性最低,T6添氟组的酶活性显著低于对照组;添氟处理7d后,734和T6添氟组的变化趋势基本一致,734对照组的酶活性最高,而T6对照组的酶活性最低。

图1 734的5龄幼虫添食NaF后血液CarE活性的变化Fig.1 Variations of CarE activity of hemolymph in 5th instar larvae of Bombyx mori 734 after treatment with NaF
2.2 添食氟化物对家蚕血液全酯酶活性的影响
2.2.1 相同暴露浓度下的时间效应关系
对照组中,734全酯酶活性前2d呈下降趋势,后5d里酶活性变化很平稳略高于前2d,T6随添氟时间的增加酶活性呈上升趋势,且在第4、7天分别出现峰值;50mg/kg NaF处理组,734前4d呈先降后升的趋势,后3d酶活性呈平缓的下降趋势,T6整体上呈上升趋势,在第2、4、7天出现峰值;100 mg/kg NaF处理组,734前3d呈平缓的下降趋势,后4d呈波浪式变化,T6前3d全酯酶活性较相似,第4天出现一个上升的峰值,后3d呈上升的趋势;200 mg/kg NaF处理组,734在试验期酶活性基本相似,仅在第1、4天略高于其它时间点,T6前3d酶活性很平稳,第4天酶活性稍升高,后3d酶活性呈上升趋势;400 mg/kg NaF处理组,734第6天全酯酶活性显著低于其他时间点,其余6d的酶活性在62—64μmol/mL之间波动,T6的全酯酶整体上呈平稳的上升趋势。
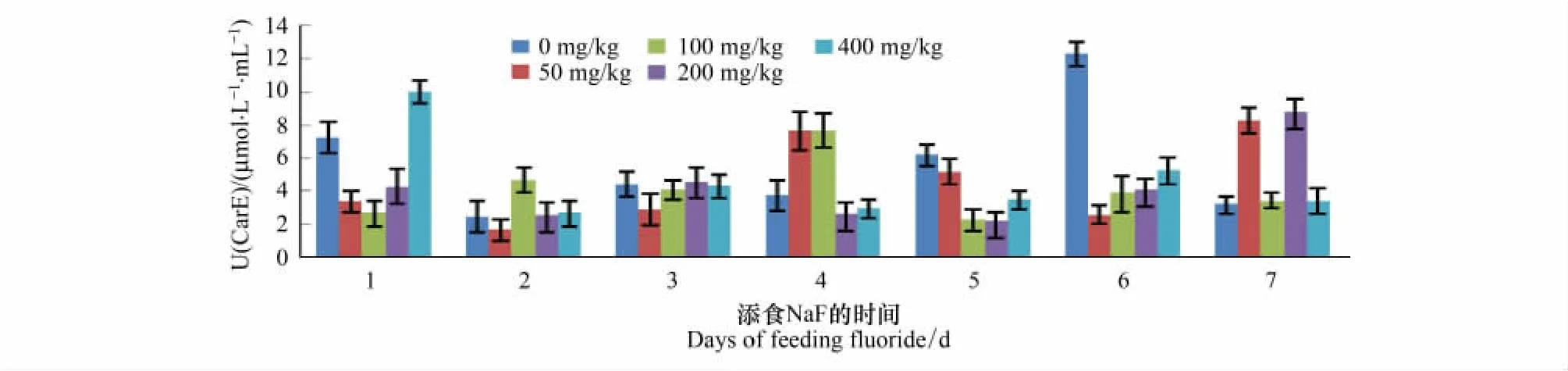
图2 T6的5龄幼虫添食NaF后血液CarE活性的变化Fig.2 Variations of CarE activity of hemolymph in 5th instar larvae of Bombyx mori T6 after treatment with NaF
2.2.2 同一暴露时间内的浓度效应关系
添氟处理1d后,734的50mg/kg NaF处理组的酶活性最低,之后随着添氟浓度增加,酶活性升高,但400 mg/kg NaF处理组的酶活性低于200 mg/kg NaF处理组,T6各浓度之间的酶活性几乎为一直线,50 mg/kg NaF处理组略低于其它处理组,100 mg/kg NaF处理组略高于其他组;添氟处理2d后,734对照组和50 mg/kg NaF处理组的全酯酶活性呈下降趋势,之后随着浓度的增加酶活性增加,T6各浓度的酶活性约为一直线,50 mg/kg NaF处理组酶活性略高于其它组,200 mg/kg NaF处理组略低于其它组;添氟处理3d后,734全酯酶的变化趋势同处理2d后相似,T6各处理组酶活性几乎仍是一直线,呈稍稍下降趋势;添氟处理4d后,734对照组和两个低浓度组呈下降趋势,200 mg/kg NaF处理组略上升,而400 mg/kg NaF处理组又下降,T6对照组和两个低浓度的酶活性相当,但远大于两个高浓度处理组的活性;添氟处理5d后,734的酶活性变化同处理4d后,T6随着浓度的增加呈下降趋势;添氟处理6d后,734对照组和两个低浓度处理组的酶活性变化较平稳,而两个高浓度组的酶活性呈骤降趋势,T6全酯酶活性同添氟处理5d后的变化趋势;添氟处理7d后,734全酯酶活性变化较平稳,几乎呈一直线,而T6对照组的酶活性最高,50、100和200mg/kg NaF处理组酶活性很平稳,400mg/kg NaF处理组酶活性骤降。

图3 734的5龄幼虫添食NaF后血液全酯酶活性的变化Fig.3 Variations of esterase activity of hemolymph in 5th instar larvae of Bombyx mori 734 after treatment with NaF
2.3 不同浓度氟化物及氟化物处理后不同天数的CarE活性差异分析
734的两个低浓度添氟组不仅和对照组而且与两个高浓度添氟组之间的差异均极显著,但对照组与高浓度添氟组之间的差异不显著;而T6各处理组之间的差异均不显著。2品种间在各个添氟浓度下的差异极显著(表1)。
734的CarE活性在添氟后4、6、7d与其他时间点差异极显著,而且第7天与前6d的酶活性差异也极显著,T6在添氟处理后7d内的CarE活性差异均不显著。2品种添氟后1d和3d差异不显著,其余各时间点差异极显著(表2)。

图4 T6的5龄幼虫添食NaF后血液全酯酶活性的变化Fig.4 Variations of esterase activity of hemolymph in 5th instar larvae of Bombyx mori T6 after treatment with NaF
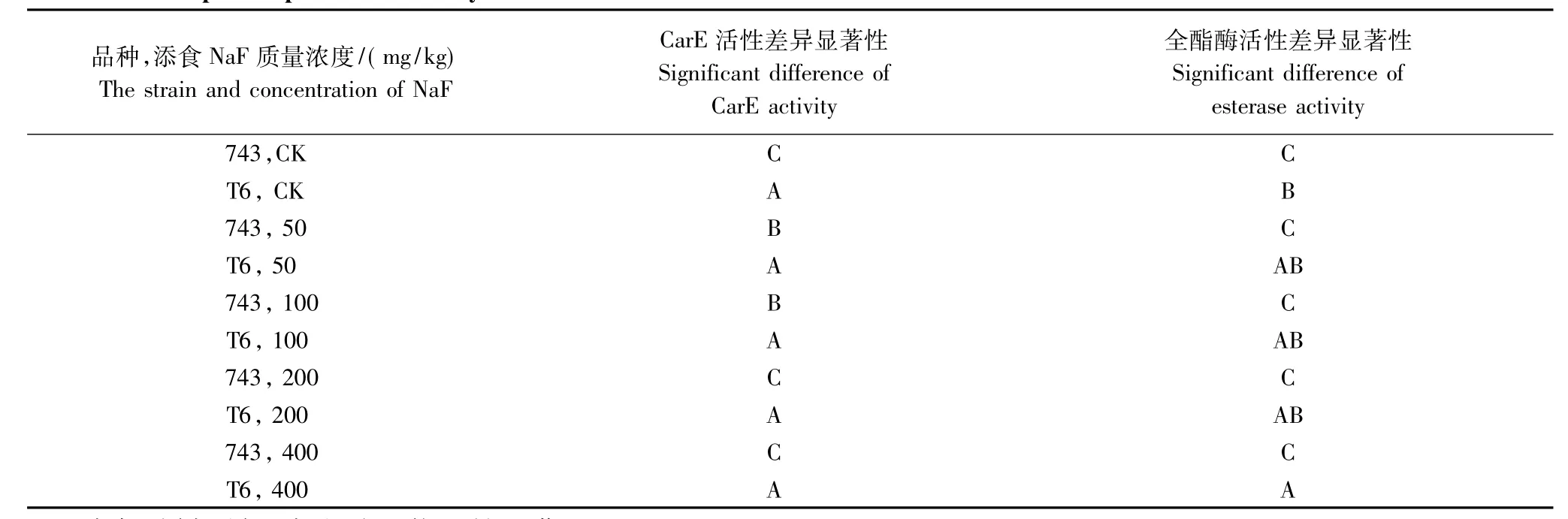
表1 734与T6添食不同浓度氟化物后CarE和全酯酶活性多重比较Table 1 Multiple comparison on activity variations of CarE and esterase between 734 and T6 after treatment with different sodium fluoride

表2 734与T6添食NaF后不同时间段CarE和全酯酶活性多重比较Tabel 2 Multiple comparison on activity variations of CarE and esterase at different time between 734 and T6 after treatment with sodium fluoride
2.4 不同浓度氟化物及氟化物处理后不同天数的全酯酶活性差异分析
734各处理组之间的差异均不显著,T6对照组与高浓度添氟组差异极显著,2品种在同一添氟浓度间的差异极显著(表1)。
734在添氟后第2天与第4、5、7天差异极显著,T6添氟分为1—3d、4—6d和7d三组,三组之间的差异极显著,组内差异不显著。2品种在添氟处理后的各个时间段差异极显著(表2)。
3 讨论
CarE是多功能家族酶,普遍存在于动物、植物、昆虫和微生物中,并在异生物质(药物、杀虫剂、致癌物等)的解毒、信息素的降解、神经的发生和调控中扮演着重要角色[18]。CarE水解包含羧酸酯、酰胺和硫酯等官能团的化学物质,在药物代谢和杀虫剂解毒方面发挥着重要的作用[19]。二斑叶螨(Tetranychus urticae)对杀螨剂的抗性通常与体内解毒酶[20-22](酯酶、多功能氧化酶、谷胱甘肽S-转移酶)的变化有关,也涉及靶标不敏感机制[23]。Van Leeuwen等[24]测定了田间多抗二斑叶螨酯酶活性,发现抗性种群中的酶活性较敏感品系为高。Achaleke等[25]发现抗拟除虫菊酯的棉铃虫酯酶活性高于敏感品系。很多学者用不同昆虫实验同样得出了CarE活力与拟除虫菊酯和有机磷的抗性成正相关,分子生物学研究已经证实,酯酶活性的升高是由于酯酶结构基因的扩增[26]。而本实验对家蚕进行添食NaF,检测其血液中的CarE活性,得到了与其相反的结论,原因可能是氟化物和常用的有机杀虫剂在化学结构上有本质区别,杀虫剂进入昆虫体内后,抑制了靶酶正常的生理功能,或作用于神经轴突阻断了神经传导或产生毒素而导致昆虫死亡,而氟化物可能是酶的抑制剂,替换了酶活性位点中的某些离子,使酶活性下降。也可能与CarE表达和活性存在物种和组织特异性有关[27]。734在1—3d时,各处理组(400 mg/kg NaF处理组除外)的CarE活性变化平稳,且添氟组的活性低于对照组,因为蚕体自身的免疫系统可以在短时间内抵抗毒物的危害,各种与解毒相关的酶在此期间发挥其相应的作用[28],但在4—7d时,各个添氟处理组的CarE活性出现无规律大幅度的变化,尤其400 mg/kg NaF处理组,在整个实验期波动范围最大,高浓度NaF处理则能引发蚕体短时间中毒,进而导致蚕体代谢系统紊乱,氟可能以间接的方式,在高剂量下扰乱酶系统已被报道[29]。734的两个低浓度添氟组的活性不仅和对照组而且与两个高浓度添氟组之间的差异均极显著(P<0.01)。T6各处理组酶活性差异不显著。
酯酶是昆虫体内一种重要的解毒酶系,它可以通过水解酯类毒性化合物的酯键,或与亲脂类有毒化合物结合,降低其有效浓度来降低有毒化合物的毒性。因此,酯酶在昆虫对这几类杀虫剂的抗性中起着重要的作用[30-31]。T6和734添食NaF后全酯酶的平均活性都表现出下降的趋势,说明NaF对家蚕血液全酯酶的活性也起到抑制作用。734的50 mg/kg添氟组在1—3d的酶活性处于最低,推测可能是低浓度的NaF在短期内对敏感品种家蚕全酯酶的抑制作用很大,而高浓度NaF使蚕体及早进入各项防御应激措施,避免受到严重损害。T6两个高浓度添氟组在2—7d内的全酯酶活性一直低于其他处理组,在6—7d最高浓度添氟组的全酯酶活性远低于其他处理组,长时间添食高浓度的氟化物,会严重抑制蚕体全酯酶的活性,影响蚕体正常生长发育,甚至死亡。整体上T6各处理组的全酯酶活性在4—7d的活性要高于前3d的活性,随着时间的增加,蚕体要为进入化蛹阶段做准备,故要提高各种解毒酶的活性或增加各种解毒酶的量来作用氟化物。T6与734两品种的全酯酶在相同时间点活性差异均极显著(P<0.01)。
本实验结果表明,不论是CarE还是全酯酶,734的酶活性要大于T6,可能是敏感品种在NaF作用下,蚕体需要大量的解毒酶或提高相关酶活性来代谢或作用于NaF,而耐氟品种其蚕体本身对NaF的代谢或抵抗能力很强,故其酶活性低于敏感品种,推测家蚕血液中的CarE和全酯酶活性与蚕体的耐氟性能有一定的相关性,但这2种酶在家蚕对氟化物代谢过程中的作用机制,有待进一步研究。
致谢:感谢西南大学生物技术学院朱勇教授对实验的指导。
[1]Huang J T,Zhu W M,Xia J G,Xiang Z H.Complete Work of Sericultural Technology in China.Chengdu:Sichuan Publishing House of Science&Technology,1996:462-467.
[2]Zhang P.Research Progress on Fluorine of the Hereditary Toxicity.livestock and poultry industry,2009,238(2):42-44.
[3]Ownsu E O,Horiike M,Hirano C.Polyacrylamide Gel Electrophoretic Assessments of Esterases in Cotton Aphid(Homoptera:Aphididae)Resistance to Dichlorvos.Journal of Economic Entomology,1996,89(2):302-306.
[4]Ownsu E O,Horiike M,Hirano C.Inhibition by insecticides of partially purified Carboxylesterases from Aphis gossypii(Homoptera:Aphididae).Journal of Economic Entomology,1996,89(2):307-310.
[5]Gopalan N,Bhattacharya B K,Prakash S,Rao K M.Characterization of Carboxylesterases from Malathion-Resistant Culex quinquefasciatus Say(Diptera:Culicidae)Mosquitoes.Pesticide Biochemistry and Physiology,1997,57(2):99-108.
[6]Karunaratne S H,Jayawardena K G,Hemingway J,Ketterman A J.The function of esterases in insecticide resistance in Culex quinquefascitatus mosquitoes from Sri Lanka.Biochemical Society Transactions,1993,21(4):482S.
[7]Li X C,Schuler M A,Berenbaum M R.Molecular Mechanisms of Metabolic Resistance to Synthetic and Natural Xenobiotics.Annual Review of Entomology,2007,52:231-253.
[8]Huang J,Qiao C L.Mechanism and Application of Insect Detoxifcation Enzymes in Bioremediation of Pesticide Contamination.Agro-environmental Protection,2002,21(3):285-287.
[9]Hemingway J.The molecular basis of two contrasting metabolic mechanisms of insecticide resistance.Insect Biochemistry and Molecular Biology,2000,30(11):1009-1015.
[10]Vaughan A,Hemingway J.Cloning and sequence of the full-length cDNA for a major insecticide resistance gene worldwide in the mosquito Culex quinquefasciatus.Journal of Biological Chemistry,1995,270(28):17044-17049.
[11]Vaughan A,Hawkes N,Hemingway J.Co-amplification explains linkage disequilibrium of two mosquito esterase genes in insecticide resistant Culex quinquefasciatus.Biochemical Journal,1997,325(Pt2):359-365.
[12]Zhang L,Shi J,Shi X Y,Liang P,Gao J P,Gao X W.Quantitative and qualitative changes of the carboxylesterase associated with betacypermethrin resistance in the housefly,Musca domestica(Diptera:Muscidae).Comparative Biochemistry and Physiology B-Biochemistry &Molecular Biology,2010,56(1):6-11.
[13]Khajuria C,Buschman L L,Chen M S,Siegfried B D,Zhu K Y.Identification of a novel aminopeptidase P-like gene(OnAPP)possibly involved in Bt toxicity and resistance in a major corn pest(Ostrinia nubilalis).PLoS One,2011,6(8):e23983.
[14]Yu X L,Wang M,Kang M J,Liu L,Guo X Q,Xu B H.Molecular cloning and characterization of two nicotinic acetylcholine receptor beta subunit genes from Apis cerana cerana.Archives of Insect Biochemistry and Physiology,2011,77(4):163-178.
[15]Karatolos N,Williamson M S,Denholm I,Gorman K,Ffrench-Constant R H,Bass C.Over-expression of a cytochrome P450 is associated with resistance to pyriproxyfen in the greenhouse whitefly Trialeurodes vaporariorum.PLoS One,2012,7(2):e31077.
[16]Huang L L,Wei B Y,Meng Y Y.Experiment about soaking time of sodium fluoride solution on concentration changes of mulberry leaf containing fluoride.Guangxi Sericulture,2005,42(4):5-7.
[17]Van Asperen K.A study of housefly esterases by means of a sensitive colorimetric method.Journal of Insect Physiology,1962,8(4):401-416.
[18]Yu Q Y,Lu C,Li W L,Xiang Z H,Zhang Z.Annotation and expression of carboxylesterases in the silkworm,Bombyx mori.BMC Genomics,2009,10(1):553.
[19]Yang D F,Pearce R E,Wang X L,Gaedigk R,Wan Y J Y,Yan B F.Human carboxylesterases HCE1 and HCE2:ontogenic expression,interindividual variability and differential hydrolysis of oseltamivir,aspirin,deltamethrin and permethrin.Biochemical Pharmacology,2009,77(2):238-247.
[20]Tsagkarakou A,Pasteur N,Cuany A,Chevillon C,Navajas M.Mechanisms of resistance to organophosphates in Tetranychus urticae(Acari:Tetranychidae)from Greece.Insect Biochemistry and Molecular Biology,2002,32(4):417-424.
[21]Ay R,Yorulmaz S.Inheritance and detoxification enzyme levels in Tetranychus urticae Koch(Acari:Tetranychidae)strain selected with chlorpyrifos.Journal of Pest Science,2010,83(2):85-93.
[22]Ay R,Kara F E.Toxicity,inheritance of fenpyroximate resistance,and detoxification-enzyme levels in a laboratory-selected fenpyroximate-resistant strain of Tetranychus urticae Koch(Acari:Tetranychidae).Crop Protection,2011,30(6):605-610.
[23]Kwon D H,Clark J M,Lee S H.Cloning of a sodium channel gene and identification of mutations putatively associated with fenpropathrin resistance in Tetranychus urticae.Pesticide Biochemistry and Physiology,2010,97(2):93-100.
[24]Van Leeuwen T,Tirry L.Esterase-mediated Bifenthrin Resistance in a Multiresistant Strain of the two-spotted Spider Mite,Tetrancychus urticae.Pest Management Science,2007,63(2):150-156.
[25]Achaleke J,Martin T,Ghogomu R T,Vaissayre M,Brevault T.Esterase-mediated Resistance to Pyrethoids in Field Populations of Helicoverpa armigera(Lepidoptera:Noctuidac)from Central Africa.Pest Management Science,2009,65(10):1147-1154.
[26]Zhai Q H.Some aspects of progress in insect molecular biology:Molecular mechanisms of insecticide resistance.Acta entomologica sinica.1995,38(4):493-501.
[27]Imai T.Human carboxylesterase isozymes:catalytic properties and rational drug design.Drug Metabolism and Pharmacokinetics,2006,21(3):173-185.
[28]Mi Z,Ruan C L,Li G N,Du W H,Long Y H,Zhu Y.Activity Variations of NADPH Cytochrome P450 Reductase and NADPH Cytochrome C Reductase in Midgut of Fluoride Poisoned Bombyx mori.Science of Sericulture,2012,38(1):0102-0108.
[29]Liu Y Q.Mutagenicity of fluoride.Foreign Medical Sciences:Section of Medgeography,1996,17(2):58-60.
[30]Zhang L,Gao X W,Liang P,Beta-cypermethrin resistance associated with high carboxylesterase activities in a strain of house fly,Musca domestica(Diptera:Muscidae).Pesticide Biochemistry and Physiology,2007,89(1):65-72.
[31]Holmes R S,Cox L A,Vandeberg J L.Mammalian Carboxylesterase 5:comparative Biochemistry and Genomics.Comparative Biochemistry and Physiology D-Genomics& Proteomics,2008,3(3):195-204.
参考文献:
[1]黄君霆,朱万民,夏建国,向仲怀.中国蚕丝大全.成都:四川科学技术出版社,1996:462-467.
[2]张平.氟化物遗传毒性的研究进展.畜禽业,2009,238(2):42-44.
[8]黄菁,乔传令.昆虫解毒酶解毒机理及其在农药污染治理中的应用.农业环境科学学报,2002,21(3):285-287.
[16]黄玲莉,韦博尤,蒙艺英.氟化钠溶液浸泡时间对桑叶含氟浓度变化的试验.广西蚕业,2005,42(4),5-7.
[26]翟启慧.昆虫分子生物学的一些进展:杀虫剂抗性的分子基础.昆虫学报,1995,38(4):493-501.
[28]米智,阮成龙,李冠楠,杜文华,隆耀航,朱勇.家蚕氟中毒后中肠NADPH-细胞色素P450还原酶和NADPH-细胞色素C还原酶活性的变化. 蚕业科学,2012,38(1):0102-0108
[29]刘雨清.氟化物的诱变性.国外医学(医学地理分册),1996,17(2):58-60.
