菹草种群内外水质日变化
2013-08-02王锦旗郑有飞王国祥
王锦旗,郑有飞,* ,王国祥
(1.南京信息工程大学环境科学与工程学院,南京 210044;2.南京师范大学地理科学学院,南京 210097)
湖泊富营养化是全球面临的一个重大环境问题,也是我国目前以及今后相当长一段时期内的重大水环境问题[1],当污染外源得到有效控制之后[2],对内源氮磷污染的研究显得格外重要,尤其对内源氮磷的赋存形态、迁移释放行为及其影响因素等内源氮磷污染机理方面的研究更显得尤其重要[3]。研究表明,内源污染物的转化受到水温、溶解氧(DO)、氧化还原电位、pH等水环境因子的影响,而水生植物,尤其是沉水植物,对DO、氧化还原电位、pH等水环境因子又有着重要影响[4]。因此,研究水生植物群落如何影响水环境因子,以及这些因子对内源性污染的影响具有重要的理论和实际意义。
沉水植物作为湖泊生态系统重要的初级生产者,能分泌化感物质抑制藻类繁殖[5],还可吸收水体及沉积物中的营养盐,为水体食物链提供食物和庇护栖息场所,对维护湖泊生态系统,控制湖泊富营养化具有重要生态价值[6]。菹草作为冬春季沉水植物的优势种,在水体生态修复过程中起重要作用,其存在对湖泊水质及水生生态系统均能产生重要影响[7-9]。
关于沉水植物对水体日变化的影响研究,曾有人以苦草为对象做过一定的研究[4,10],而以冬春季沉水植物菹草为对象的研究还少见,因此,研究菹草种群对水环境日变化的影响,为更全面了解水生植物对水环境的影响,及水生植物对内源氮磷转化影响的日变化提供理论参考。
1 材料与方法
1.1 监测点设置
监测点设于南京玄武湖的西北湖区,选择一岸边带菹草连续分布区,因其他湖区及湖心区管理人员定期刈割及游人干扰,菹草种群面积小且不连续。该监测水域水流稳定,游船较少,菹草生长及水体受扰动均较小。该区平均水深约92cm,菹草种群沿湖岸南北向连续均匀分布,菹草种群离岸平均宽度约100m,平均高度达130cm,种群区内菹草分布均匀,平均分枝数约650株/m2,鲜重约2450g/m2,种群与开阔水域分界明显。
监测点设置如图1所示。在菹草种群中央区域设2个监测点,在种群与开阔水域过渡区设3个监测点,无草开阔水域设3个监测点,为保证监测点准确,监测线两端用木桩固定,并用尼龙绳连接,并在各监测点用竹竿标记。据分析可知,种群内离岸最近的种群内监测点,种群与开阔水域交界线监测点,及开阔水域离岸最远的一个监测点各项指标差异均具有显著的代表性[11],分别能代表菹草种群区,种群-开阔水域交界处,开阔水域的各项水质指标变化,故选取上述三点进行分析,其他点位不作分析,3个监测点分别记为“种群”、“交界处”、“开阔水域”。各监测点离岸距离及水深情况见图1及表1。

图1 监测点布点示意Fig.1 Distribution of the monitoring areas
1.2 监测方法及频率
因调查时菹草顶端叶片主要集中在水体表层至水下40cm处,故水温和DO选取水下20cm处作监测分析,氮、磷等营养盐指标分别取水下5cm处水样带回实验室测得。水温及DO采用YSI-55型溶解氧仪于现场测定;pH采用HANNA便携式pH计测定;总氮(TN)、氨氮亚硝态氮、硝态氮和总磷(TP)由Skalar流动水质分析仪(荷兰)经预处理后测得。

表1 各监测点水深及离岸距离Table 1 Depth and offshore distance of the monitoring points
监测时间自2006年4月17日13:30至18日15:30,水温、DO、pH监测频率1次/2—3h。氮、磷取样时间分别为 17 日13:30,18 日的 01:30、07:30、11:30、15:30。
1.3 数据分析
监测两日均为晴天,光照正常。据国家授时中心网站查询得监测时段日出、日中、日落时刻。4月17日日中时刻为12:04,日没时刻为18:35,4月18日日出时刻为05:33;日中时刻为12:04。故将17日13:30—18:35及18日05:33—15:30处理为白昼时段,17日18:35—18日05:33为夜间。
试验数据用Excel软件进行统计分析及图表制作。
2 结果与分析
2.1 水温及光照
水温见表2,3个监测点水温基本维持在17.9—22.4℃之间,水温自日出后持续升高,于11:30—15:30达最高,约20—22℃,3个点水温基本于日出前后5:30—7:30达最低,约18℃,日出后回升。
监测区水面光照强度见表3,3个监测点水面平均光照均在4.2×104lx以上,3个点白天光照强度在9:30—13:30 达到最高,为4.4×104—8.4×104lx。
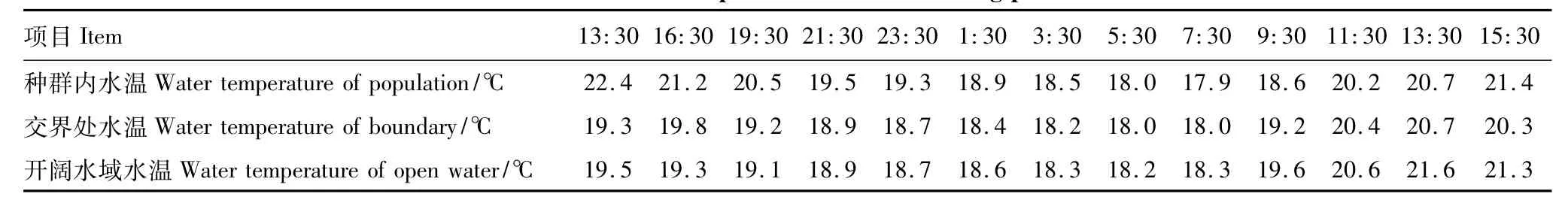
表2 各监测点水温Table 2 Water temperature of the monitoring pionts
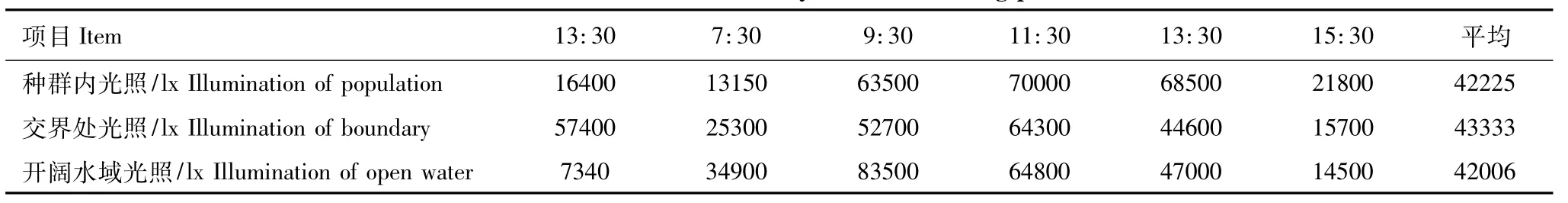
表3 各监测点光照强度Table 3 Illumination intensity of the monitoring pionts
2.2 受菹草光合作用影响的水环境因子日变化
因沉水植物菹草根、茎、叶完全淹没于水下,故其光合作用释放氧气,消耗CO2,以及呼吸作用释放的CO2的过程会对水环境因子中的DO、pH等产生显著的影响。
2.2.1 DO变化
水体DO含量日变化如图2所示。种群与开阔水域的DO含量与对应点水温呈极显著正相关关系(r=0.89,0.71;P<0.01),交界处呈显著性正相关关系(r=0.54;P<0.05)。种群水体DO含量自13:30—19:30逐渐下降,由13.99mg/L降至11.09mg/L,晚间21:30升至12.20mg/L,后持续下降,次日07:30降至全天最低,仅9.1mg/L,与水温最低点一致,日出后持续升高,至15:30达当日最高,达13.90mg/L,较07:30高出34.5%。交界处水体DO含量16:30时较13:30略有升高,16:30—21:30逐渐降低,23:30略有回升,后又持续降低,次日03:30—05:30降至最低,仅8.8—8.9mg/L,07:30以后持续回升。开阔水域DO含量日变化趋势较简单,13:30—21:30水体DO维持在10.30mg/L上下,21:30至次日05:30持续降低,05:30达最低,仅8.4mg/L,05:30—09:30水体DO逐渐恢复,次日09:30—15:30维持在10.40 mg/L上下。DO含量空间分布:种群区>交界处>开阔水域(11.16mg/L>10.06mg/L>9.83mg/L)。
2.2.2 pH日变化
菹草种群对水体pH的日变化影响如图3所示。种群pH与DO含量呈显著正相关(r=0.61;P<0.05),交界处与开阔水域两点呈极显著正相关(r=0.77,0.87;P<0.01)。种群区pH13:30—19:30持续升高,于日落后约1h的19:30达到最高,为10.6,后持续下降,于次日03:30—05:30达最低,仅9.9—10.0,日出后07:30开始升高,11:30—15:30又达最高值,约10.5—10.6。交界处pH日变化趋势与种群区变化趋势一致,前一日13:30—19:30持续升高,19:30达最高,为9.8,后持续降低,于次日03:30—05:30达最低,仅8.9—9.1。而开阔水域pH值与该点DO含量保持较高的一致性,自13:30至次日7:30持续下降,凌晨03:30—07:30达最低,仅9.0—9.1,后持续升高,于次日15:30升至最高,为9.5。在空间分布上全天pH值:种群区>交界处>开阔水域。
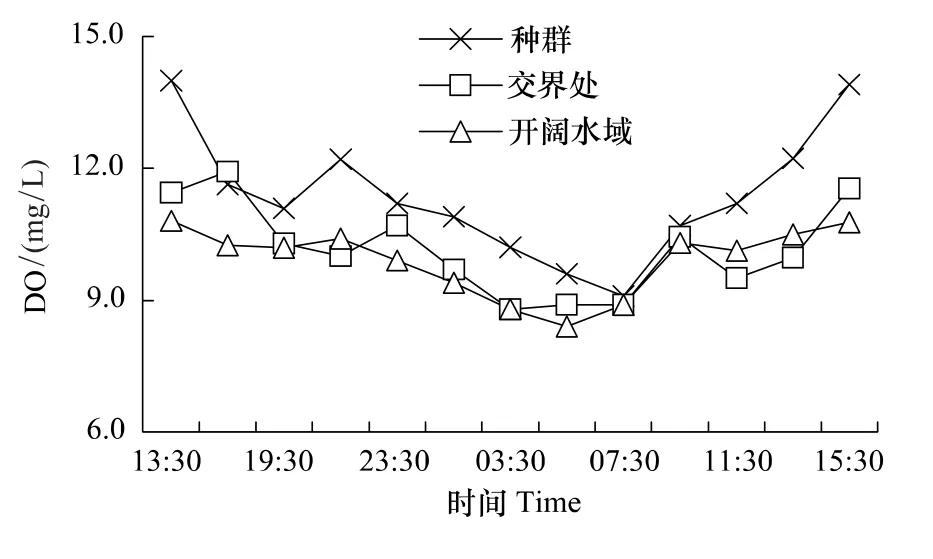
图2 监测点DO含量Fig.2 DO concentration of all monitoring points

图3 监测点pHFig.3 pH value of all monitoring points
2.3 营养盐指标日变化
2.3.1 氮的日变化
TN监测结果如图4所示。种群区TN含量13:30—07:30逐渐上升,13:30时TN最低,仅1.41mg/L,次日07:30最高,达1.84mg/L,较前一日13:30时高出30.3%,次日11:30也较低,为1.58 mg/L,15:30略回升。交界处TN含量与种群区变化趋势一致,13:30最低,仅1.44mg/L,凌晨07:30最高,达2.42mg/L,后者较前者高出67.7%。开阔水域TN含量自13:30—07:30逐渐升高,07:30—15:30逐渐降低,17日13:30时TN最低,次日凌晨07:30最高,两者相差78.5%。总体TN含量:种群<交界处<开阔水域。种群区及开阔水域水体TN含量与各点DO含量呈显著负相关关系(r=-0.81,r=-0.89;P<0.05),交界处关系不显著;三点TN含量与各点pH关系不显著。

图4 监测点氮变化Fig.4 Nitrogen variation of the monitoring points
2.3.2 磷的日变化
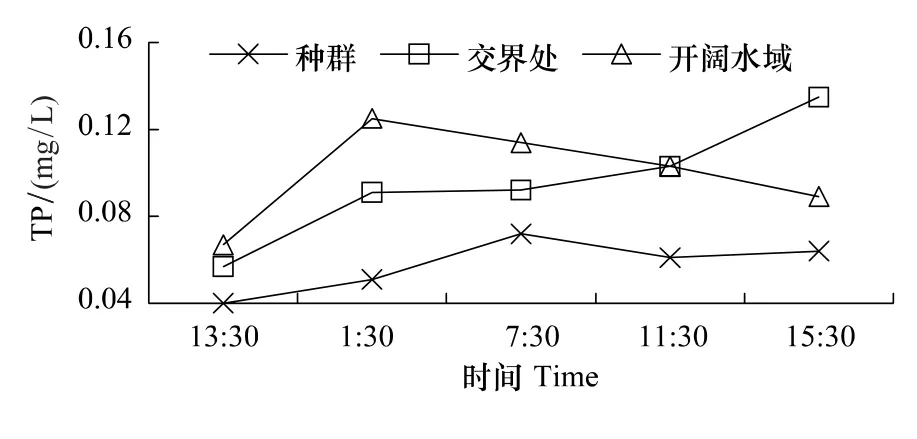
图5 监测点磷变化Fig.5 Phosphorus variation of the monitoring points
TP监测结果如图5所示。种群水体TP含量自17日13:30—18日07:30递增,18日07:30后水体TP含量略有回落,最低点为17日13:30,仅0.040mg/L,18日07:30最高,达0.072 mg/L。交界处水体TP含量自17日13:30—18日15:30持续上升,17日13:30最低,仅0.057 mg/L,18日15:30最高,为0.135 mg/L。开阔水域17日13:30也处于最低点,仅0.067 mg/L,18日01:30最高,达0.125 mg/L。3个点TP含量:开阔水域>交界处>种群。其中开阔水域TP含量与该处DO呈显著负相关(r=-0.86;P<0.05),与pH均呈负相关关系,但不显著,其余点TP含量与DO、pH关系均不显著。
3 讨论
据研究,菹草适宜的生长温度为15—25℃,20℃附近菹草光合作用产氧量最高,适宜的光照为2.6×104—5.5×104lx,在光照强度为5.43×104lx时菹草光合作用的产氧量最高。故监测时间的水温基本处于18—20℃,水面光照强度均在4.2×104lx以上,水温及光照强度均适宜菹草的生长和发育,也非常适宜菹草光合放氧[12]。
水体一方面通过大气复氧、水生植物及藻类光合放氧提高水体DO含量,同时水生植物及水体中微生物还要进行呼吸作用耗氧。菹草种群区的DO含量主要受植株光合放氧速率与呼吸耗氧速率的影响,因水域表层被菹草叶片覆盖,其大气复氧能力较开阔水域要低,故水体DO主要来自菹草白天光合放氧,其光合速率的高低主要受光照、水温、水体CO2浓度等因素的影响。因植株叶片覆盖水面,需经过一段时间的光照后,水下20cm水温逐渐才上升,植株光合速率才显著加快,故18日9:30水体DO含量才显著升高,直至15:30。而日落前后,随光照减弱,菹草光合作用也随之减弱,光合放氧量减少,故17日13:30—19:30水体DO随水温降低持续降低。而日落后19:30菹草中停止光合放氧,水体水生生物呼吸作用旺盛,且水面因菹草叶片覆盖,大气复氧速度较慢,故19:30附近出现一个明显的低谷,后通过大气复氧水体DO含量略有恢复,但量较少,之后水体中水生动植物持续不断消耗DO,直至日出后,水温显著升高,菹草光合作用开始后,DO才开始回升。开阔水域水体DO与水温呈极显著性相关,说明水体中DO主要来自于水体大气复氧和藻类的光合放氧,清晨日出后,随光照强度增加,水温上升,水体DO含量迅速增加,从5:30—9:30水体DO含量迅速增加,之后缓慢增加,直至日落时刻附近DO含量变化不大;自21:30—5:30水体中微生物持续呼吸耗氧,水体DO减少,至5:30降至最低。交界处DO含量一方面来自于种群内部氧的传输,另一方面可通过大气复氧获得,故DO平均含量处于两监测点之间,DO日变化趋势既有种群内部特点,又有开阔水域的特点,自17日16:30—21:30种群及水体中微生物因呼吸作用DO持续下降,21:30又通过大气复氧水体DO略有恢复,之后一直下降,直至3:30—7:30降至全天最低,日出后因种群光合放氧,DO开始恢复,9:30左右种群内、开阔水域与交界处DO均得到恢复,三监测点差异较小,之后种群内与开阔水域差异增大,种群内DO开始向开阔水域传输,故交界处的DO增加速度减慢,但仍较开阔水域要高。
沉水植物因其根、茎、叶完全沉没于水中,在白天光照充足时,光合放氧作用,为水体提供氧化环境,改变水体平衡[13],影响水体pH值,且强烈的光合作用消耗水中的CO2[14],导致水中 pH 值的增加。由图3可见,菹草种群区自前一日13:30—16:30光照强烈且水温较高,菹草光合作用强烈,消耗水体CO2量较大,水体中H+浓度降低,pH值较高,均高于10.3。18:35日落后,菹草光合作用逐渐停止,菹草种群以呼吸作用为主,但水体中CO2未能及时累积升高,故19:30水体pH仍保持较高的水平,此后水体中CO2浓度逐渐累积升高,水体中H+浓度逐渐升高,故pH逐渐降低,直至凌晨日出前后,达到一天中最低值。日出后,菹草光合作用逐渐恢复,水体中累积的CO2开始逐渐被消耗,水体中H+浓度开始降低,水体pH值逐渐升高,至11:30—15:30达最高值。而开阔水域水体pH受水体中藻类及微生物影响较大,有日光照射时水中藻类光合作用,消耗水体CO2,水体H+浓度降低,pH值较高,故前一日13:30—16:30,水体pH较高,但其光合作用消耗的CO2量远不及种群区菹草光合作用消耗量,故整体其pH值低于种群区,自18:35日落后,水体浮游生物开始呼吸作用释放CO2,但因其生物量不及菹草种群区,故水体中CO2累积速度较缓,未能迅速影响pH,故13:30—21:30开阔水域pH值一直维持在9.3—9.4,直至21:30后,CO2累积量逐渐增高,水体中H+浓度逐渐升高,水体pH值降低,直至日出前后,CO2累积量最高,pH值达最低,日出后因藻类光合作用CO2减少,pH开始增加,但其消耗CO2较低,pH值升高较少,故9:30—13:30 pH值始终保持在9.3,直至15:30才略有升高。交界处因受菹草种群光合作用及呼吸作用影响,水体中CO2量变化趋势与种群区一致,故水体pH与种群区变化趋势基本一致,但种群从该水体消耗的CO2量不及种群内部,故总体pH低于种群内。而开阔水域藻类光合作用及呼吸作用对水体的影响均较菹草种群的影响要小,故从种群区—交界处—开阔水域,水体pH逐渐降低。
氮在沉积物-水体界面的迁移和转化是一个复杂的过程,其吸附与释放是一个动态平衡过程[15]。而温度、DO、pH、水动力条件等环境因素都能够对氮释放过程产生影响[16],其中DO是最重要的影响因子[17]。因监测区水体较浅,表层水体各种形态氮含量与底层水体差异不大[11],故沉积物与上覆水氮迁移能够迅速从表层水体氮含量变化表现出来。由表2及表3可得,监测期间水体DO处于较高溶解氧阶段(8—14mg/L),温度介于18—22℃,pH种群内基本都高于10.0,交界处介于8.9—9.8之间,开阔水域介于9.0—9.5之间。有研究表明厌氧(<0.5 mg/L)条件下沉积物以溶出为主,高溶解氧条件下,沉积物释放减缓,以硝态氮溶出[18-19];但温度越高抑制氮释放效果越好[20]。由此可推断,因种群至开阔水域三点pH值昼夜最高与最低值差异依次相当于平均pH的6.8%、9.6%、6.5%,差异较小,故3个监测点pH对氮变化影响较小,而种群至开阔水域昼夜水温最高与最低值差异分别为平均值的17.9%、14.1%、17.5%,而三点DO含量昼夜最高与最低值差异分别为平均值的43.8%、30.0%、24.5%,故水体昼夜DO及水温变化对水体沉积物氮释放起重要作用。因各点DO含量较高,故底泥对上覆水释放量较小,故各点之间含量差异较小,且未随DO变化而变化。3个监测点含量变化趋势与DO含量变化趋势均相反,特别是N含量变化趋势尤为明显,由此说明DO越高,对上述三氮释放抑制作用越强,故上述三氮含量空间分布顺序为:种群区<交界处<开阔水域;而DO较高时刻,水温也较高,两者共同抑制氮释放,故在含量在DO变化呈负相关关系。时间分布上,白天水体DO含量增高,水温升高,对沉积物氮释放抑制能力较强;夜间因水温下降及DO含量降低,对沉积物氮释放抑制能力较白天略有降低,故水体中含量均升高。除此之外,沉水植物生长对硝态氮吸收能力较强,对氨态氮吸收能力较弱,故沉水植物的生长对及影响十分显著,对影响较弱[21]。故植株生长对水体含量无显著影响。因监测季节为菹草旺盛生长期,菹草生长过程中可从水中吸收部分氮元素,使得水体中含量下降,且对周围水域也有所影响,故离种群越远含量越高。1:30—7:30菹草光合作用停止,以呼吸作用为主,对氮的利用率下降,加之DO与水温对内源性氮释放抑制能力下降,故夜间含量较高。
水温、DO含量、pH、水动力条件、聚磷菌活动及水体中金属离子价态密切相关还会对磷的释放起重要影响[22-24]。据金相灿等人的研究,pH值是影响磷释放的重要因素,碱性条件下,促进NaOH-P的释放;酸性条件下,促进HCl-P的释放。在pH>7的碱性条件下,沉积物磷的释放量随pH值增大而显著增加[25]。另有研究认为碱性条件下则最有利于沉积物中的磷向水体释放[26]。由上述分析可知,监测期间水体DO处于8.8—14.0mg/L,pH值为9.0—10.6之间,呈好氧碱性环境,但该实验TP含量并未随pH值增加而增大,反而出现负相关关系,其原因主要是种群至开阔水域三点pH值昼夜最高与最低值差异较小,未能对磷的迁移产生显著影响,对磷的迁移产生重要影响应是水体DO含量的变化,其中种群内昼夜DO含量最高与最低值差异达4.89mg/L,交界处达3.02 mg/L,开阔水域为2.41mg/L,分别相当于平均DO含量的43.8%、30.0%、24.5%。因水体氧化环境可促进铁铝等金属离子呈三价状态与磷结合,以磷酸盐形式沉淀[26-29],还可促进聚磷菌的活动,故水体DO含量高低决定了上覆水磷的沉淀。故白天种群区菹草光合放氧,使水体处于富氧环境,促进磷的沉积,而夜间水体DO含量下降,其磷沉积速度不及白天,故水体前一日13:30水体DO较高时,水体TP含量最低,而夜间水体DO降低时,TP达最高,日出后,水体DO含量升高,水体中TP含量下降,而种群区DO含量并未与TP含量呈显著负相关性,其中菹草白天旺盛生长对磷的吸收也会产生一定影响,而菹草种群显著改变其他水环境因子,继而影响水体磷的迁移也可能是重要原因。而开阔水域无水生植物影响,TP含量受DO、pH影响显著,故两者相关性较好。交界处水体受种群光合作用影响,水体DO含量高于开阔水域,故交界处TP含量变化也与种群内表现出同样的变化趋势。3个监测点中种群区DO含量最高,磷沉淀量最高,其TP含量最低,开阔水域相反,交界处介于两者之间。
4 结论
(1)菹草种群对水体DO影响显著,日出后水体DO开始增加,白天DO含量与水温变化一致,日落后开始下降,并于19:30左右出现1次明显低谷,后略有恢复,此后一直下降至日出前后。种群区光合作用对周围水域有一定的影响,交界处DO含量呈现种群内的特点,同时具有开阔水域变化趋势。离种群较远的开阔水域DO变化也与水温呈现一定相关性,但总体变化幅度较小。种群内水体pH值自日出前后开始升高,日落后达最高值,后开始下降,直至次日日出前后,交界处与种群变化趋势一致,开阔水域pH总体变化幅度较小,白天略高,夜间略低。总体DO及pH分布:种群区>交界处>开阔水域。
(3)菹草种群能显著引起水体DO、pH和其他环境因子的变化,尤其以DO昼夜变化较大,影响作用最强,继而影响水体与底泥的氮磷交换,pH昼夜变化率较低未能影响水体氮磷交换,与无水生植物区对比,菹草种群光合放氧能促进水体DO的提升,降低水体氮磷营养盐的含量,并对周围水域产生一定的影响。
[1]Kong F X,Gao G.Hypothesis on Cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes.Acta Ecologica Sinica,2005,25(3):589-595.
[2]Zhong J C,Liu G F,Fan CX,Zhang L,Ding S M,Ren X L.Environmental effect of sediment dredging in lake(Ⅰ):the role of sediment dredging in reducing internal phosphorous release.Journal of Lake Sciences,2009,21(1):84-93.
[3]Li H,Pan X J,Shi L Q,Mi J,Song D,Zhao L,Liu X H,He B.Research progress on the analytical methods and characteristic of endogeneous nitrogen and phosphorus pollution in lakes.Environmental Chemistry,.2011,30(1):281-292.
[4]Wang C H,Li K Y,Wen M Z,Liu Z W.Effects of Vallisneria asiatica on water environmental factors and its diurnal variation.Journal of Agro-Environment Science,2007,26(2):798-800.
[5]Wu C,Cang X X,Dong H J,Li D F,Liu J Y.Allelopathic inhibitory effect of Myriophyllum aquaticum(Vell.)Verdc.on Microcystis aeruginosa and its physiological mechanism.Acta Ecologica Sinica,2008,28(6):2595-2603.
[6]Fu C Z,Xiao Y,Gao S X.Effect of submerged plants on nutrient removal in model aquatic eco-system.Environmental Pollution & Control,2006,28(10):753-756.
[7]Yang W B.Wang G X.Environmental effects of Potamogeton crispus population in Lake Xuanwu,Nanjing.Journal of Lake Sciences,2007,19(5):572-576.
[8]Zhang M,Cao T,Nia L,Xie P,Li Z Q.Carbon,nitrogen and antioxidant enzyme responses of Potamogeton crispus to both low light and high nutrient stresses.Environmental and Experimental Botany,2010,68(1):44-50.
[9]Guo C C,Yu G H,Wang G X.Removal of Potamogeton crispus to suspended sediment and N,P of water.Journal of Soil and Water Conservation,2007,21(3):108-110.
[10]Wang Y P,Wang X D,Qin B Q,Zhu G W.Efects of diel variation of Vallisneria asiatica photosynthesis on water quality.Research of Environmental Sciences,2009,22(10):1141-1144.
[11]Wang J Q,Zheng Y F,Wang G X.Influences of Potamogeton crispus population on the lake water quality distribution.Environmental Science,2011,32(2):416-422.
[12]Su S Q,Shen A L,Tang H Y,Yao W Z.Effects of temperature,light intensity and pH on photosynthesis in Potamogeton crispus L..Journal of Southwest Agricultural University,2001,23(6):532-534.
[13]Nurdogan Y,Oswald W J.Enhanced nutrient removal in high-rate ponds.Water Science and Technology,1995,31(12):33-43.
[14]Zhao L F,Zhu W,Mo M X.Effects of submerged macrophytes on pH values and nitrogen removal.Water Resources Protection,2008,24(6):64-67.
[15]Shen L.Impact of dredging on nitrogen release from sediment in seriously polluted river.Water Resources Protection,2011,27(2):6-8.
[16]Gong C S.Study on small urban shallow lake inner pollution source and environmental dredging depth[D].Nanjing:Hohai University,2007.
[17]Wu Q H,Zeng X Y,Huang Y.Influence of DO and organic matter on nitrogenreleasing in the sediment of river.Research of Environmental Science,2005,18(5):34-39.
[18]Xing Y N,Ruan X H,Zhao Z H.Effect of environmental changes on nitrogen release from sediments in polluted urban river.Advances in Water Science,2010,21(1):120-126.
[19]Li W H,Chen Y X,Sun J P.Influence of different dissolved oxygen(DO)amounts on released pollutants from sediment to overlying water.Journal of Agro-Environment Science,2003 22(2):170-173.
[20]Lin J W,Zhu Z L,Zhao J F.Effect of aeration on release of nitrogen and phosphorus from sediments in eutrophic waterbody.Ecology and Environment,2005,14(6):812-815.
[21]Tong C H,Yang X E,Pu P M.Purification of eutrophicated water by aquatic plant.Chinese Journal of Applied Ecology,2004,15(8):1447-1450.
[22]Schulz M,Kozerski HP,Pluntke T,Rinke K.The influence of macrophytes on sedimentation and nutrient retention in the lower River Spree(Germany).Water Research,2003,37(3):569-578.
[23]Zhang L,Fan C X,Wang J J,Zheng C H.Space-time dependent variances of ammonia and phosphorus flux on sediment-water interface in Taihu Lake.Environmental Science,2006,27(8):1537-1543.
[24]Jin X C,Wang S R,Pang Y,Zhao H C,Zhou X N.The study of the effect of pH on phosphate sorption by different trophic lake sediments.Journal of Colloid and Interface Science,2005,285(2):448-457.
[25]Jin X C,Wang S R,Pang Y.The influence of phosphorus forms and pH on release of phosphorus from sediments in Taihu Lake.China Environmental Science,2004,24(6):707-711.
[26]Guo Z Y,Li X C,Wang C,Ma H Y T.Influence of pH Value on the release and the chemical fractions of phosphorus in sediments of Xuanwu Lake.Journal of Agro-Environment Science,2007,26(3):873-877.
[27]Jiang Z J,Fang J G,Zhang J H,Mao Y Z,Wang W.Forms and bioavailability of phosphorus in surface sediments from Sungo Bay.Environmental Science,2007,28(12):2783-2788.
[28]Wang C,Zou L M,Wang P F,Lin Z P.Distribution and correlation of P and Fe fractions in sediments of typical urban shallow lakes.Environmental Science,2008,29(12):3400-3405.
[29]Harveya O R,Rhueb R D.Kinetics and energetics of phosphate sorption in a multi-component Al(III)-Fe(III)hydr(oxide)sorbent system.Journal of Colloid and Interface Science,2008,322,(2):384-393.
[30]Li W H,Chen Y X,Sun J P.Influence of different dissolved oxygen amounts on released pollutants from sediment to overlying water.Journal of Agro-environmental Science,2003,22(2):170-173.
参考文献:
[1]孔繁翔,高光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考.生态学报,2005,25(3):589-595.
[2]钟继承,刘国锋,范成新,张路,丁士明,任小龙.湖泊底泥疏浚环境效应:Ⅰ.内源磷释放控制作用.湖泊科学,2009,21(1):84-93.
[3]李辉,潘学军,史丽琼,米娟,宋迪,赵磊,刘晓海,贺彬.湖泊内源氮磷污染分析方法及特征研究进展.环境化学,2011,30(1):281-292.
[4]王传海,李宽意,文明章,刘正文.苦草对水中环境因子影响的日变化特征.农业环境科学学报,2007,26(2):798-800.
[5]吴程,常学秀,董红娟,李地福,刘军燕.粉绿狐尾藻(Myriophyllum aquaticum)对铜绿微囊藻(Microcystis aeruginosa)的化感抑制效应及其生理机制.生态学报,2008,28(6):2595-2603.
[6]伏彩中,肖瑜,高士祥.模拟水生生态系统中沉水植物对水体营养物质消减的影响.环境污染与防治,2006,28(10):753-756.
[7]杨文斌,王国祥.南京玄武湖菹草种群的环境效应.湖泊科学,2007,19(5):572-576.
[9]郭长城,喻国华,王国祥.菹草对水体悬浮泥沙及氮、磷污染物的净化.水土保持学报,2007,21(3):108-110.
[10]王永平,王小冬,秦伯强,朱广伟.苦草光合作用日变化对水质的影响.环境科学研究,2009,22(10):1141-1144.
[11]王锦旗,郑有飞,王国祥.菹草种群对湖泊水质空间分布的影响.环境科学.2011,32(2):416-422.
[12]苏胜齐,沈盎绿,唐洪玉,姚维志.温度光照和pH对菹草光合作用的影响.西南农业大学学报,2001,23(6):532-534.
[14]赵联芳,朱伟,莫妙兴.沉水植物对水体pH值的影响及其脱氮作用.水资源保护,2008,24(6):64-67.
[15]沈乐.重污染河道疏浚程度对底泥中总氮释放的影响.水资源保护,2011,27(2):6-8.
[16]龚春生.城市小型浅水湖泊内源污染及环保清淤深度研究[D].南京:河海大学,2007.
[17]吴群河,曾学云,黄钥.河流底泥中DO和有机质对三氮释放的影响.环境科学研究,2005,18(5):34-39.
[18]邢雅囡,阮晓红,赵振华.城市重污染河道环境因子对底质氮释放影响.水科学进展,2010,21(1):120-126.
[19]李文红,陈英旭,孙建平.不同溶解氧水平对控制底泥向上覆水体释放污染物的影响研究.农业环境科学学报,2003 22(2):170-173.
[20]林建伟,朱志良,赵建夫.曝气复氧对富营养化水体底泥氮磷释放的影响.生态环境,2005,14(6):812-815.
[21]童昌华,杨肖娥,濮培民.富营养化水体的水生植物净化试验研究应用.应用生态学报,2004,15(8):1447-1450.
[23]张路,范成新,王建军,郑超海.太湖水土界面氮磷交换通量的时空差异.环境科学,2006,27(8):1537-1543.
[25]金相灿,王圣瑞,庞燕.太湖沉积物磷形态及 pH值对磷释放的影响.中国环境科学,2004,24(6):707-711.
[26]郭志勇,李晓晨,王超,马海涛.pH值对玄武湖沉积物中磷的释放及形态分布的影响.农业环境科学学报,2007,26(3):873-877.
[27]蒋增杰,方建光,张继红,毛玉泽,王巍.桑沟湾沉积物中磷的赋存形态及生物有效性.环境科学,2007,28(12):2783-2788.
[28]王超,邹丽敏,王沛芳,林志评.典型城市浅水湖泊沉积物中磷与铁的形态分布及相关关系.环境科学,2008,29(12):3400-3405.
[30]李文红,陈英旭,孙建平.不同溶解氧水平对控制底泥向上覆水体释放污染物的影响研究.农业环境科学学报,2003,22(2):170-173.
