基于光谱特征变量的湿地典型植物生态类型识别方法
——以北京野鸭湖湿地为例
2013-08-02宫兆宁赵文吉
林 川,宫兆宁,赵文吉,樊 磊
(首都师范大学资源环境与旅游学院;三维信息获取与应用教育部重点实验室;资源环境与地理信息系统北京市重点实验室;北京市城市环境过程与数字模拟国家重点实验室培育基地,北京 100048)
湿地植被作为湿地生态系统的一个重要组成部分,可以综合反映湿地的生境特征,是湿地研究的关键,因此快速、准确进行湿地植被的鉴识,对于湿地资源监测和保护具有重要的意义[1]。
由于大范围的湿地植被具有面源特性,常规的监测技术范围有限,并且费时费力,因此采用遥感手段,利用地物反射光谱信息,可以实时、快速、大面积的获取湿地生态系统的信息,实现从点源监测到面源监测的飞跃,目前已广泛用于湿地资源的调查和研究中。许多学者已经采用各种多光谱影像(如TM、SPOT、IKONOS等),来获取湿地植被分类的数据并进行湿地的监测与保护[2-5]。但是,由于多光谱传感器的波段少、光谱分辨率较低(一般大于100nm),再加上湿地植被组成的复杂性以及植被光谱特征的相似性,在空间遥感探测中容易出现“异物同谱”的现象,影响了分类的精度和效率,无法满足更高精度湿地植被物种和群落识别的需要。而高光谱遥感技术经过近二十年来的飞速发展,以其所具有的光谱分辨率高、波段数目多、数据丰富等独特性能,弥补了传统多光谱遥感技术的不足,使其在地表物质的识别和分类、有用信息提取方面具有独特的优势,在农业、水文和地质等领域得到了广泛应用[6-8]。近年来该技术在湿地科学中的应用也逐渐增多,尤其是精细湿地植被识别和分类方面,能够提高湿地植被识别与分类的精度,国内外的许多研究都取得了较好的效果[9-11]。同时,国内外一些学者也应用地面实测光谱,通过分析和提取实测光谱间的差异,进行湿地植物群落的识别研究。Schmidt等[12]使用GER 3700野外便携式地物光谱仪测量了荷兰南部海岸盐沼湿地的27种湿地植被的反射光谱,利用统计检验、连续统去除法以及距离分析法,最终筛选出了6个用于分类的最优波段。Zhang[13]等应用改进的光谱混合分析方法对盐沼湿地植被的地面实测光谱进行处理,结果表明,利用该方法可以放大种间的光谱差异,降低种内的光谱差异,对优势种的识别精度能够达到90%以上。Elhadi等[14]使用ASD FieldSpec3野外高光谱辐射计测定了南非圣路西亚湿地公园沼泽湿地中包括纸草在内的4种湿地植被的冠层光谱,并综合运用方差分析与分类回归的分析方法,选定了8个用于识别纸草的最优波段。Zomer等[15]使用GER 2600野外便携式光谱辐射计测定了美国加利福尼亚州帕切科溪盐沼湿地7种湿地植被类型的冠层和叶片光谱,然后利用得到的地物光谱曲线建立波谱库,为基于高光谱遥感影像的湿地植被分类提供一定的科学依据与技术支持。
然而,由于高光谱与传统的遥感技术差别明显,特别是高光谱数据的波段多、信息量大、信息冗余多等特点,使得在高光谱数据的处理与应用中还有许多问题需要解决,其中,如何选择用于特定分析的光谱特征变量(最佳波段、植被指数以及光谱吸收特征参数)已经成为国内外学者研究的重点问题之一[16]。光谱特征变量的选择对于湿地植被识别的精度和效率有着直接的影响作用,因此,快速、简单以及准确的选择湿地植被识别的光谱特征变量,对于湿地植被的识别与分类具有重要的意义。同时,目前应用高光谱遥感技术进行湿地植被识别的研究大多集中于盐沼湿地植被上,针对淡水湿地植被的研究尚不多见。
本文以典型淡水湿地——野鸭湖湿地为研究区,在采集典型湿地植物群落反射光谱的基础上,利用光谱微分技术中的一阶导数分析方法与光谱吸收谷/反射峰特征分析中的包络线去除法[17],在可见光-近红外波段范围内选出识别湿地植物生态类型的光谱特征变量,并采用单因素方差分析(One-way ANOVA)验证得到的最优光谱特征变量是否能够区分各植物生态类型,最后应用反向传播人工神经网络(BP-ANN)模型[18]和Fisher线性判别分析(FLDA)方法[19]进行湿地植物生态类型识别,以期为野鸭湖湿地植被的高光谱遥感数据的处理以及野鸭湖湿地资源的监测和保护提供科学依据,为遥感技术在淡水湿地植被识别中的实际应用提供理论依据和技术支持。
1 研究区概况
野鸭湖湿地保护区位于北京市延庆县西北部的延庆镇、康庄镇、和延庆农场交界处,地理位置为东经115°46'16″—115°59'48″,北纬 40°22'04″—40°30'31″,是官厅水库延庆辖区及环湖海拔 479 m 以下淹没区及滩涂组成的人工湿地(图1)。目前,保护区总面积9000 hm2,是北京最大的湿地自然保护区,同时也是北京首个湿地鸟类自然保护区。野鸭湖湿地地处北山隆起构造区的延庆-昌平活动断裂区,地势东北高,西南低,属于堆积构造地貌类型,主要由妫水河洪冲击形成,地势平坦,土壤类型以褐土为主。属北温带大陆性季风气候,处于暖温带与中温带、半干旱到半湿润之间的过度地带,具有四季分明的特点,春季干旱,夏季雨热同季,降雨多集中于7、8、9三个月,年平均降水500 mm左右;秋季天高气爽,冬季寒冷干燥[20]。

图1 研究区地理位置图Fig.1 Location map of study area
在野鸭湖特殊的地质地貌、水文、土壤和气候等因子的作用下,植物群落经过长期的演替变化,该区域生长了大面积的湿地植被,分布广、种类多、生物多样性丰富,在北京乃至华北区湿地中具有典型性和代表性。野鸭湖区域内的湿地植被在空间上具有典型的成带分布特点,自岸边至湖中心处,随着水深的不断增加,形成了不同的植物群落。湖中心处水深较深,沉水植物广泛分布,比较典型的有狐尾藻、篦齿眼子菜、菹草等;趋向湖岸的水较浅,生长着浮水植物,比较典型的有莲、浮萍、槐叶萍等;在靠近湖岸的浅水处,为挺水植物带,比较典型的有芦苇、香蒲等。在野鸭湖湿地长期浸水区域或季节性水淹区域,分布有大量的湿生植物,以球穗莎草和扁杆藨草群落为主,伴生种主要为水芹菜、针蔺、水葱、薄荷等,植物多样性丰富[20-21]。在季节性水体的上方,很少被水淹浸,但土壤湿度仍然很大,是湿生和旱生植物均能生长的地带,分布有牛鞭草等中生植物群落。
2 数据资料与研究方法
2.1 数据获取与预处理
由于研究区内环境较为复杂,有的区域因为地形地貌等因素的限制难以进入,同时研究区内湿地植被类型丰富,因而采样过程中无法达到全部区域以及覆盖所有植被类型,所以在进行野外光谱数据采集之前,首先进行采样区域以及植被类型的选择和确定[22]。本次研究的采样区域如图2所示,图中3个区域内滩涂面积较大、沟岔众多、水深较浅,湿地植被类型众多,具有一定的典型性和代表性,因此选定为光谱数据的采样区。区域4被人工建造的围堤所包围,围堤内湿地植被生长状况良好,面积较大,也具有一定的典型性与代表性。区域5为湿地生态恢复与苜蓿人工种植的混合区域,区域内苜蓿大面积种植,与自然生长的植被相比,该区域内的植被受人类活动影响较大,同时也是野鸭湖区域内湿地植被的重要组成部分,所以将该区域中的苜蓿(栽培种)选定为采样的植被类型之一。而且上述区域水深较浅,地势平坦,方便到达,便于开展光谱数据的采集工作。选定采样区域后,结合研究目的和采样区域内湿地植被的类型、数量、长势以及分布特点,选择样区内的典型湿地植被进行采样,选定的典型湿地植被如表1所示。表1中所选取的12种湿地植被生长旺盛,密度较大,覆盖度较高,在5个采样区域内分布广泛,所占面积达到了采样区域面积的75%—85%。
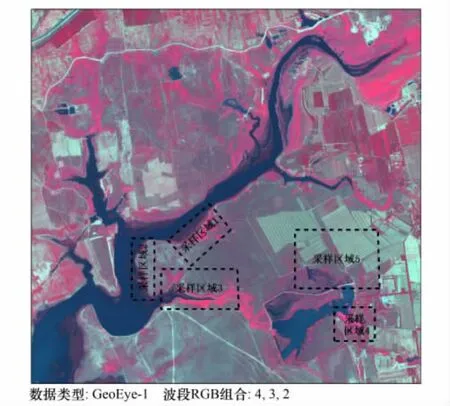
图2 野外采样区域图Fig.2 Field sampling area
采样时间选择2011年6月上旬到7月下旬,该段时间内,降水充足,温度、光照都比较适合湿地植被的生长,而且大多数湿地植被都处于花期或者果期,生长比较旺盛,健康状况良好,是采集光谱信息的最佳时期。随后,在GPS的辅助下,进行典型湿地植被冠层光谱的采集,针对每种典型湿地植被的数量与分布特点设置适合的样方个数。典型湿地植被冠层光谱测量使用美国ASD公司生产的Field Spec 3背挂式野外高光谱辐射仪,光谱范围为350—2500 nm,其中350—1000 nm光谱采样间隔(波段宽)为1.4 nm,光谱分辨率为3 nm,1000—2500 nm光谱采样间隔(波段宽)为2 nm,光谱分辨率为10 nm,数据采样间隔为1 nm,光纤前视场角为25°。所有光谱测定均在晴朗、无云、无风或微风的天气,测定时间为每日10:00—14:00,此时光照条件良好,阳光几乎直射(太阳高度角大于45°),并根据天气条件及时进行标准白板优化校正,每15 min进行1次优化,标准白板的反射率为1。测定植被冠层光谱时,应保证测定区域内植被类型单一,植被覆盖度较高,测定时将光谱仪探头垂直向下,根据植被冠层的直径和高度确定探头距离冠层的高度,保证视场可以覆盖冠层。每个样点记录10条采样光谱曲线。

表1 样区典型湿地植被类型Table 1 Typical wetland vegetation types of sample area
野外实测地物光谱数据由于受到自然环境、仪器和目标本身光谱特性等多种因素的影响,获取的光谱数据中包含地物光谱数据和噪声两部分信息,通过光谱数据的预处理可以消除噪声并且突出地物光谱中的某些细微差别。光谱数据的预处理主要包括光谱平滑去噪、水汽吸收波段的剔除以及光谱曲线均值处理3部分。
(1)光谱平滑去噪 由于光谱仪波段间对能量响应上的差异,导致光谱曲线总是存在一些噪声,为了得到平稳与概略的变化,需要平滑波形,以去除包含在信号内的少量噪声。本文选用前后9个波段的平均值作为滤波后的光谱值,其函数表达式为:

(2)水汽吸收波段的剔除 由于大气中水汽的强烈吸收,地面光谱在水汽吸收波段基本上都为噪声。在湿地区域内,地表湿度大,空气中水汽含量较高,为了保证光谱数据的精度,需要剔除水汽吸收峰影响严重的波段区域,去除明显错误的波段数值。本文中,由于1350—1450 nm、1800—2000 nm以及2350—2500 nm波段范围内产生的干扰噪音较大,对其进行了剔除处理。
(3)光谱曲线均值处理 由于每个样点采集10条光谱曲线,所以对10条曲线进行均值运算,将均值处理后得到的光谱曲线作为每个样点的最终光谱曲线,图3为本次研究中选取的湿地植物生态类型经过预处理后的光谱曲线。
经过光谱数据预处理,最终得到7种植物生态类型的270条待分析光谱曲线,然后将其分为训练样本和检验样本两组。按照分层随机抽样的方法,在每一种植物生态类型里随机选择2/3的样本作为训练样本,余下1/3作为检验样本,即训练样本数为180条,检验样本数为90条。
2.2 数据分析
2.2.1 光谱数据一阶导数计算
光谱微分技术是高光谱遥感数据最主要的分析技术之一,对光谱曲线进行微分或采用数学函数估算整个光谱上的斜率,由此得到光谱曲线斜率称为微分光谱,又称为导数光谱,可分为一阶导数光谱和高阶导数光谱[23]。利用光谱微分技术可以消除大气和背景噪声的影响,突出光谱特征和规律。一阶导数的计算方法如
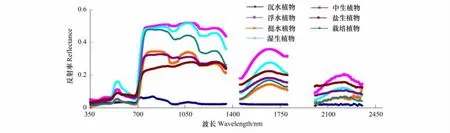
图3 野鸭湖7种植物生态类型反射光谱曲线Fig.3 Reflectance spectral curves of seven plant ecological types in Wild Duck Lake
公式(2)[24]所示:

式中,λi为每个波段的波长,ρ'(λi)为波长λi的一阶导数。
2.2.2 包络线去除法
包络线去除法通过将反射光谱吸收强烈部分的波段特征进行转换,在一个共同基线的基础上比较反射光谱的吸收特征,从而进行光谱吸收特征分析和光谱特征波段选择[25]。包络线是指一条连接光谱上选取波段间上吸收起点和吸收终点的线,如图4所示。根据包络线去除后的曲线,进一步得到吸收位置(WP)、吸收宽度(WID)、吸收面积(AREA)、吸收深度(DEP)等光谱吸收特征。吸收位置(WP)、吸收宽度(WID)、吸收面积(AREA)、吸收深度(DEP)的计算方法如公式(3)、(4)、(5)、(6)[26]所示:

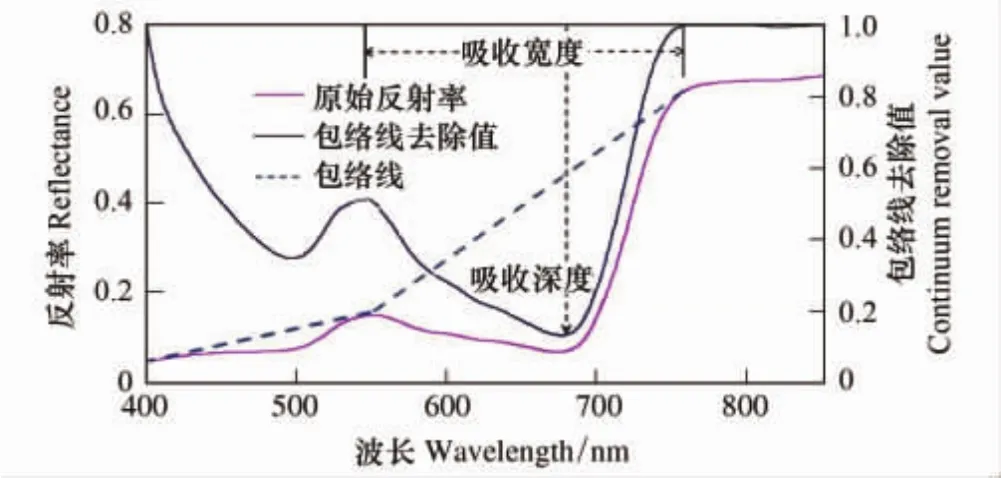
图4 包络线去除法示意图Fig.4 Continuum removal reflectance spectral curve
式中,CRmin为吸收谷内包络线去除后的最小值,λ(CRmin)为吸收谷内包络线去除后最小值对应的波长,λb、λa为包络线去除后的曲线中吸收深度一半位置的波长,b>a。
2.2.3 单因素方差分析(One-way ANOVA)
单因素方差分析研究的是一个分类型自变量对一个数值型因变量的影响,利用单因素方差分析可以对选定光谱特征变量的区分度进行验证,从而说明所选光谱特征变量是否能够较好的区分不同植物生态类型[27]。单因素方差分析首先检验总体的均数是否相等,进而判断该分类型自变量对数值型因变量的显著影响。单因素方差分析采用的统计推断方法是计算F统计量,进行F检验。总的变异平方和表示为SST,由两部分组成,一部分是由控制变量引起的离差,表示为SSA(组间离差平方和),反映了控制变量的影响;另一部分是由随机变量引起的离差,表示为SSE(组内离差平方和),反映了数据抽样误差的大小程度。于是有SST=SSA+SSE。F的比统计量是平均组间平方和与平均组内平方和的比,SSA、SSE和F的计算方法如公式(7)、(8)、(9)[27]所示:
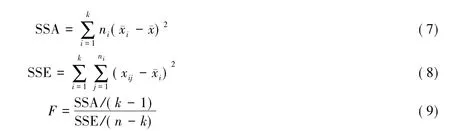
式中,k为水平数,ni为第i个水平下的样本容量。本文利用SPSS 17.0统计分析软件实现单因素方差分析。
2.3 基于光谱特征变量的湿地典型植物生态类型识别
2.3.1 BP-ANN模型
随着人工智能理论及应用的逐渐发展与完善,神经元网络模型和算法作为一种基于模式识别的数据挖掘技术,被引入了高光谱分类研究领域。人工神经网络(ANN,简称神经网络)作为一种由大量简单神经元广泛相互联接而成的非线性映射或自适应动力系统,能实现各种非线性映射和求解各种分界面十分复杂和高度非线性的分类和模式识别问题。其中,在高光谱数据挖掘的众多人工神经网络模型和算法中,反向传播人工神经网络(BP-ANN)模型的应用最广泛。BP-ANN模型是一种多层前馈神经网络模型,该网络的主要特点是信号前向传递,误差反向传播。构成BP-ANN模型的神经元与常规人工神经网络中定义的神经元一样。按照BP-ANN的算法要求,这些神经元所用的激活函数必须是处处可导的,一般使用非线性的s形压缩函数(Sigmoid函数)[28],其表达式为:Y=1/(1+e-s)。本文中应用3层BP-ANN模型,包括输入层、隐蔽层和输出层,如图5所示。本文利用MATLAB R2008实现BP-ANN模型。
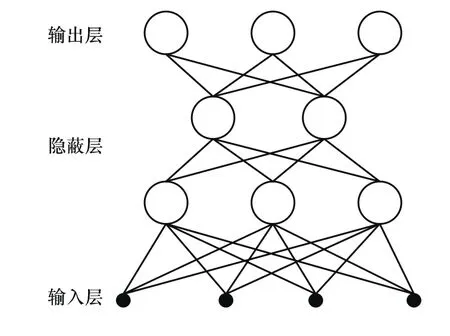
图5 3层BP-ANN网络模型Fig.5 Three BP-ANN network model
BP-ANN模型的训练过程如下:首先根据当前的内部表达,对样本输入模式作前向传播,然后将实际输出和期望输出加以对比,如果误差值小于规定值,则训练结束,否则将误差反向传播,逐步修正加权值和阈值,直至误差达到要求为止[28]。对具有m个输入结点和n个输出结点的BP网络来说,输入到输出的关系可视为m维到n维欧氏空间的映射。只要有足够的隐结点,任何输入到输出的映射均可实施。
2.3.2 Fisher线性判别分析
Fisher线性判别分析(FLDA)是线性判别分析的一种,是由Fisher提出的一种非常经典的分类技术,判别分析的目的是得到体现分类的函数关系式,即判别函数。基本思想是在已知观测对象的分类和特征变量值的前提下,从中筛选出提供较多信息的变量,并建立判别函数;目标是使得到的判别函数在对观测量进行判别其所属类别时的错判率最小。判别函数的一般形式如公式(10)所示:

式中,Y为判别分数判别值;x1,x2,…,xn为反映研究对象特征的变量;a1,a2,…,an为各变量的系数,即判别系数。本文利用SPSS 17.0统计分析软件实现FLDA。
3 结果与分析
3.1 湿地典型植物生态类型光谱特征变量的分析与选择
3.1.1 湿地典型植物生态类型的反射光谱一阶导数计算结果分析
针对训练样本,通过光谱微分技术中的一阶导数分析方法,选出识别湿地植物生态类型的光谱特征变量。由于植被的反射光谱特征主要集中在1000 nm之前[24],所以本文选取350—1000 nm之间的一阶导数进行分析。图6为野鸭湖7种湿地植物生态类型的光谱一阶导数曲线。
光谱一阶微分技术能够消除大气和背景噪声的影响,突出光谱曲线的斜率变化,从而确定光谱曲线的变化区域,如绿峰、红谷、红边等。一阶导数为正极值的波段,代表光谱反射率增速最大的波段,从图6可以看出7种植物生态类型基本都在520nm和710 nm附近达到反射率增速最快的极点。520 nm附近反射率快速上升是因为叶绿素的反射作用增强,湿生植物在520 nm附近的表现较为突出,而沉水植物的反射作用最弱。710 nm附近反射率急剧上升是由“红边”效应导致,沉水植物的反射作用仍然最弱。一阶导数等于0的点对应光谱反射率出现极值的波段,如:550、680、880 nm等波段附近。总体上,沉水植物一阶导数的波动范围最小,挺水植物、湿生植物以及栽培植物的变化幅度较大。
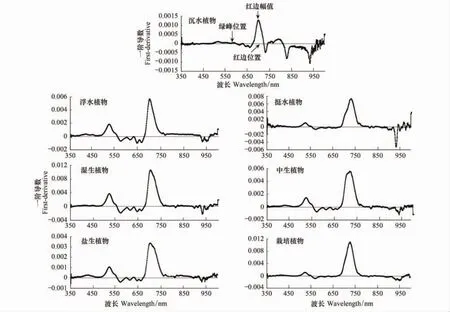
图6 野鸭湖7种湿地植物生态类型光谱一阶导数曲线Fig.6 Spectral first-derivative curves of seven plant ecological types in Wild Duck Lake
“红边”是绿色植物光谱最明显的特征之一,它的定义为红光范围内(680—760 nm)反射光谱一阶导数的最大值所对应的光谱位置(波长),描述“红边”的参数一般有红边位置(红光范围内一阶导数光谱最大值所对应的波长)WP_r,红边幅值(红光范围内一阶导数光谱的最大值)Dr等。本文选取7种植物生态类型的“红边”参数,如表2和图7所示。7种植物生态类型在WP_r与Dr上存在不同水平的差异,WP_r都不相同,沉水植物的Dr平均值最小,仅为0.0012,栽培植物的Dr平均值最大,为0.012。“绿峰”是绿色植被在绿光范围(510—560 nm)内反射峰所处的光谱位置,它是由植物中的色素对蓝光和黄光的强吸收而在绿光区形成的相对反射高峰。描述“绿峰”的参数有绿峰幅值(Rg)定义为绿光范围内最大的光谱反射率和绿峰位置(WP_g)定义为Rg对应的波长。本文选取7种植物生态类型的“绿峰”参数,如表2和图7(b)所示。7种植物生态类型在WP_g与Rg上仍然存在不同水平的差异,沉水植物的Rg平均值依旧最小,仅为0.032,湿生植物的Rg平均值最大,为0.164。沉水植物与其他6种植物生态类型在Dr和Rg上存在明显的差异,出现明显差异的原因,一是因为水面以下的生活环境迫使沉水植物的叶片演化成不同于其他环境的模式,二是因为生长在水面以下,入射能量大部分被水体吸收。湿生植物的Rg值最高,栽培植物的Dr值最高,原因是这两种植物生态型类型正处于生长旺盛期,细胞间的活力较为旺盛。

表2 野鸭湖7种植物生态类型红边与绿峰参数统计表Table 2 Red edge and green peak parameters of seven plant ecological types in Wild Duck Lake
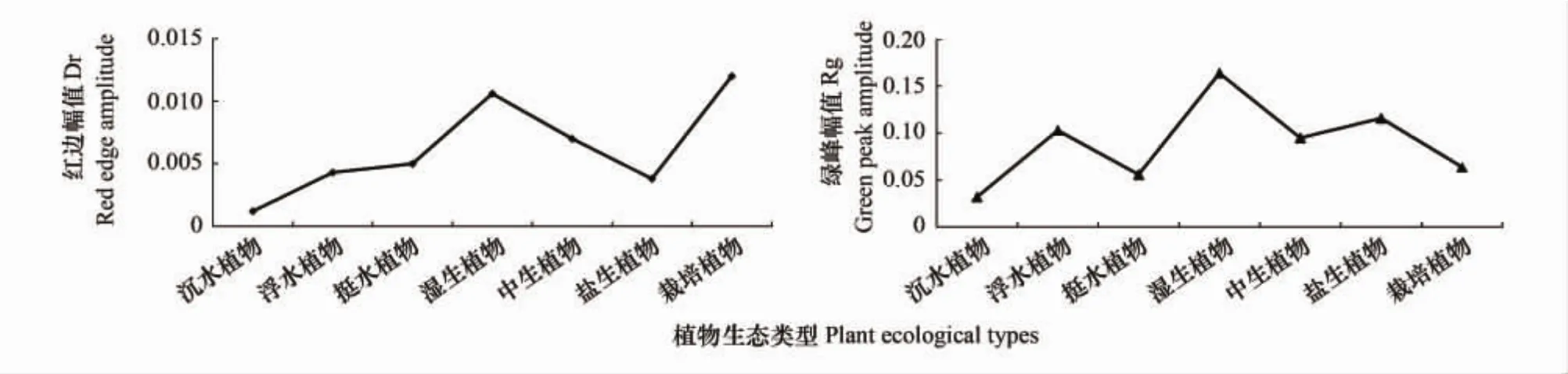
图7 野鸭湖7种植物生态类型红边与绿峰参数Fig.7 Red edge and green peak parameters of seven plant ecological types in Wild Duck Lake
3.1.2 不同植物生态类型的包络线去除光谱特征分析
植被在可见光波段范围内存在着强烈的吸收,在植被光谱中该区域包含了重要的信息。针对训练样本,本文选取400—820 nm范围内的光谱曲线进行包络线去除处理,处理后的光谱吸收特征曲线如图8所示。在该波段范围内,不同植物生态类型的吸收曲线存在着较大的差异。挺水植物、湿生植物的吸收较为强烈,沉水植物的吸收程度最弱。7种植物生态类型在510nm和675 nm附近,存在两个不同深度的吸收谷。
对完成包络线去除处理后光谱吸收特征曲线进一步计算得到510 nm和675 nm附近的吸收特征参数(吸收深度DEP和吸收面积AREA),如表3和图9所示。7种植物生态类型在675 nm附近的吸收深度和吸收面积均高于510 nm附近数值,说明植被在红光范围内比蓝光范围有着更为强烈的吸收效应。由于栽培植物受人为因素影响较大,所以除栽培植物,随着水分梯度的变化,其他6种植物生态类型的吸收深度和吸收面积表现出先升高后降低的趋势。7种植物生态类型在DEP-510、AREA-510、DEP-675以及AREA-675上存在较为明显的差异,因而可以将其作为识别湿地植物生态类型的光谱特征变量。
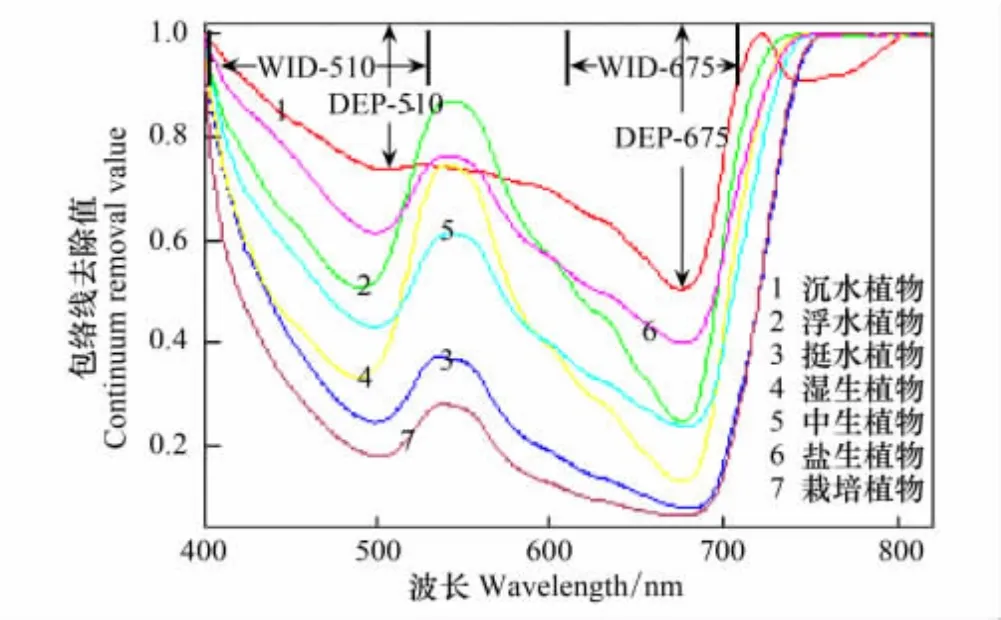
图8 野鸭湖7种植被生态类型光谱吸收特征曲线Fig.8 Spectral absorption feature curves of seven plant ecological types in Wild Duck Lake
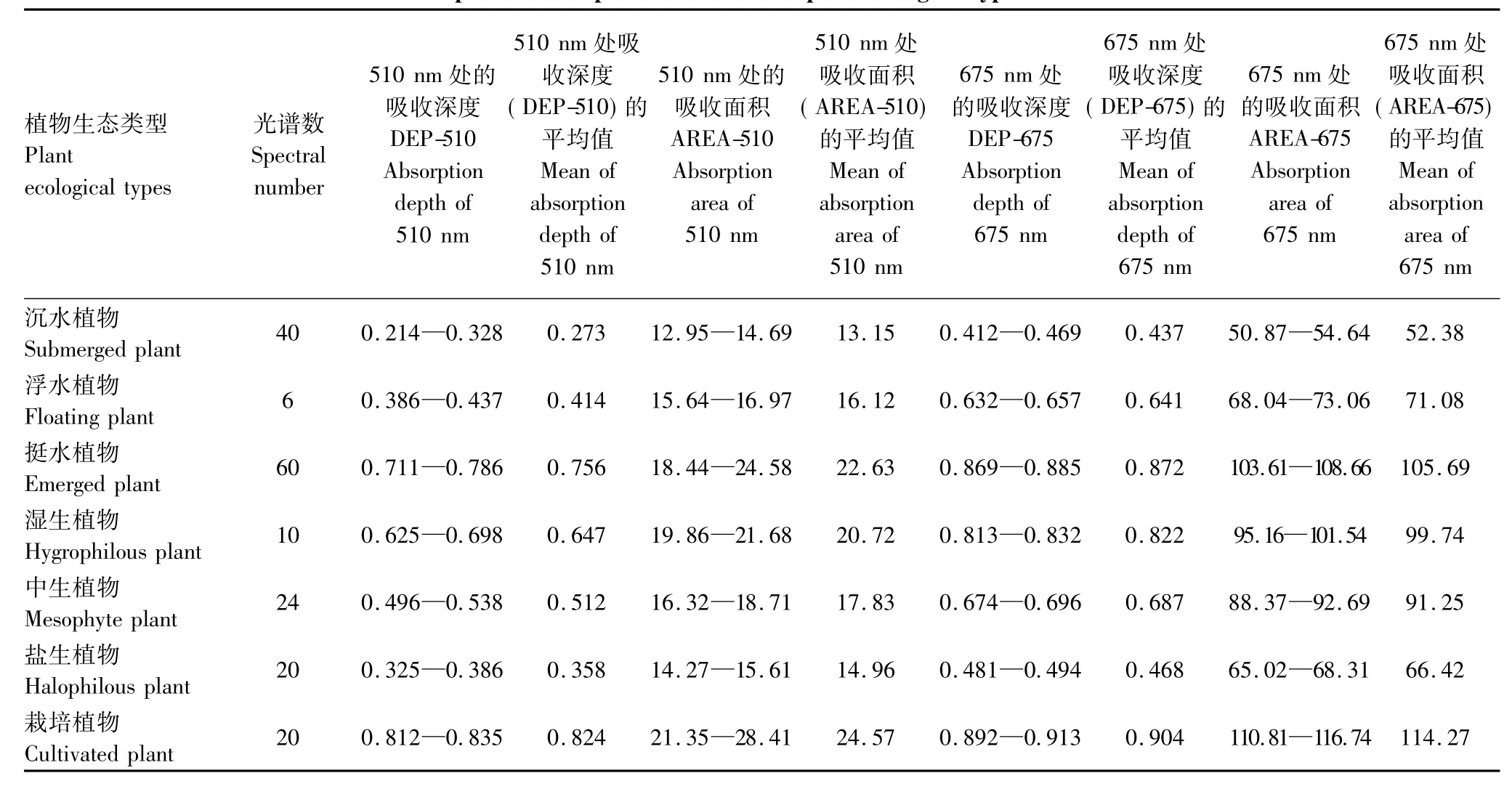
表3 野鸭湖7种植物生态类型吸收特征参数统计表Table 3 Absorption feature parameters of seven plant ecological types in Wild Duck Lake
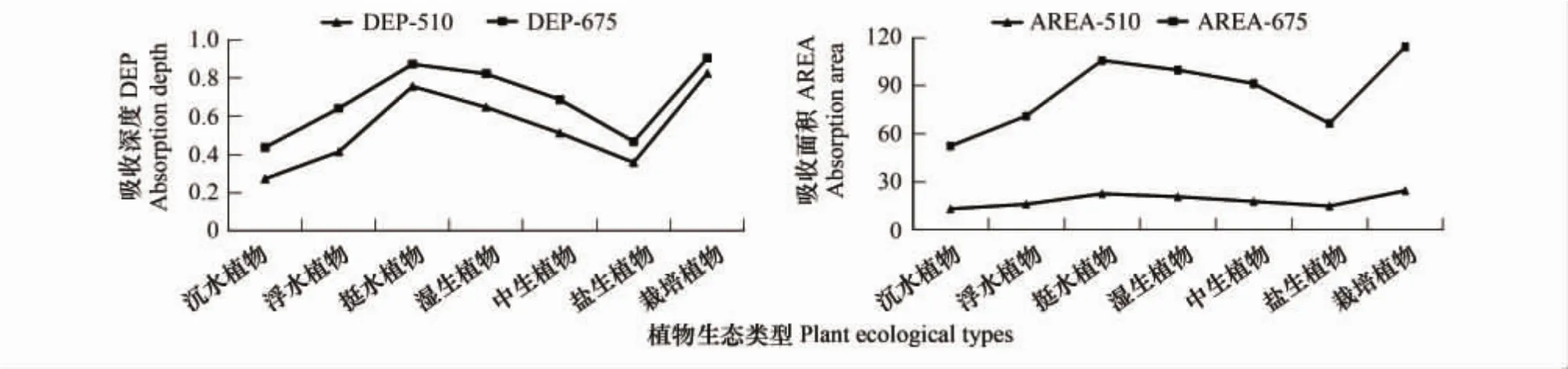
图9 野鸭湖7种植物生态类型吸收特征参数Fig.9 Absorption feature parameters of seven plant ecological types in Wild Duck Lake
3.1.3 基于光谱特征变量的单因素方差分析
利用检验样本,应用单因素方差分析(One-way ANOVA)验证所选的8个(WP_r、Dr、WP_g、Rg、DEP-510、AREA-510、DEP-675和AREA-675)光谱特征变量是否能够较好的区分各植物生态类型。单因素方差分析的结果如图10所示。图中区分度的含义为,如果能够区分7种植物生态类型中的任意两种,则区分度+1。在P≤0.01的置信水平下,选取的8个光谱特征参数都能够较好的区分7种植物生态类型。其中,吸收特征参数的区分度优于一阶导数参数。
3.2 基于选定光谱特征变量的湿地典型植物生态类型识别
3.2.1 基于BP-ANN模型的湿地植物生态类型识别
利用训练样本和检验样本,应用BP-ANN模型进行湿地植物生态类型识别。在训练前,由于选取的光谱特征变量范围和单位不一致,因而需要对训练样本与检验样本数据进行归一化处理。归一化处理方法选择最大小法,计算公式为:xk=(xk-xmin)/(xmax-xmin)。经过多次试验,选取单隐层的BP网络,输入层一共有8个神经元,隐蔽层取7个神经元,输出层为7个神经元。隐蔽层的传递函数为S型正切函数(tansig),输出层节点转移函数选用纯线性函数。训练函数采用学习率可以变化的动量BP算法,学习速率选择0.01,学习目标误差精度制定为ε=10-4,训练迭代次数为10000次。将训练样本用作网络训练,检验样本测试网络的识别能力。BP-ANN模型的识别精度如表4所示。利用BPANN模型取得了较高的识别精度,总分类精度达到85.5%,Kappa系数达到0.8473。沉水植物的识别精度最高,达到100%,原因是沉水植物的光谱特征与其他植物生态类型相比,具有较大的差异性,所以不存在错分和漏分的情况;浮水植物的识别精度最低,为75%,原因可能是浮水植物的样本数较少,一旦出现错分或者漏分的情况,对识别精度影响较大。
3.2.2 基于FLDA的湿地植物生态类型识别
在SPSS 17.0统计分析软件中,利用训练样本建立Fisher线性判别函数。判别系数如表5所示。将检验样本的8个光谱特征变量带入Fisher线性判别函数计算其在各类别上的判别值,并根据判别值的大小,比较不同类别的判别值,哪个大就属于哪一类。FLDA的识别精度如表6所示。利用Fisher线性判别分析方法同样取得了较高的分类精度,总分类精度达到87.98%,Kappa系数达到0.8672。其中,沉水植物与浮水植物的识别精度达到100%,中生植物的识别精度较低,为75%。由于沉水植物的光谱特征与其他植物生态类型相比,具有较大的差异性,所以分类精度仍然为100%,依旧不存在错分与漏分的情况。与基于BP-ANN模型的识别结果相比,浮水植物的识别精度有了较大幅度的提高,中生植物的识别精度有了较大幅度的降低,原因可能是由于识别算法本身的规则表达和运行机制不同,导致对于同一种植物生态类型的识别精度具有一定的差异。

图10 单因素方差分析结果图Fig.10 The result of single factor analysis of variance

表4 基于BP-ANN模型的分类精度矩阵Table 4 Classification accuracy matrix based on BP-ANN model
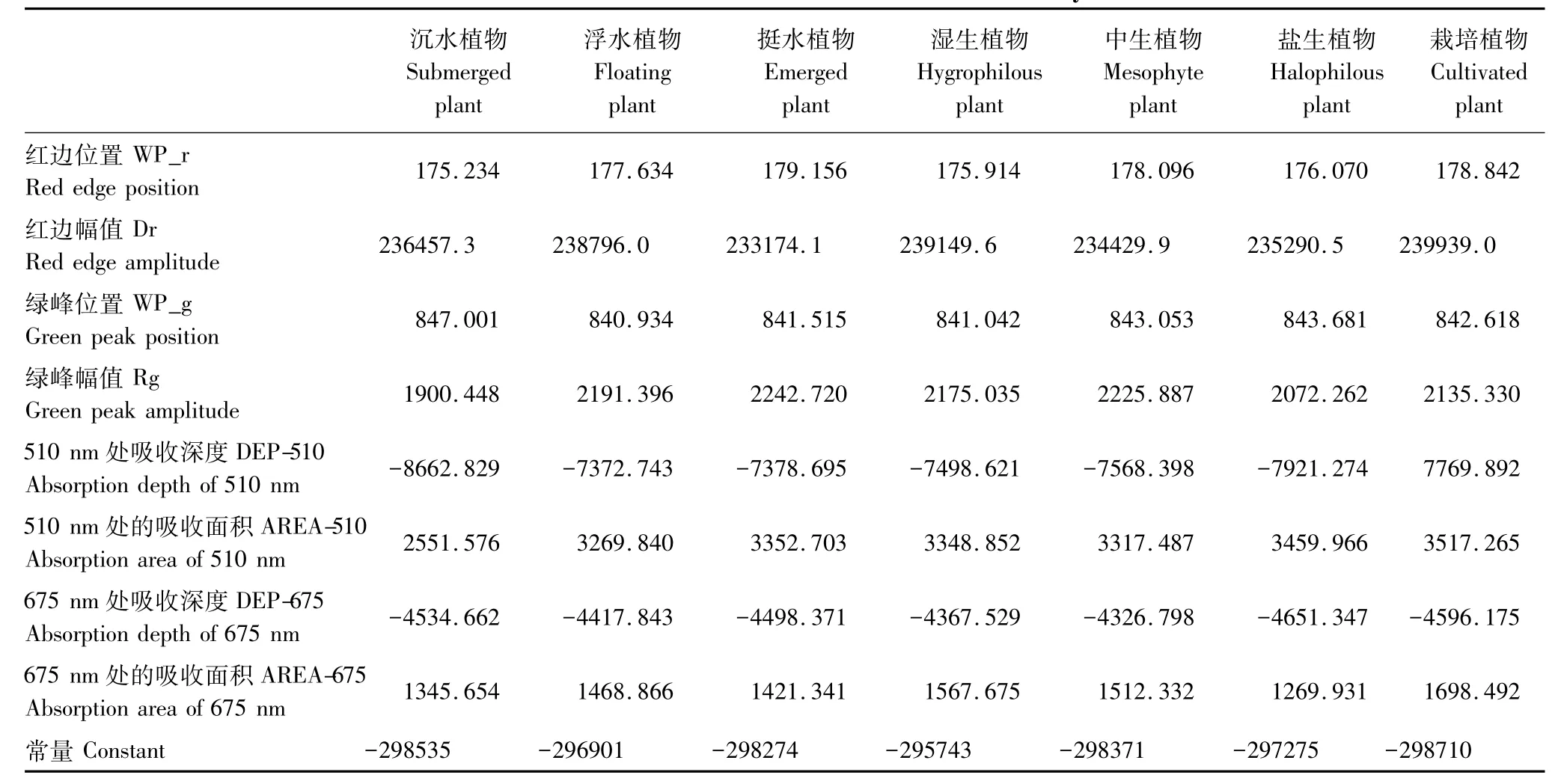
表5 Fisher线性判别系数Table 5 The coefficient of fisher linear discriminant analysis

表6 基于FLDA的分类精度矩阵Table 6 Classification accuracy matrix based on FLDA
4 结论与讨论
许多关于植物生态类型光谱特征的研究表明分析和选择光谱特征变量进行植被研究具有现实的可行性[29]。除了能够应用于农作物、森林之外,本次研究表明也能够应用于淡水湿地植被。目前,大多数研究所得到的光谱特征变量具有一定的相似性,说明一些关键光谱特征变量在植被研究中具有普适性,但是由于植被反射光谱在物种水平上存在不同,也具有一定差异,不同研究对象的光谱特征变量有所不同[30]。
本次研究的7种植物生态类型中,沉水植物的反射光谱由于受到水体和水中悬浮物等因素的影响,其反射光谱特征较为特别。其他6种植物生态类型的反射光谱则具有一定的相似性,但是由于不同植物生态类型的植物形态、含水量、叶绿素含量等方面不同,因而呈现出不同的反射光谱特征,并且通过光谱微分技术中的一阶导数分析方法和光谱吸收谷/反射峰特征分析中的包络线去除法,可以放大这些差异,是选择光谱特征变量的有效分析方法。
植被的分布与其生境条件具有密切关系,植被种类能够作为生境条件的反应或指示。野鸭湖湿地植物的分布、生存以及演替主要受控于水盐等生境条件[21]。本文的研究对象正是不同生境下的湿地植物,通过一阶导数和包络线去除法,选出了能够区分不同生境湿地植物的光谱特征变量。利用湿地光谱特征变量进行湿地制图,进而获取湿地植物的生境信息,对于分析湿地植物演替等具有潜在的应用价值。选定的8个光谱特征变量为红边位置WP_r、红边幅值Dr、绿峰位置WP_g、绿峰幅值Rg、510 nm附近的吸收深度DEP-510和吸收面积AREA-510、675 nm附近的吸收深度DEP-675和吸收面积AREA-675。
在应用选定的8个光谱特征变量进行湿地植物生态类型识别之前,首先对检验样本进行单因素方差分析(One-way ANOVA)处理,验证了8个光谱特征变量对7种湿地植物生态类型的区分度,结果表明,所选的8个光谱特征变量能够较好的区分7种湿地植物生态类型,具有一定的普适性和可靠性。
本文最后利用非线性BP-ANN与线性判别分析(FLDA)的类型识别方法,利用选定的8个光谱特征变量进行湿地植物生态类型识别,取得了较好的识别精度,两种方法的总分类精度分别达到85.5%和87.98%,说明选定的8个光谱特征变量对不同分类器具有良好的适应性,再次证明所选的光谱特征变量具有一定的普适性和可靠性。其中,两种方法对沉水植物的识别精度最高,均为100%。以上研究成果不仅能够为野鸭湖湿地植被的高光谱遥感数据处理与湿地植被制图提供较为有力的科学依据,也可以为淡水湿地植被的遥感识别和分类提供一定的借鉴。
本次研究虽然取得了较为理想的结果,但是仍然存在以下不足:(1)仅应用6月上旬至7月下旬的实测光谱数据,进行湿地植物生态类型的光谱特征分析以及识别,所得结论是否适用于整个生长季的湿地植物,还有待于进一步的研究;(2)样本数量在一定程度上影响着BP-ANN模型和FLDA的识别精度。本文所使用的样本数量仍然较少,在以后的研究中需要进一步增加样本量;(3)本文的研究对象为植物生态类型,在下一步的研究中,应该对数据进行深入挖掘,将研究对象进一步细化,达到群落或者更高层次;(4)本次研究中只应用实测光谱数据进行分析,在下一步研究中应结合机载或星载高光谱影像,达到图谱合一,充分发挥高光谱遥感技术的特点和优势。
[1]Liu K,Zhao W J,Guo X Y,Hu D Y,Gong Z N,Long J.Spectral bands of typical wetland vegetation in the Wild Duck Lake.Acta Ecologica Sinica,2010,30(21):5853-5861.
[2]Charlotte M,Manithaphone M.Mapping wetlands in the Lower Mekong Basin for wetland resource and conservation management using Landsat ETM images and field survey data.Journal of Environmental Management,2009,90:2130-2137.
[3]Aurélie D,Gaёtan L,Brigitte P.Wetland monitoring using classification trees and SPOT-5 seasonal time series.Remote Sensing of Environment,2010,114:552-562.
[4]Xi Z,Alfred S,Xiao L C.Monitoring the dynamics of wetland inundation by random sets on multi-temporal images.Remote Sensing of Environment,2011,115:2390-2401.
[5]Iryna D,Peng G,Lin W.Object-based analysis and change detection of major wetland cover types and their classification uncertainty during the low water period at Poyang Lake,China.Remote Sensing of Environment,2011,115:3220-3236.
[6]Li B Z,Li M X,Zhou X,Zhang L S,Zhang H Y.Hyperspectral estimation models for nitrogen contents of apple leaves.Journal of Remote Sensing,2010,14(4):767-780.
[7]Chen B,Li S K,Wang K R,Wang F Y,Xiao C H,Pan W C.Study on hyperspectral estimation of pigment contents in leaves of cotton under disease stress.Spectroscopy and Spectral Analysis,2010,30(2):421-425.
[8]Rachid B,Kamal L,Patrick L,Anne G,Brahim O.Using HySpex SWIR-320m hyperspectral data for the identification and mapping of minerals in hand specimens of carbonate rocks from the Ankloute Formation(Agadir Basin,Western Morocco).Journal of African Earth Sciences,2011,61:1-9.
[9]Jollineau M Y,Howarth P J.Mapping an inland wetland complex using hyperspectral imagery.International Journal of Remote Sensing,2008,29(12):3609-3631.
[10]Hamada Y,Stow D A,Coulter L L,Jafolla J C,Hendricks L W.Detecting Tamarisk species(Tamarix spp.)in riparian habitats of Southern California using high spatial resolution hyperspectral imagery.Remote Sensing of Environment,2007,109(2):237-248.
[11]Wang C,Menenti M,Stoll M P,Belluco E,Marani M.Mapping mixed vegetation communities in salt marshes using airborne spectral data.Remote Sensing of Environment,2007,107(4):559-570.
[12]Schmidt K S,Skidmore A K.Spectral discrimination of vegetation types in a coastal wetland.Remote Sensing of Environment,2003,85(1):92-108.
[13]Zhang M,Pinzon J E,Ustin S L,Rejmankova E.Differentiating salt marsh species using foreground/background analysis//ERIM 2nd Ann.Airborne Remote Sensing Conference,1996,1:83-92.
[14]Elhadi A,Onisimo M.Spectral discrimination of papyrus vegetation(Cyperus papyrus L.)in swamp wetlands using field spectrometry.ISPRS Journal of Photogrammetry and Remote Sensing,2009,64:612-620.
[15]Zomer R J,Trabucco A,Ustin S L.Building spectral libraries for wetlands land cover classification and hyperspectral remote sensing.Journal of Environmental Management,2009,90:2170-2177.
[16]Tong Q X,Zhang B,Zheng L F.Hyperspectral Remote Sensing— Principle,Technique and Application.Beijing:Higher Education Press,2006:136-146.
[17]Zhang Y R,Gong Z N,Zhao W J.Typical plant spectral characteristics analysis in Wild Duck Lake along water environment gradient.Spectroscopy and Spectral Analysis,2012,32(3):743-748.
[18]Qian Y R,Jia Z H,Yu J,Yang F,Duan W L.Application of BP-ANN to classification of hyperspectral grassland in desert.Computer Engineering and Applications,2011,47(12):225-228.
[19]Yang J,Yang J Y,Ye H.Theory of fisher linear discriminant analysis and its application.Acta Automatica Sinica,2003,29(4):481-493.
[20]Chen W,Hu D,Fu B Q,Gong Z N,Gao W,Hong J M,Du G S.Studies on Biological Diversity of Wetland in Beijing.Beijing:Science Press,2007:46-58.
[21]Gong Z N,Zhao W J,Hu D.Wetland plant community characteristics and ecological succession mode in Wild Duck Lake along salt and water environment gradient.Progress in Natural Science,2009,19(11):1272-1280.
[22]Gong Z N,Gong H L,Hu D.Wetland plants in Wild Duke Lake,Beijing.Beijing:China Environmental Science Press,2012:19-225.
[23]Huang W J.Remote sensing monitoring of crop diseases—Mechanism and Application.Beijing:China Agricultural Science and Technology Press,2009:113-114.
[24]Wang J H,Zhao C J,Huang W J.Fundamentals and Applications of Quantitative Remote Sensing in Agriculture.Beijing:Science Press,2008:157-158.
[25]Yue Y M,Zhang B,Wang K L,Liu B,Li R,Jiao Q J,Yang Q Q,Zhang M Y.Spectral indices for estimating ecological indicators of karst rocky desertification.International Journal of Remote Sensing,2010,31(8):2115-2122.
[26]Freek van der M.Analysis of spectral absorption features in hyperspectral imagery.International Journal of Applied Earth Observation and Geoinformation,2004,5:55-68.
[27]Huang C M,Cai R S.Application of One-way ANOVA in environmental tests.Electronic Product Reliability and Environmental Testing,2010,28(6):21-26.
[28]Lou X L,Huang W G.An artificial neural network method for detecting red tides with NOAA AVHRR imagery.Journal of Remote Sensing,2003,2(7):125-131.
[29]Thenkabail P S,Smith R B,DePauw E.Hyperspectral vegetation indices and their relationships with agricultural crop characteristics.Remote Sensing of Environment,2000,71(2):158-182.
[30]Cochrane M A.Using vegetation reflectance variability for species level classification of hyperspectral data.International Journal of Remote Sensing,2000,21(10):2075-2087.
参考文献:
[1]刘克,赵文吉,郭逍宇,胡德勇,宫兆宁,龙娟.野鸭湖典型湿地植物光谱特征.生态学报,2010,30(21):5853-5861.
[6]李丙智,李敏夏,周璇,张林森,张海燕.苹果树叶片全氮含量高光谱估算模型研究.遥感学报,2010,14(4):767-780.
[7]陈兵,李少昆,王克如,王方永,肖春华,潘文超.病害胁迫下棉花叶片色素含量高光谱遥感估测研究.光谱学与光谱分析,2010,30(2):421-425.
[16〛 童庆禧,张兵,郑兰芬.高光谱遥感-原理、技术与应用.北京:高等教育出版社,2006:136-146.
[17]张翼然,宫兆宁,赵文吉.水分环境梯度下野鸭湖湿地典型植物光谱特征分析.光谱学与光谱分析,2012,32(3):743-748.
[18]钱育蓉,贾振红,于炯,杨峰,段文亮.BP-ANN在荒漠草地高光谱分类研究中的应用.计算机工程与应用,2011,47(12):225-228.
[19]杨健,杨静宇,叶晖.Fisher线性鉴别分析的理论研究及其应用.自动化学报,2003,29(4):481-493.
[20]陈卫,胡东,付必谦,宫兆宁,高武,洪剑明,杜桂森.北京湿地生物多样性研究.北京:科学出版社,2007:46-58.
[21]宫兆宁,赵文吉,胡东.水盐环境梯度下野鸭湖湿地植物群落特征及其生态演替模式.自然科学进展,2009,19(11):1272-1280.
[22]宫兆宁,宫辉力,胡东.北京野鸭湖湿地植物.北京:中国环境科学出版社,2012:19-225.
[23]黄文江.作物病害遥感监测——机理与应用.北京:中国农业科学技术出版社,2009:113-114.
[24]王纪华,赵春江,黄文江.农业定量遥感基础与应用.北京:科学出版社,2008:157-158.
[27]黄创绵,蔡汝山.单因素方差分析方法在环境试验中的应用.电子产品可靠性与环境试验,2010,28(6):21-26.
[28]楼绣林,黄韦垠.基于人工神经网络的赤潮卫星遥感方法研究.遥感学报,2003,2(7):125-131.
