艾塞那肽对载脂蛋白E基因敲除小鼠动脉粥样硬化模型中VCAM-1、ICAM-1表达的影响
2013-08-02陈若然梁琳琅王健美王宇
陈若然,梁琳琅,王健美,王宇
艾塞那肽对载脂蛋白E基因敲除小鼠动脉粥样硬化模型中VCAM-1、ICAM-1表达的影响
陈若然,梁琳琅,王健美,王宇
目的探讨胰高血糖素样肽1(GLP-1)受体激动剂艾塞那肽对ApoE-/-小鼠动脉粥样硬化模型中主动脉病变的影响。方法 ApoE-/-小鼠随机分为普通饮食组(n=14)和高脂饮食组(n=68),喂养12周后随机抽取普通饮食组4只和高脂饮食组8只小鼠检测造模情况。将高脂饮食组小鼠再分为非药物干预组、阿托伐他汀钙片组、艾塞那肽小剂量组、艾塞那肽大剂量组、阿托伐他汀+艾塞那肽小剂量组、阿托伐他汀+艾塞那肽大剂量组(每组10只)。药物干预6周后,各组小鼠眶周静脉丛取血,并取主动脉弓行石蜡切片,HE染色观察。ELISA法检测血清血脂水平,Western blotting检测主动脉血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)的蛋白表达水平。结果HE染色结果显示:普通饮食组及阿托伐他汀+艾塞那肽大剂量组镜下观察未见异常;阿托伐他汀钙片组,艾塞那肽小、大剂量组,阿托伐他汀+艾塞那肽小剂量组可见广泛的病理性内膜增厚;非药物干预组有脂质斑块形成,可见脂核。单独应用艾塞那肽或联合阿托伐他汀可不同程度降低血清血脂(TC、TG、LDL-C)水平(P<0.05)。艾塞那肽不同剂量单独或联合阿托伐他汀可降低主动脉VCAM-1、ICAM-1的表达(P<0.05)。结论艾塞那肽可能通过下调ApoE-/-小鼠主动脉VCAM-1、ICAM-1的表达,抑制ApoE-/-小鼠动脉粥样硬化病变的形成。
艾塞那肽;动脉粥样硬化;载脂蛋白E类;小鼠,基因敲除;血管细胞黏附分子-1;胞间黏附分子-1
[Key words]exenatide; atherosclerosis; apolipoproteins E; mice, knockout; vascular cell adhesion molecule-1; intercellular adhesion molecule-1
糖尿病患者的高糖、高脂状态可直接影响心血管系统,引起心血管并发症,严重危害患者的生命健康。动脉粥样硬化(AS)是糖尿病大血管病变的病理基础,而高糖、高脂在AS形成中的作用很难独立区分[1-2]。近年来研究发现,胰高血糖素样肽1(GLP-1)不仅具有血糖依赖性促胰岛素分泌的降血糖作用[3],还可减轻体重、改善血脂[4],对心血管系统也有一定的保护效应[5-6]。目前关于GLP-1对AS的直接效应报道较少,本研究探讨了GLP-1受体激动剂艾塞那肽对高脂干预的ApoE-/-小鼠AS病变的作用,旨在为防治和延缓糖尿病大血管病变提供依据。
1 材料与方法
1.1动物及饲料 SPF级雄性健康ApoE-/-小鼠[北京华阜康生物科技股份有限公司,动物许可证号:SGSK(京)2009-0004],5~7周龄,体重17~27g,分笼(5~6只/笼)喂养,自由进食、饮水,12h明暗交替,温度23±2℃,湿度55%~65%。普通、高脂饲料购自北京华阜康生物科技股份有限公司;高脂饲料成分为(每100g计):普通饲料79.85g,脂肪15g,蛋黄粉5g,胆固醇0.15g,经60钴灭菌后真空压缩包装。
1.2药物 阿托伐他汀钙片(立普妥,辉瑞制药有限公司);艾塞那肽注射液(百泌达,美国礼来公司)。
1.3主要试剂 甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)试剂盒(南京建成生物工程研究所);小鼠血管细胞黏附分子-1(VCAM-1)抗体、细胞间黏附分子-1(ICAM-1)抗体(美国R&D Systems公司);BCA蛋白浓度测定试剂盒(美国Thermo公司);高灵敏度ECL化学发光检测试剂盒(北京康为世纪生物科技有限公司)。
1.4研究方法 ApoE-/-小鼠在基础饲料条件下适应性喂养7d,随机分为普通饮食组(n=14)和高脂饮食组(n=68)。喂养12周后随机抽取普通饮食组4只、高脂饮食组8只检测造模情况。将其余高脂饮食组小鼠分为6组(每组10只),即非药物干预组、阿托伐他汀钙片组、艾塞那肽小剂量组、艾塞那肽大剂量组、阿托伐他汀+艾塞那肽小剂量组、阿托伐他汀+艾塞那肽大剂量组。阿托伐他汀钙片剂量为10mg/(kg·d),艾塞那肽小、大剂量分别为1.2、100μg/(kg·d)。进行相关药物干预6周后,小鼠禁食12h,眶周静脉丛取血,腹腔内注射戊巴比妥钠(1mg/kg),解剖胸主动脉弓及主动脉,一部分用4%多聚甲醛溶液固定,一部分于液氮中保存备用。
1.5指标检测
1.5.1血清血脂水平检测 TG、TC采用酶法测定,LDL-C采用选择性沉淀法测定。
1.5.2主动脉弓石蜡切片HE染色 4%多聚甲醛溶液中已固定好的胸主动脉弓经梯度乙醇脱水(70%、80%、90%、95%、100%),二甲苯透明,石蜡包埋,常规切片(厚度4μm),HE染色,中性树胶封固,显微镜下摄片。
1.5.3Western blotting检测主动脉中VCAM-1、ICAM-1的蛋白表达 每组分别取胸主动脉血管4根,用PBS冲洗干净后剪碎组织,按1mg组织加入15μl预冷的裂解液(含终浓度1mmol/L的PMSF)于冰上裂解20min,收集裂解组织,4℃、13 000r/min离心15min,取上清;使用BCA定量试剂盒检测蛋白浓度;常规电泳、转膜、封闭后结合VCAM-1、ICAM-1一抗,以β-actin为内参照,4℃孵育过夜;TBST洗膜10min×4次,加入相应二抗,再次洗膜;与化学发光试剂(ECL)PVDF膜共孵育1min,入暗室将PVDF膜与X线片于压片盒中曝光,显影后再定影。扫描胶片,用Quantity One软件分析条带光密度值,以VCAM-1、ICAM-1与β-actin条带的光密度比值评定VCAM-1、ICAM-1蛋白表达水平。
1.6统计学处理 采用SPSS 17.0统计软件进行数据分析,所有数据用±s表示。两样本比较采用t检验,多样本比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1AS模型的建立 喂养12周后,高脂饮食组未见明显AS斑块形成,但可见脂质条纹,内膜中膜厚度较普通饮食组增厚,提示AS造模成功(图1)。
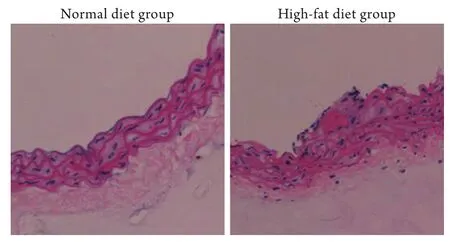
图1 普通饮食组和高脂饮食组主动脉弓病理形态学变化(×200)Fig.1 Pathomorphological change of aortic arch of mice in normal diet group (left) and high-fat diet group (right) (×200)
2.2血清脂质代谢水平 非药物干预组、阿托伐他汀钙片组TC、LDL-C水平明显高于普通饮食组(P<0.05);艾塞那肽小剂量组、艾塞那肽大剂量组、阿托伐他汀+艾塞那肽小剂量组LDL-C水平明显低于非药物干预组(P<0.05);阿托伐他汀+艾塞那肽大剂量组TG水平明显高于普通饮食组,TC、LDL-C水平明显低于非药物干预组(P<0.05,表1)。
2.3各组主动脉弓病理学变化 HE染色结果显示:普通饮食组及阿托伐他汀+艾塞那肽大剂量组内膜结构未见异常;非药物干预组内膜形成脂质斑块,可见脂核;阿托伐他汀钙片组、艾塞那肽小/大剂量组、阿托伐他汀+艾塞那肽小剂量组可见广泛的病理性内膜增厚(图2)。
2.4动脉组织中VCAM-1、ICAM-1蛋白表达水平比较 与普通饮食组相比,除阿托伐他汀钙片组外,其余各组的VCAM-1表达差异均有统计学意义(P<0.05);与非药物干预组相比,除艾塞那肽小剂量组外,其余各组VCAM-1的表达差异均有统计学意义(P<0.05);与阿托伐他汀钙片组相比,除普通饮食组外,其余各组VCAM-1的表达差异均有统计学意义(P<0.05);各药物干预组之间VCAM-1的表达差异无统计学意义。与普通饮食组相比,非药物干预组、阿托伐他汀钙片组、艾塞那肽小剂量组、艾塞那肽大剂量联合阿托伐他汀组ICAM-1的表达差异均有统计学意义(P<0.05);与非药物干预组相比,各组ICAM-1的表达差异均有统计学意义(P<0.05);与阿托伐他汀钙片组相比,各组ICAM-1的表达差异均有统计学意义(P<0.05);各药物干预组之间ICAM-1的表达差异均无统计学意义(图3)。
表1 药物干预对ASApoE-/-小鼠血清血脂的影响(mmol/L,±s,n=10)Tab.1 Effects of drug intervention on the levels of serum lipid in ApoE-deficient mice with atherosclerosis (mmol/L,±s, n=10)

表1 药物干预对ASApoE-/-小鼠血清血脂的影响(mmol/L,±s,n=10)Tab.1 Effects of drug intervention on the levels of serum lipid in ApoE-deficient mice with atherosclerosis (mmol/L,±s, n=10)
(1)P<0.05 compared with normal diet group; (2)P<0.05 compared with non-drug intervention group; (3)P<0.05 compared with atorvastatin group
TC TG LDL-C Normal diet 8.29±2.93 1.77±0.69 2.44±1.04 Non-drug intervention 13.63±1.48(1) 2.16±0.65 6.02±1.66(1)Atorvastatin 13.46±2.37(1) 2.18±0.99 4.99±2.17(1)Exenatide low -dose 10.98±1.22 1.82±0.45 2.02±1.62(2)(3)Exenatide high-dose 9.68±3.60(2) 1.75±0.42 2.34±0.81(2)(3)Atorvastatin + exenatide low -dose 10.04±0.27 1.51±0.23 1.28±1.08(2)(3)Atorvastatin + exenatide high-dose 9.24±1.81(2)(3) 2.88±0.51(1) 0.89±0.74(2)(3)Group

图2 各组主动脉弓病理形态学变化(HE ×200)Fig.2 Pathomorphological change of aortic arch of mice in each group (HE ×200)
3 讨 论
AS是一种累及全身大、中动脉内膜的慢性炎症性疾病,炎症反应贯穿其发生发展的全过程。在高脂等致炎因子的作用下,多种黏附分子活化并与单核细胞表面受体结合,促使单核细胞黏附到损伤的内皮上,这是AS早期病变的重要特征之一[7-8]。黏附分子在介导单核细胞与血管内皮细胞黏附及其相互作用方面起到了关键作用,影响着AS病变的形成与发展。VCAM-1是一种介导细胞与细胞、细胞与细胞外基质间黏附及相互作用的膜表面糖蛋白,在内皮细胞、白细胞、血小板及平滑肌细胞表面表达。ICAM-1属于免疫球蛋白超家族,可表达于白细胞、成纤维细胞、上皮细胞,尤其在血管内皮细胞中的表达最强。ICAM-1在活性内皮细胞上的表达是组织损伤和炎症反应的关键[9-10]。VCAM-1和ICAM-1在抗原表达过程中可以作为淋巴细胞的共刺激信号,在AS中进一步发挥作用。

图3 主动脉内VCAM-1、ICAM-1的蛋白表达Fig.3 Protein expression of VCAM-1 and ICAM-1 in aorta
GLP-1是一种由肠道L细胞分泌的重要的肠促胰素,可通过以葡萄糖依赖方式促进胰岛素分泌,抑制胰高血糖素分泌,延缓胃排空,增加饱腹感等作用维持血糖的稳定[3]。艾塞那肽是人工合成的GLP-1受体激动剂,通过与其受体特异性结合发挥作用。Arakawa等[11]研究表明,Exendin-4可显著减少单核/巨噬细胞在血管壁上的聚集,并最终抑制AS。本研究Western blotting检测表明,非药物干预组小鼠全程接受高脂饲料喂养,VCAM-1、ICAM-1表达水平与其他组比较均显著增加,表明在AS炎症反应过程中艾塞那肽单独或联合阿托伐他汀钙片可抑制黏附分子的过度表达,从而减轻AS炎症,延缓AS进程。在各药物干预组中,阿托伐他汀钙片单用和联合艾塞那肽大剂量组的ICAM-1表达水平、阿托伐他汀钙片联合艾塞那肽大剂量组的VCAM-1表达水平均较普通饮食组低,表明阿托伐他汀钙片联合大剂量艾塞那肽抑制黏附分子表达的效果较好,为防治糖尿病合并大血管并发症提供了依据。艾塞那肽小剂量组中VCAM-1、ICAM-1的表达水平均较其余组高,考虑与该组单独用药及用药剂量较小有关。本实验结果与Arakawa等[11]的结论一致,证实GLP-1可抑制AS的进程。
目前普遍认为,GLP-1的心血管保护效应是综合作用的结果,它可以通过改善心血管系统的相关危险因素如降糖、调脂等而发挥保护作用[12]。本实验血清血脂(TC、TG、LDL-C)水平降低提示艾塞那肽可在一定程度上改善脂代谢。由于本实验采用的ApoE-/-小鼠是非糖尿病鼠,因此在降糖及减轻胰岛素抵抗上的作用表现并不明显。
综上所述,艾塞那肽可能通过抑制ApoE-/-小鼠主动脉上VCAM-1、ICAM-1等多种细胞因子的过度表达实现其抗AS作用,从而抑制ApoE-/-小鼠动脉粥样斑块的形成。同时,艾塞那肽还可通过改善相关危险因素发挥对心血管系统的综合保护作用。因此我们认为,糖尿病大血管病变患者应用GLP-1类药物不仅可以降糖,一定程度上还可对大血管病变起到改善和延缓作用,是治疗伴有大血管并发症或合并血脂等代谢异常糖尿病患者的理想药物。
[1]Gerrity RG, Natarajan R, Nadler JL, et al. Diabetes-induced accelerated atherosclerosis in swine[J]. Diabetes, 2001, 50(7): 1654-1665.
[2]Renard CB, Kramer F, Johansson F, et al. Diabetes and diabetesassociated lipid abnormalities have distinct effects on initiation and progression of atherosclerotic lesions[J]. J Clin Invest, 2004, 114(5): 659-668.
[3]Jin YC, Shen CA, Chai JK, et al. Progress of researches on the structure and biological effects of glucagon-like peptide-1[J]. Med J Chin PLA, 2011, 36(8): 875-878. [金玉翠, 申传安, 柴家科, 等. 胰高血糖素样肽-1的结构及生物学作用研究进展[J]. 解放军医学杂志, 2011, 36(8): 875-878.]
[4]Viswanathan P, Chaudhuri A, Bhatia R, et al. Exenatide therapy in obese patients with type 2 diabetes mellitus treated with insulin[J]. Endocr Pract, 2007, 13(5): 444-450.
[5]Klonoff DC, Buse JB, Nielsen LL, et al. Exenatide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for 3 years[J]. Curr Med Res Opin, 2008, 24(1): 275-286.
[6]Goyal S, Kumar S, Bijjem KV, et al. Role of glucagon-like peptide-1 in vascular endothelial dysfunction[J]. Indian J Exp Biol, 2010, 48(1): 61-69.
[7]Calixto JB, Campos MM, Otuki MF, et al. Anti-inflammatory compounds of plant origin. Part Ⅱ. Modulation of proinflammatory cytokines, chemokines and adhesion molecules[J]. Planta Med, 2004, 70(2): 93-103.
[8]Kitagawa K, Matsumoto M, Sassaki T, et al. Involvement of ICAM-1 in the progression of atherosclerosis in apoE-knockout mice[J]. Atherosclerosis, 2002, 160(2): 305-310.
[9]Lu SF, Chen JY. Relationship between intercellular adhesion molecule 1 and macrovascular complications of type 2 diabetes mellitus[J]. Zhejiang Prev Med, 2007, 19(5): 59-61. [卢曙芳,陈建悦. 细胞间黏附分子1与2型糖尿病大血管病变的关系[J]. 浙江预防医学, 2007, 19(5): 59-61.]
[10]Zhang JX, Xiang GD, Sun HL, et al. Effect of α-lipoic acid in inhibiting the expression of intercellular adhesion molecule-1 in human umbilical vein endothelial cells under high glucoseconcentration[J]. Med J Chin PLA, 2009, 34(11): 1353-1355. [张军霞, 向光大, 孙慧伶, 等. α-硫辛酸对高糖作用下血管内皮细胞ICAM-1表达的影响[J]. 解放军医学杂志, 2009, 34(11): 1353-1355.]
[11]Arakawa M, Mita T, Azuma K, et al. Inhibition of monocyte adhesion to endothelial cells and attenuation of atherosclerotic lesion by a glucagon-like peptide-1 receptor agonist, exendin-4[J]. Diabetes, 2010, 59(4): 1030-1037.
[12]Liu L, Yan ZX. Protective effects of glucagon-like peptide-1 on cardiovascular system[J]. Chin Med Her, 2011, 8(21): 5-7. [刘琳, 严宗逊. 胰高血糖素样肽-1对心血管系统的保护效应[J]. 中国医药导报, 2011, 8(21): 5-7.]
Effects of exenatide on expression of VCAM-1, ICAM-1 in ApoE-knock-out mice with atherosclerosis
CHEN Ruo-ran1, LIANG Lin-lang2*, WANG Jian-mei2, WANG Yu2
1Postgraduate Training Base of General Hospital of Shenyang Command, Liaoning Medical University, Jinzhou, Liaoning 121000, China
2Department of Endocrinology, General Hospital of Shenyang Command, Shenyang 110016, China
*
, E-mail: lianglllj@sina.com
ObjectiveTo investigate the effect of exenatide, a glucagon-like peptide-1 receptor agonist, on aortic lesions in ApoE-knock-out (ApoE-/-) mice with atherosclerosis.MethodsApoE-/-mice were randomly divided into normal diet group (n=14) and high-fat diet group (n=68). After fed for 12 weeks, 4 from normal diet group and 8 from high-fat diet group were randomly chosen for verification of model reproductions. Then the mice in high-fat diet group were divided into 6 groups (10 each): nondrug intervention group, atorvastatin group, exenatide low/high-dose groups and atorvastatin + exenatide low/high-dose groups. After 6 weeks of drug intervention, blood samples were collected from the retro-orbital venous plexus of the mice. All the mice were sacrificed by intraperitoneal injection of sodium pentobarbital, and paraffin sections of the aortic arch was processed for HE staining. The serum lipid level was measured by ELISA, the protein expressions of vascular cell adhesion molecule-1 (VCAM-1) and intercellular adhesion molecule-1 (ICAM-1) were determined by Western blotting.ResultsHE staining showed that the histology of the aorta of mice in normal diet group and atorvastatin + exenatide high-dose group were normal, but those of atorvastatin group and exenatide low/high-dose groups and atorvastatin + exenatide low-dose group showed extensive pathological thickening of endometrium. Lipid plaques were formed with visible lipid cores in the aorta of mice in non-drug intervention group. Application of exenatide alone or combined with atorvastatin reduced the levels of serum lipid (TC, TG, LDL-C) in varying degrees (P<0.05). Different doses of exenatide alone or in combination with atorvastatin reduced the expression of VCAM-1, ICAM-1 in aorta (P<0.05).ConclusionsExenatide may inhibit the formation of atherosclerotic lesions by down-regulating the expression of VCAM-1, ICAM-1 in aorta of ApoE-/-mice.
R541.4
A
0577-7402(2013)06-0467-05
2013-03-04;
2013-04-15)
(责任编辑:张小利)
陈若然,硕士研究生。主要从事糖尿病及其并发症的研究
121000 辽宁锦州 辽宁医学院沈阳军区总医院研究生培养基地(陈若然);110016 沈阳 沈阳军区总医院内分泌科(梁琳琅、王健美、王宇)
梁琳琅,E-mail:lianglllj@sina.com
