FLT3-ITD阳性与阴性急性髓细胞白血病的实验室特征及预后比较
2013-08-02李婷婷孙雪冬董征余长林孙琪云乔建辉胡锴勋刘广贤姚波艾辉胜郭梅
李婷婷,孙雪冬,董征,余长林,孙琪云,乔建辉,胡锴勋,刘广贤,姚波,艾辉胜,郭梅
FLT3-ITD阳性与阴性急性髓细胞白血病的实验室特征及预后比较
李婷婷,孙雪冬,董征,余长林,孙琪云,乔建辉,胡锴勋,刘广贤,姚波,艾辉胜,郭梅
目的比较伴FLT3基因突变(FLT3-ITD+)与不伴FLT3基因突变(FLT3-ITD-)的急性髓细胞白血病(AML)患者的实验室特征、疗效以及预后。方法2010年10月-2012年10月收治的初诊AML患者93例,年龄10~66岁,包括21例FLT3-ITD+AML(22.6%)和72例FLT3-ITD-AML(77.4%,对照组)列入分析。比较两组患者的临床表现,HOX11、EVI、ETO、MLL、NPM1基因表达情况,细胞学抗原(CD34/CD38、淋巴抗原、CD7和CD4)表达情况,细胞遗传学表现(正常核型、复杂核型),2年无事件生存(EFS)和2年总生存(OS)情况。结果FLT3-ITD+AML初诊时合并外周血白细胞增高(>100×109/L)及出血者多于FLT3-ITD-组(P<0.01,P=0.004),但两组在年龄、免疫表型及染色体异常等方面无明显差异。FLT3-ITD+AML完全缓解(CR)率28.57%,显著低于FLT3-ITD-AML的55.56%(P=0.03)。FLT3-ITD+AML 2年无事件生存率为29.2%,低于FLT3-ITD-AML组(37.7%,P=0.04)。FLT3-ITD+AML联合表达NPM1者占33.33%,明显高于FLT3-ITD-AML组(1.39%,P=0.001)。FLT3-ITD+AML中表达NPM1的患者均未达完全缓解。结论FLT3-ITD+AML易合并白细胞增高,完全缓解率低,无事件存活率低,预后差。
白血病,前髓细胞性,急性;易位,遗传;FLT3基因;NPM1基因
FLT3是Ⅲ型受体酪氨酸激酶(RTK)家族成员的原癌基因,其蛋白产物属于受体,定位于细胞膜。FLT3与其配体(FL)在骨髓中仅表达于造血干/祖细胞并对其增殖和分化发挥调节作用[1]。配体与FLT3细胞外结构域的结合会使FLT3二聚体化,酪氨酸残基磷酸化,并通过与多种胞质蛋白结合介导一系列细胞内信号传导,导致细胞增殖和活化[2-4]。FLT3基因突变可导致正常血细胞增殖和分化出现异常。近来研究发现FLT3基因的异常表达、突变与急性白血病(acute leukemia,AL)的发生、发展、预后有密切关系,主要发生在急性髓细胞白血病(acute myeloid leukemia,AML),突变类型主要包括近膜区的内部串联复制(internal tandem duplication,ITD),占20%~35%,以及酪氨酸激酶结构域(tyrosin kinase domain,TKD)的突变。其中,TKD突变常发生于激酶结构域Ⅱ,人最常见的是835位天冬氨酸残基(Asp835)的突变,占7%~10%[2]。FLT3-ITD突变阳性(此后表述为FLT3-ITD+)的AML往往病情凶险,化疗反应差,缓解率低,早期死亡率高[5-7]。因此,对FLT3-ITD+AML的研究受到国外学者的广泛关注,国外文献已将FLT3-ITD+作为AML独立的预后不良指标。近年来,我国学者对AML FLT3基因突变的研究明显增多,尤其是对FLT3-ITD+AML的基因学特点、检测技术及其在白血病中的分布等研究较多,但尚缺乏FLT3-ITD突变阳性与阴性AML患者临床和实验室特点的比较分析及其疗效和预后的研究报告。本文总结比较了军事医学科学院附属医院血液科收治的93例伴或不伴FLT3-ITD突变的初诊AML患者的临床特征、细胞学、免疫学、细胞遗传学、分子生物学特性及治疗效果和预后等情况,报告如下。
1 资料与方法
1.1研究对象 2010年10月-2012年10月我院血液科共收治年龄10~65岁初次诊断为AML的患者93例(急性早幼粒细胞白血病、继发性AML和慢性粒细胞白血病急性变未纳入),对其临床资料进行回顾性分析。全部病例均按国际FAB标准和WHO标准,经骨髓形态、细胞化学染色及免疫分型结果确诊[8],常规行染色体/FISH及ETO、PML/RARα、NPM1 和FLT3-ITD等融合基因检查。列入分析的93例患者中,FLT3-ITD基因突变阳性患者(FLT3-ITD+组)21例,FLT3-ITD基因突变阴性者72例(FLT3-ITD-组)。
1.2FLT3-ITD基因突变及相关基因表达检测 参照文献[9],采用聚合酶链反应(PCR)法检测FLT3-ITD基因突变状态及HOX11、EVI、MLL、ETO、NPM1基因表达水平。
1.3细胞遗传学检查 采用染色体R显带法,核型异常的描述根据人类细胞遗传学国际命名体制(ISCN1995)[10],按本实验室常规方法进行,油镜下分析20~30个中期分裂细胞。
1.4白血病免疫分型 采用直接/间接免疫荧光技术标记,以流式细胞仪检测髓系、T系、B系及干/祖系相关的单克隆抗体。
1.5诱导缓解及缓解后治疗 采用MA方案[米托蒽醌10mg/(m2·d),1~3d;阿糖胞苷150~250mg/d,5~10d]或IA方案(盐酸伊达比星8~12mg/d,1~3d;阿糖胞苷150~250mg/d,5~10d)进行诱导缓解化疗。如第一个疗程诱导化疗未达到完全缓解(CR),则在原方案基础上加用替尼泊苷100~150mg(d2,d5),即第二疗程诱导化疗。如两疗程诱导化疗未达CR,则视为治疗失败,评价为难治性急性髓细胞白血病,则重新制订治疗方案。缓解后治疗:达CR的患者,根据患者及供体情况选择HLA相合或半相合非清髓移植、非血缘移植或微移植作为缓解后治疗。
1.6疗效及诊断标准 诊断、分型及疗效判定参照文献[11]的标准。无事件生存(event-free survival,EFS)指确诊后至治疗失败、复发或各种原因所致的死亡;无上述事件发生的患者计算至末次随访检查日(2012年12月);未达CR者自诊断之日开始计算至疾病进展或死亡。总生存(overall survival,OS)指白血病诊断至患者死亡或最后随访时间(2012年12月)。
1.7统计学处理 采用SPSS 17.0软件进行统计分析。计量资料采用t检验,计数资料采用χ2检验,率的比较采用四格表资料的χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1一般情况 93例AML患者的临床特征见表1。93例患者中,FLT3-ITD+组21例(22.6%),男9例(42.9%),女12例(57.1%),平均年龄为41.2(10~63)岁,FAB亚型中M1 1例、M2 7例、M4 3例、M5 10例。FLT3-ITD-组72例(77.4%),其中男41例(56.9%),女31例(43.1%),平均年龄38.8(10~65)岁,FAB亚型中M2 32例、M4 13例、M5 22例、M6 5例。两组患者的性别、年龄等临床特征相近,但FLT3-ITD-组的病例数明显多于FLT3-ITD+组(表1)。
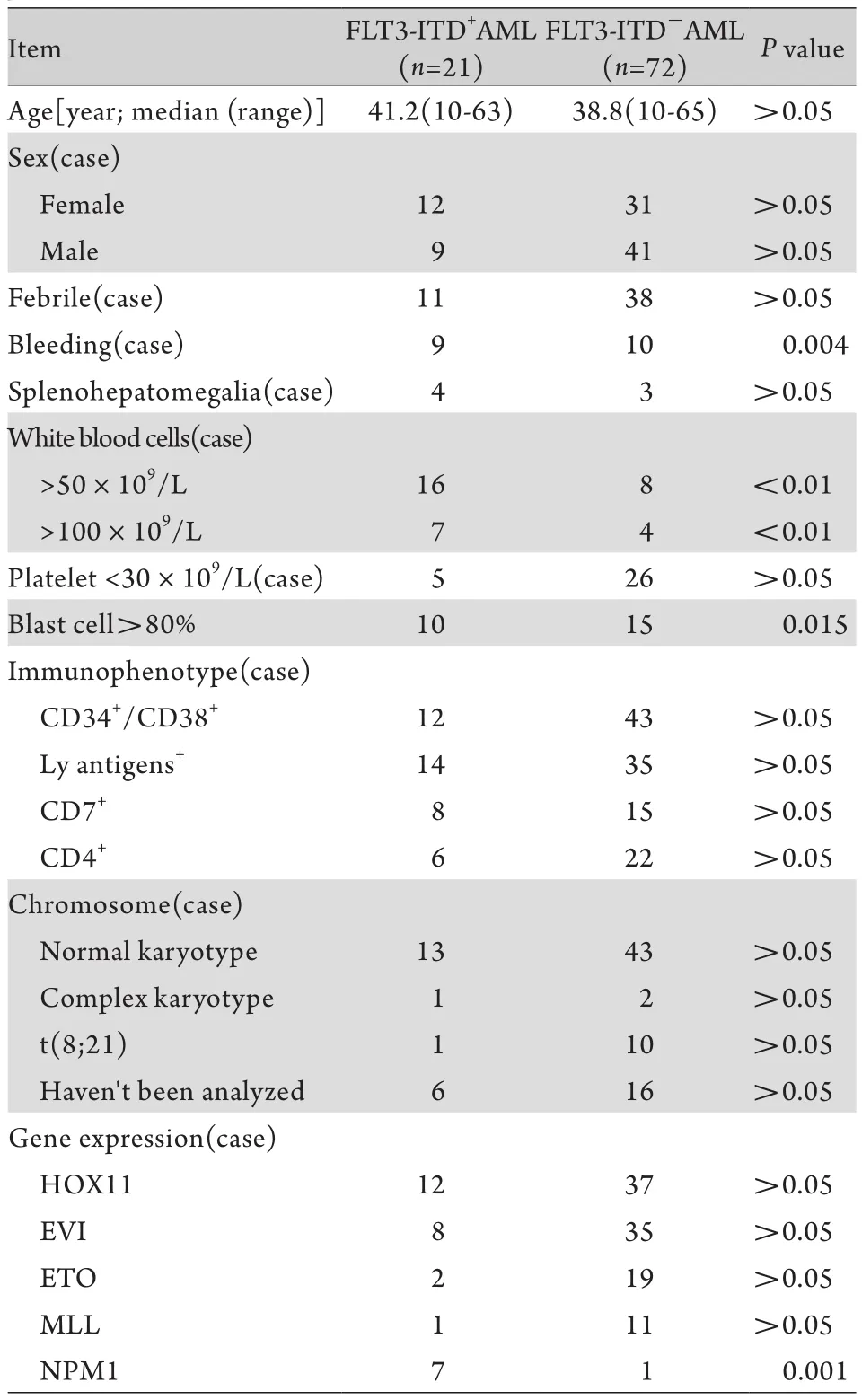
表1 93例AML患者的临床和实验室特征Tab. 1 Clinical and laboratory characteristics of 93 AML patients
2.2临床表现 两组患者诊断时合并发热、肝脾大的比例接近(P>0.05),但FLT3-ITD+组出血发生率(42.86%)高于FLT3-ITD-组(13.89%),差异有统计学意义(P=0.004)。此外,FLT3-ITD+组诊断时外周血白细胞数>50×109/L者各占76.19%,其中>100×109/L的占33.33%,明显高于对照组的11.11%和5.56%,差异有统计学意义(P<0.01,P<0.01)。两组骨髓中白血病细胞比例>80%者分别为47.62%和20.83%,差异有统计学意义(P=0.015)。
2.3免疫分型 两组均有较高的CD34或CD38抗原表达(57.14%和59.72%),差异无统计学意义(P=0.832)。FLT3-ITD+组淋巴系抗原共表达的比例为66.67%,高于FLT3-ITD-组的48.61%,但差异无统计学意义(P=0.145)。FLT3-ITD+组CD7抗原的共表达率为38.09%,高于FLT3-ITD-组的20.83%,而FLT3-ITD-组的CD4抗原共表达率为30.56%,高于FLT3-ITD+组的28.57%,但差异均无统计学意义(P>0.05)。
2.4染色体 两组正常核型、复杂核型所占比例近似,差异无统计学意义(P>0.05)。其他染色体异常如t(8;21)易位,在FLT3-ITD-组的发生率(15.38%)与FLT3-ITD+组(5.26%)差异无统计学意义(P>0.05)。
2.5基因表达 两组的HOX11、ETO和EVI基因表达无明显差异,FLT3-ITD-组的MLL表达率为15.28%,与FLT3-ITD+组(4.76%)之间差异无统计学意义(P值均>0.05)。FLT3-ITD+组的NPM1基因表达率高达33.33%,明显高于FLT3-ITD-组的1.39%,差异有统计学意义(P=0.001)。
2.6疗效 所有患者CR的比例为58.06%,其中FLT3-ITD+组CR率仅33.33%,明显低于FLT3-ITD-组的65.28%,差异有统计学意义(P=0.013)。一个疗程后的CR率FLT3-ITD-组为55.56%,明显高于FLT3-ITD+组的28.57%(P=0.03)。FLT3-ITD+组总的2年EFS率为29.2%,低于FLT3-ITD-组的37.7%,差异有统计学意义(图1,P=0.04)。FLT3-ITD+组总的2年为43.7%,与FLT3-ITD-组(67.1%)比较差异无统计学意义(图1,P=0.17)。值得注意的是,FLT3-ITD+组21例患者中共表达NPM1的7例患者起病时外周血白细胞数均高于50×109/L,其中4例高于100×109/L,7例中无1例达CR并均早期死亡。其他14例NPM1阴性患者中,10例(71.4%)白细胞数高于50×109/L,7例(50%)达CR,两组的CR率差异均有统计学意义(P=0.022)。

图1 FLT3-ITD+组和FLT3-ITD-组AML患者2年EFS和OSFig. 1 The probability of 2-years EFS and OS in AML patients with(FLT3-ITD+) or without FLT3-ITD gene mutation(FLT3-ITD-)
3 讨 论
FLT3-ITD基因突变(FLT3-ITD+)是AML中最常见的突变类型之一[12-13]。正常情况下,酪氨酸激酶受体的近膜区和“激活环”具有自我抑制功能,使激酶保持一种非活性构象。如发生FLT3-ITD基因突变,将导致酪氨酸激酶持续活化,使细胞发生自发性、非依赖性增殖,与肿瘤和白血病的发生密切相关。文献报道,成人初次诊断AML的患者有20%~30%存在FLT3-ITD突变[5-7,14]。本研究显示,93例初诊AML患者中,伴FLT3-ITD突变者共21例(22.58%),与国内外文献相近。另有文献报道,老年AML中FLT3-ITD突变的阳性率略高,可达34%或更高[15-16],但本研究显示FLT3-ITD突变阳性与阴性组的年龄和性别均无明显差异。
既往大多数文献认为FLT3-ITD突变阳性者具有外周血白细胞数目及骨髓白血病细胞比例高的临床特点[2,5-7,17]。本研究显示,FLT3-ITD突变阳性与阴性两组患者的发热、肝脾肿大、血小板数目及骨髓中白血病细胞数目等指标均未见明显差异。但是,初诊时FLT3-ITD突变阳性AML患者的白细胞数目高于50×109/L和100×109/L者均明显多于阴性组,差异有统计学意义(P<0.01)。大量文献报道,FLT3-ITD突变阳性AML患者的临床疗效差,诱导缓解率低、无病(事件)生存率和总生存率低[18-20]。本组结果显示,FLT3-ITD+AML患者CR率仅为33.33%,明显低于FLT3-ITD-者的65.28%(P=0.03),FLT3-ITD+AML患者的2年EFS为29.2%,亦明显低于FLT3-ITD-者的37.7%(P=0.04),与文献报告基本一致,说明FLT3-ITD是AML患者能否获得CR、EFS和长期生存的不良预后因素。
有关FLT3-ITD突变阳性AML的免疫学和细胞遗传学特征国内外报告均较少[21-22],本研究结果显示,两组患者的髓系抗原表达率、合并表达淋巴系抗原及CD34/CD38抗原的比例等均未见明显差异。FLT3-ITD突变阳性AML的复杂染色体比例高于阴性组,但不存在统计学差异,推测与本组病例数较少有关。
既往文献对FLT3基因突变与NPM1等其他分子标志的相关性研究已有较多报道[18,22-24]。本研究结果显示两组患者MLL、HOX11、EVI、ETO基因的表达率无明显差别,与文献报告一致。文献报道,NPM1基因在初诊AML患者中的阳性表达率为20%~50%,而表达NPM1基因的AML患者预后更好[19,23-24]。2008年WHO更将NPM1基因列为低危AML患者的重要分子标志。文献认为,FLT3-ITD基因突变合并NPM1基因阳性的AML患者,其比例低于不伴FLT3-ITD突变者,且绝大多数文献报道FLT3-ITD基因突变AML患者如果同时合并NPM1基因阳性表达,则患者的临床疗效(包括CR率、EFS和OS等)均优于FLT3-ITD单独阳性的患者[25-28]。但也有文献认为,这两类患者的临床疗效相近[29],还有极个别文献报道FLT3-ITD基因突变合并NPM1基因阳性表达的AML患者临床疗效更差[30]。Micol等[29]分析的102例AML患者中42例(41.18%)存在FLT3-ITD突变和NPMl基因表达阳性,这些患者与仅存在FLT3-ITD突变患者的CR率分别为70.3%和72.4%,差异并无统计学意义。Döhner等[30]研究了300例16~60岁AML患者,结果显示CR率在NPM1基因阳性表达的患者中最高(86%),其次为FLT3-ITD突变阳性患者(76%),而在NPM1和FLT3-ITD均阳性的患者中最低,仅为63%(P<0.001)。本组结果显示,FLT3-ITD+组患者合并表达NPM1基因者为33.33%,明显高于FLT3-ITD阴性组的1.39%。此结果虽然不同于大多数文献,但却与Micol等[29]的报告相近。此外,本研究FLT3-ITD+组21例患者中,7例同时合并NPM1基因阳性表达者的白细胞数均高于50×109/L,而且此7例患者均未达CR并均早期死亡,其疗效明显差于其他14例FLT3-ITD单独阳性者。此结果除与Döhner等[30]的报告类似外,与绝大多数文献的报告结果并不一致,值得临床工作者重视。
总之,本研究显示,与FLT3-ITD-患者相比,FLT3-ITD+AML患者初诊时容易合并出血、高白细胞数和NPM1基因高表达。FLT3-ITD突变阳性AML患者的CR率低、EFS短,FLT3-ITD突变同时合并NPM1基因表达的AML患者,其临床疗效更差。
[1]Wang HW, Lu JY, Tian G, et al. Immunotherapeutical role of Flt3 ligand amplification of pulmonary dendritic cells in murine multiple organ dysfunction syndrome in vivo[J]. Med J Chin PLA, 2012, 37(8): 774-778. [王宏伟, 陆江阳, 田光, 等. Flt3配体体内扩增肺树突细胞对多器官功能障碍综合征模型小鼠的免疫治疗作用观察[J]. 解放军医学杂志, 2012, 37(8): 774-778.]
[2]Zaker F, Mohammadzadeh M, Mohammadi M. Detection of KIT and FLT3 mutations in acute myeloid leukemia with different subtypes[J]. Arch Iran Med, 2010, 13(1): 21-25.
[3]Rönnstrand L. Oncogenic signaling from the hematopoietic growth factor receptors c-Kit and Flt3[J]. Cell Signal, 2009,21(12): 1717-1726.
[4]Habif G, Grasset M F, Kieffer-Jaquinod S, et al. Phosphop-roteome analyses reveal specific implications of Hcls1, p21-activated kinase 1 and Ezrin in proliferation of a myeloid progenitor cell line downstream of wild-type and ITD mutant Fms-like tyrosine kinase 3 receptors[J]. J Proteomics, 2013, 78: 231-244.
[5]Pratz KW, Sato T, Murphy KM, et al. FLT3 mutant allelic burden and clinical status are predictive of response to FLT3 inhibitors in AML[J]. Blood, 2010, 115(7): 1425-1432.
[6]Gale RE, Green C, Allen C, et al. The impact of FLT3 internal tandem duplication mutant level, number, size, and interaction with NPM1 mutations in a large cohort of young adult patients with acute myeloid leukemia[J]. Blood, 2008, 111(5): 2776-2784.
[7]Whitman SP, Ruppert AS, Radmacher MD, et al. FLT3 D835/ I836 mutations are associated with poor disease-free survival and a distinct gene-expression signature among younger adults with de novo cytogenetically normal acute myeloid leukemia lacking FLT3 internal tandem duplications[J]. Blood, 2008, 111 (3): 1552-1559.
[8]Cheson BD, Bennett JM, Kopecky KJ, et al. Revised recommendations of the International Working Group for Diagnosis, Standardization of Response Criteria, Treatment Outcomes, and Reporting Standards for Therapeutic Trials in Acute Myeloid Leukemia[J]. J Clin Oncol, 2003, 21(24): 4642-4649.
[9]Scheijen B, Ngo HT, Kang H, et al. FLT3 receptors with internal tandem duplications promote cell viability and proliferation by signaling through Foxo proteins[J]. Oncogene, 2004, 23(19): 3338-3349.
[10]Farag SS, Archer KJ, Mrózek K, et al. Pretreatment cytogenetics add to other prognostic factors predicting complete remission and long-term outcome in patients 60 years of age or older with acute myeloid leukemia: results from Cancer and Leukemia Group B 8461[J]. Blood, 2006, 108(1): 63-73.
[11]Zhang ZN, Shen T. Diagnosis and outcome evaluation criteria[M]. 3rd Ed. Beijing: Science Press, 2007. 133. [张之南,沈悌. 血液病诊断及疗效标准[M]. 3版. 北京: 科学出版社, 2007. 133.]
[12]Xu B, Tang JH, Li L, et al. The expression and clinical significance of FLT3/ITD gene mutation in hematologic malignancies[J]. Chin J Pract Intern Med, 2007, 27(14): 1113-1115.[徐兵, 唐家宏, 李琳, 等. 血液肿瘤患者FLT3/ITD基因突变的检测及临床意义[J]. 中国实用内科杂志, 2007, 27(14): 1113-1115.]
[13]Yan LZ, Yang L, Chen SN, et al. Research on mutation of gene NPM1 and FLT3 in patients with adult acute myelogenous leukemia[J]. Chin J Pract Intern Med, 2007, 2007, 27(S1): 68.[颜灵芝, 杨莉, 陈苏宁, 等. 成人急性髓性白血病患者NPM1与FLT3基因突变的研究[J]. 中国实用内科杂志, 2007, 27(S1): 68.]
[14]Borthakur G, Kantarjian H, Ravandi F, et al. Phase I study of sorafenib in patients with refractory or relapsed acute leukemias[J]. Haematologica, 2011, 96(1): 62-68.
[15]Wang LH, Zhou CL, Zhang XW, et al. Prevalence and clinical significance of FLT3 internal tandem duplication mutation in acute leukemia[J]. Chin J Hematol, 2004, 25(7): 393-396.[王莉红, 周春林, 张新伟, 等. FLT3基因内部串联重复突变与急性白血病的关系及临床意义[J]. 中华血液学杂志, 2004, 25(7): 393-396.]
[16]Singh H, Asali S, Werner LL, et al. Outcome of older adults with cytogenetically normal AML (CN-AML) and FLT3 mutations[J]. Leuk Res, 2011, 35(12): 1611-1615.
[17]Haferlach T, Bacher U, Alpermann T, et al. Amount of bone marrow blasts is strongly correlated to NPM1 and FLT3 mutation rate in AML with normal karyotype[J]. Leukemia Res, 2012, 36(1): 51-58.
[18]Lee SH, Paietta E, Racevskis J, et al. Complete resolution of leukemia cutis with sorafenib in an acute myeloid leukemia patient with FLT3 mutation[J]. Am J Hematol, 2009, 84(10): 701-702.
[19]Martelli M P, Pettirossi V, Thiede C, et al. CD34+cells from AML with mutated NPM1 harbor cytoplasmic mutated nucleophosmin and generate leukemia in immunocompromised mice[J]. Blood, 2010, 116(19): 3907-3922.
[20]Kindler T, Lipka DB, Fischer T. FLT3 as a therapeutic target in AML: still challenging after all these years[J]. Blood, 2010, 116(24): 5089-5102.
[21]Dunlap J, Beadling C, Warrick A, et al. Multiplex highthroughput gene mutation analysis in acute myeloid leukemia[J]. Hum Pathol, 2012, 43(12): 2167-2176.
[22]Dang H, Jiang A, Kamel-Reid S, et al. Prognostic value of immunophenotyping and gene mutations in elderly patients with acute myeloid leukemia with normal karyotype[J]. Hum Pathol, 2013, 44(1): 55-61.
[23]Kim HJ. Mutations in AML with a normal karyotype: NPM1 and FLT3, ready to use as a key prognosticator[J]? Korean J Hematol, 2010, 45(2): 79-80.
[24]Schnittger S, Bacher U, Kern W, et al. Prognostic impact of FLT3 load in NPM1 mutated acute myeloid leukemia[J]. Leukemia, 2011, 25(8): 1297-1304.
[25]Schnittger S, Kern W, Tschulik C, et al. Minimal residual disease levels assessed by NPM1 mutation-specific RQ-PCR provide important prognostic information in AML[J]. Blood, 2009, 114(11): 2220-2231.
[26]Wang L, Xu W L, Meng HT, et al. FLT3 and NPM1 mutations in Chinese patients with acute myeloid leukemia and normal cytogenetics[J]. J Zhejiang Univ Sci B, 2010, 11(10): 762-770. [27]Falini B, Martelli M P, Bolli N, et al. Acute myeloid leukemia with mutated nucleophosmin (NPM1): is it a distinct entity[J]? Blood, 2011, 117(4): 1109-1120.
[28]Erdogan T, Lars B, Andrea C, et al. Prognostic impact, concurrent genetic mutations, and gene expression features of AML with CEBPA mutations in a cohort of 1182 cytogenetically normal AML patients: further evidence for CEBPA double mutant AML as a distinctive disease entity[J]. Blood, 2011, 117(8): 2469-2475.
[29]Micol JB, Boissel N, RennevilIe A, et a1. The role of cytogenetic abnormalities in acute myeloid leukemia with NPMl mutations and no FLT3 internal tandem duplication[J]. Blood, 2009, 114(20): 4601-4602.
[30]Döhner K, Schlenk RF, Habdank M, et al. Mutant nucleophosmin (NPM1) predicts favorable prognosis in younger adults with acute myeloid leukemia and normal cytogenetics: interaction with other gene mutations[J]. Blood, 2005, 106 (12): 3740-3746.
Comparison of molecular biology, immunological characteristics and clinical efficacy in patients with acute myelogenous leukemia with or without FLT3-ITD gene mutation
LI Ting-ting1,2, SUN Xue-dong2, DONG Zheng2, YU Chang-lin2, SUN Qi-yun2, QIAO Jian-hui2, HU Kai-xun2, LIU Guang-xian2, YAO Bo2, AI Hui-sheng2, GUO Mei2*
1Postgraduate School, Anhui Medical University, Hefei 230032, China
2Department of Hematology, Affiliated Hospital, Academy of Military Medical Sciences, Beijing 100071, China
*
, E-mail: guom196801@yahoo.com.cn
This work was supported by the key Program of National Natural Science Foundation of China (81130054), and the General Program of National Natural Science Foundation of China (81170493)
ObjectiveTo compare the clinical and laboratory characteristics, therapeutic efficacy and prognosis of acute myelogenous leukemia (AML) with or without FLT3-ITD gene mutation.MethodsThe clinical data of 93 AML patients, aged from 10 to 66 years, were retrospectively analyzed. Among them, 21 patients were FLT3-ITD gene (FLT3-ITD+AML group) positive, and 72 patients were negative for FLT3-ITD gene (FLT3-ITD-AML group). The patients' chromosomes were examined, and mutation of FLT3-ITD and NPM1 gene and the expressions of HOX11, ETO, EVI and NPM1 gene were analyzed, along with the 2-year event-free survival and 2-year overall survival were learned.ResultsAt primary diagnosis, the proportion of patients with WBC>100×109/L, and bleeding rate was significantly higher in FLT3-ITD+AML group than that in FLT3-ITD-AML group (P=0.04; P=0.01), but no statistical difference was found in age, immunophenotype and chromosomal abnormality (P>0.05). The complete remission (CR) rate was 28.57% in FLT3-ITD+AML group, and it was obviously lower than that in FLT3-ITD-AML group (55.56%, P=0.013). The 2-year event-free survival was 29.2% in FLT3-ITD+AML group, and it was significantly lower than that in FLT3-ITD-AML group (37.7%; P=0.04). Meanwhile, 33.3% of the patients in FLT3-ITD-AML group were also positive for NPM1 gene expression, and all of them did not get complete remission. However, only 1.39% of the patients expressed NPM1 genein FLT3-ITD-AML group, but 50% of them got complete remission (P=0.022).ConclusionPatients with FLT3-ITD+AML were easily associated with high WBC counts, bleeding, lower CR rate, poor event-free survival, and poor prognosis.
leukemia, promyelocytic, acute; translocation, genetic; FLT3 gene; NPM1 gene
R733.712
A
0577-7402(2013)06-0501-05
2013-03-12;
2013-04-12)
(责任编辑:沈宁)
国家自然科学基金重点项目(81130054);国家自然科学基金面上项目(81170493)
李婷婷,住院医师,硕士研究生。主要从事恶性血液病方面的研究
230032 合肥 安徽医科大学研究生院[李婷婷(现在军事医学科学院附属医院血液科)];100071 北京 军事医学科学院附属医院血液科(孙雪冬、董征、余长林、孙琪云、乔建辉、胡锴勋、刘广贤、姚波、艾辉胜、郭梅)
郭梅,E-mail:guom196801@yahoo.com.cn
