热打击对单层肠上皮Caco-2细胞屏障功能的影响
2013-08-02肖桂珍袁芳芳古正涛刘志锋张亚历苏磊
肖桂珍,袁芳芳,古正涛,刘志锋,张亚历,苏磊
热打击对单层肠上皮Caco-2细胞屏障功能的影响
肖桂珍,袁芳芳,古正涛,刘志锋,张亚历,苏磊
目的研究热打击对肠黏膜屏障上皮细胞间紧密连接及凋亡的影响。方法采用肠上皮细胞株Caco-2建立肠屏障模型,检测经37~43℃热打击后细胞的单层跨膜电阻抗(TEER)值及对大分子物质辣根过氧化物酶(HRP)的通透性,采用Western blotting检测occludin蛋白的表达水平,Annexin V-FITC/PI流式细胞术检测细胞凋亡情况。结果随着热打击温度的升高,TEER值降低,HRP通透性增加,37℃热打击细胞的TEER值和HRP通透性与39、41、43℃热打击细胞差异均有统计学意义(P<0.01)。热打击温度从37℃到41℃,occludin蛋白的表达逐渐增加,于41℃达峰值,此后逐渐下降。43℃时随热打击时间延长,occludin蛋白表达逐渐降低。随热打击温度(37~43℃)升高,细胞凋亡逐渐增加(P<0.05或P<0.01)。结论热打击可造成肠上皮紧密连接的明显破坏,细胞凋亡增加,从而破坏肠屏障功能。
中暑;肠黏膜;细胞凋亡
中暑是一种威胁生命的机体状态,其特征为核心体温升高(>40℃)[1],可影响包括肠道在内的各器官系统功能。相邻肠上皮细胞靠上部的紧密连接聚合成机械屏障,可防止肠腔内的病原体和抗原侵入肠黏膜,对维持肠壁通透性具有重要作用[2]。中暑动物模型显示,体温升高到40~42℃可导致肠上皮破坏及通透性增高,肠内有毒物质入血[3],诱发全身炎症反应综合征(SIRS)和多器官功能障碍(MODS),甚至导致死亡[4]。因此,研究肠黏膜屏障功能的破坏机制、寻找保护因素对中暑的预防和治疗意义重大。有研究观察到热打击可破坏细胞间紧密连接[5],但并未从蛋白水平以及细胞凋亡方面对肠屏障功能进行系统研究。本实验采用Caco-2细胞建立肠上皮细胞模型,探讨高温对肠屏障的影响。
1 材料与方法
1.1主要材料及仪器 肠上皮细胞株Caco-2细胞(ATCC,Manassas,VA),Transwell小室(直径6.5mm,孔径3μm,Corning公司),Annexin V-FITC/PI试剂盒、小鼠抗occludin抗体(BD Biosciences公司),小鼠抗β-actin抗体(中杉金桥公司),TMB显色液、BCA蛋白浓度测定试剂盒(碧云天公司),辣根过氧化物酶(HRP,typeⅤ,Sigma公司),Immobilon Western发光液(Millipore公司),空气恒温箱(Edison公司),多功能酶标仪(Molecular Devices公司),细胞电阻计(EVOM,World Precision Instruments公司),BD FACSCanto Ⅱ流式细胞仪(美国BD公司)。
1.2热损伤模型的建立 Caco-2细胞用含10%胎牛血清的DMEM完全培养液在5%CO2、37℃、90%相对湿度条件下培养。取生长至80%~90%融合的细胞,换液后置于空气恒温箱中,调节温度和时间进行热打击。打击结束后重新置入培养箱中。
1.3细胞单层跨膜电阻抗(TEER)值检测 每个Transwell小室的上室种植2.0×106个细胞,上室和下室分别加入200μl和600μl培养液。取不同的3个点,将细胞电阻仪电极的短臂和长臂分别插入上室和下室测定TEER值。培养至7~14d,待TEER值超过250Ω/cm2后,即可进行热损伤实验。由于各孔基础值有差异,将各组热打击前的TEER值设为1,经37~43℃持续1h的热打击后,立即测定TEER值,计算热打击后与热打击前TEER值的比值,以TEER(%)表示。
1.4单层细胞通透性测定 将Transwell小室中换为去酚红的DMEM培养液,将辣根过氧化物酶(HRP)加入上室(终浓度3.4×10-6mol/L)。热打击后,于下室中取2μl培养基,置于96孔板内,加入TMB显色液,于多功能酶标仪370nm波长处读数,绘制标准曲线,计算HRP浓度,以其占加入总HRP量的百分比(%)表示。
1.5Western blotting检测 经37~43℃持续1~4h的热打击后,将细胞培养24h,提取蛋白,BCA试剂盒测定浓度。取等量样品蛋白,10%SDS-PAGE凝胶电泳分离,以湿转移法将蛋白条带转移至PVDF膜上。封闭后,分别加入小鼠抗occludin抗体(1:500)、小鼠抗β-actin抗体(1:1000)孵育过夜,加入相应的二抗(1:3000)孵育2h,采用Immobilon Western发光液检测,以β-actin为内参对照。
1.6Annexin V-FITC/PI流式细胞术检测细胞凋亡将处于对数生长期的细胞进行37~43℃持续1h的热打击,再培养24h;用无EDTA的胰蛋白酶消化,2000r/min离心5min,冷PBS洗2次;取100μl缓冲液重悬细胞,加入5μl AnnexinV-FITC和5μl PI混匀;室温避光孵育15min后上机检测,检测细胞数为1×105个,激发波长488nm,发射波长530nm。
1.7统计学处理 采用SPSS 13.0软件进行统计分析,计量资料以±s表示,多组间比较采用单因素方差分析(ANOVA,Bonferroni),进一步两两比较采用Bonferroni法,P<0.05为差异有统计学意义。
2 结 果
2.1细胞单层通透性的改变 经过1h的热打击,与37℃热打击的细胞相比,39℃、41℃和43℃热打击细胞的TEER值(%)均明显降低(P<0.01)。相应的随着温度升高,下室中大分子物质HRP占上室加入量的百分比逐渐增加,与37℃热打击细胞相比差异显著(P<0.01),即从上室漏入下室的HRP增多,表明细胞间空隙加大,通透性增高(表1)。
表1 温度升高对TEER值(%)和大分子物质HRP通透性的影响(±s,n=6)Tab.1 Effects of heat stress on TEER(%) and permeability to HRP flux±s, n=6)

表1 温度升高对TEER值(%)和大分子物质HRP通透性的影响(±s,n=6)Tab.1 Effects of heat stress on TEER(%) and permeability to HRP flux±s, n=6)
(1)P<0.01 compared with 37℃
Temperature(℃) TEER(%) HRP flux(%) 37 1.025±0.025 0.037±0.002 39 0.921±0.053(1) 0.047±0.002(1)41 0.769±0.050(1) 0.071±0.004(1)43 0.701±0.025(1) 0.132±0.009(1)
2.2紧密连接蛋白occludin表达的变化 经37~43℃持续1h的热打击后,从37℃到41℃热打击细胞的occludin蛋白表达逐渐增加,在41℃时达高峰,而当温度继续上升,其表达反而下降(图1A)。进行43℃的热打击,时间从1h增加至4h,occludin蛋白表达逐渐降低,且呈时间依赖性(图1B)。
2.3热打击对细胞凋亡率的影响 进行37~43℃持续1h的热打击后,与37℃热打击细胞相比,39、41、43℃热打击细胞的凋亡细胞明显增加(P<0.05或P<0.01),表明热打击可诱导细胞凋亡,并随温度的升高而增强(表2,图2)。
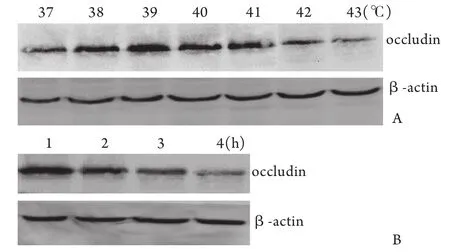
图1 温度升高及时间延长对occludin蛋白的表达影响Fig.1 Effects of heat stress on expression of tight junction protein occludin
表2 温度升高对细胞凋亡率的影响(%,±s,n=3)Tab.2 Effects of heat stress on apoptosis (%±s, n=3)

表2 温度升高对细胞凋亡率的影响(%,±s,n=3)Tab.2 Effects of heat stress on apoptosis (%±s, n=3)
(1)P<0.05, (2)P<0.01 compared with 37℃
Temperature(℃) Early apoptosis cell Non-viable apoptosis cell 37 1.47±0.05 7.15±0.14 39 2.95±0.17(2) 8.43±0.40(1)41 10.02±0.20(2) 16.28±0.20(2)43 18.44±0.58(2) 22.69±0.54(2)
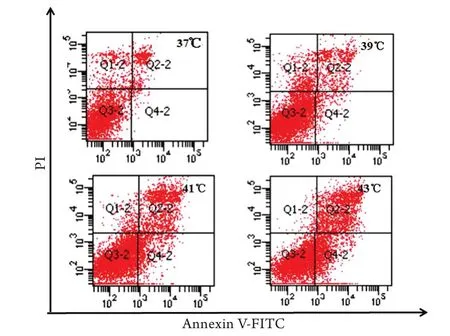
图2 温度升高对细胞凋亡的影响Fig.2 Effects of heat stress on apoptosis
3 讨 论
肠道上皮组织将机体内环境与外环境分开,可有效抵抗外源性病原菌和毒素的入侵。多种有害因素可引起肠上皮细胞破坏,肠黏膜损伤、萎缩,黏膜屏障功能障碍,造成肠道通透性增加[6],使肠腔内的细菌和内毒素进入血液,炎症因子释放,引发炎症反应和肠源性感染[7]。本实验使用源于肠腺癌的Caco-2细胞建立肠上皮细胞屏障模型,该细胞因可形成类似于肠黏膜单层上皮紧密连接的结构,接近正常肠上皮的功能特点,近20年来被广泛用于研究肠上皮紧密连接的体外模型中[8]。
紧密连接是由一系列蛋白、脂肪组成的复合体,位于肠上皮细胞顶端,呈环状连续地围绕于相邻细胞周围,封闭细胞之间的空隙,是机械屏障的主要组成部分,可有效阻止微生物以及一些有害物质进入体内,肠黏膜屏障破坏常伴随肠上皮紧密连接结构和功能的改变。肠上皮紧密连接与多种疾病的发生和发展密切相关,紧密连接结构一旦受损,肠上皮细胞间的通透性增加,就会使细菌和有害物质等进入体内循环,造成炎症反应[9-10]。内毒素移位与中暑的疾病进程有直接关系,Lambert[11]研究发现,高体温可破坏肠上皮细胞膜,使紧密连接开放,肠道屏障功能破坏,对大分子物质的通透性增加,导致肠道细菌和内毒素从相邻的上皮细胞间隙进入,触发热射病。相反,抗内毒素的抗体对受热打击的动物有保护作用,还可阻止病理进程由热损伤向中暑转变[12]。因此,维持紧密连接的正常结构,保护肠屏障功能是预防中暑发生和发展的主要目标之一。
体外试验中,单层细胞的TEER值是反映肠黏膜屏障通透性的主要指标之一,与细胞单层通透性呈负相关。如果细胞完整性受损,则TEER值下降,同时对HRP的通透性升高,HRP通过受损的细胞间空隙漏入下室增多。本研究中,上述两个指标的变化都表明热打击破坏了肠上皮细胞的屏障功能。
紧密连接区域的特异性蛋白包括跨膜蛋白occludin、膜蛋白ZO-1以及claudin蛋白家族等,这些蛋白表达下调时,紧密连接结构会发生改变,肠道屏障功能受损。其中,occludin蛋白是一种跨膜蛋白,参与体内多种屏障结构的形成,位于细胞间紧密连接的缝隙处,在调控细胞间的通透性和信号传导方面有重要意义[13],其表达下调会引起肠上皮细胞通透性明显增加[14]。但是,以往研究发现,以39℃和41℃的高温分别刺激肠上皮Caco-2细胞,occludin表达随打击温度升高和打击时间延长而上升,同时细胞旁通透性增加,推测occludin上调是肠细胞的保护性反应[15]。本研究显示,温度从37℃上升到41℃时,occludin表达上升,这一结果与既往研究一致,但温度继续升高时,occludin的表达反而下降,而且在43℃条件下,随时间延长呈现持续降低的趋势,表明occludin表达并不能无限制地增加而保护和维持紧密连接结构,如果热打击的温度上升到一定阈值,紧密结构也会遭到破坏,因此在高温时能否上调occludin表达可作为判定保护性因素的标准之一。
细胞凋亡对确保机体的生长发育和维持内环境稳定有重要作用。肠黏膜上皮正常结构维持稳定有赖于细胞增殖和凋亡间的平衡[16]。肠黏膜上皮细胞的过度凋亡可减弱肠上皮的再生与修复,引起肠黏膜上皮缺损,造成屏障功能障碍,使细菌和内毒素经缺损处进入体循环。动物实验表明,细菌、内毒素、氧自由基及肠道缺血/再灌注损伤均可引起肠黏膜上皮细胞凋亡增加,同时伴有肠黏膜屏障功能障碍,且通透性与凋亡指数呈正相关[17]。本研究的结果显示,热打击诱导Caco-2细胞凋亡明显增加,且随着温度升高,凋亡细胞数上升,表明热打击可以通过诱导肠黏膜上皮细胞的凋亡损伤肠黏膜屏障。因此可以推测,细胞凋亡率上升是热打击后早期肠屏障功能障碍的重要机制。
综上所述,本研究结果显示,热打击可通过改变occludin蛋白功能及增加细胞凋亡影响紧密连接、增加上皮缺损,使单层肠上皮细胞TEER值下降,对大分子物质的通透性增加,黏膜屏障功能下降。因此,保护肠屏障,减少由此而产生的肠源性感染是减少中暑后炎症反应和死亡率的重要机制。
[1]Bouchama A, Knochel JP. Heat stroke[J]. N Engl J Med, 2002, 346(25): 1978-1988.
[2]Sharma R, Young C, Neu J. Molecular modulation of intestinal epithelial barrier: contribution of microbiota[J]. J Biomed Biotechnol, 2010, 2010: 305879.
[3]Lambert GP, Gisolfi CV, Berg DJ, et al. Selected contribution: Hyperthermia-induced intestinal permeability and the role of oxidative and nitrosative stress[J]. J Appl Physiol, 2002, 92(4): 1750-1761.
[4]Ji J, Song Q, Yue H, et al. The protective role of Xuebijing injection to heat stroke in rats[J]. Med J Chin PLA, 2011, 36(6): 578-581. [纪筠, 宋青, 岳慧, 等. 血必净注射液对热射病大鼠保护机制的研究[J]. 解放军医学杂志, 2011, 36(6): 578-581.]
[5]Yang PC, He SH, Zheng PY. Investigation into the signal transduction pathway via which heat stress impairs intestinal epithelial barrier function[J]. J Gastroenterol Hepatol, 2007, 22(11): 1823-1831.
[6]Yang DZ, Zhou QQ, Li SZ, et al. Intestinal mucosal barrier dysfunction injury induced by altitude hypoxia in rats and the protective effect of glutamine[J]. Med J Chin PLA, 2011, 36(3): 301-306. [杨定周, 周其全, 李素芝, 等. 高原缺氧致大鼠肠黏膜屏障功能损伤及谷氨酰胺的保护作用观察[J]. 解放军医学杂志, 2011, 36(3): 301-306.]
[7]Soeters PB, Luyer MD, Greve JW, et al. The significance of bowel permeability[J]. Curr Opin Clin Nutr Metab Care, 2007, 10(5): 632-638.
[8]Sambuy Y, De Angelis I, Ranaldi G, et al. The Caco-2 cell line as a model of the intestinal barrier: influence of cell and culturerelated factors on Caco-2 cell functional characteristics[J]. Cell Biol Toxicol, 2005, 21(1): 1-26.
[9]Zhang HG, Sun SJ, Yao YZ, et al. Changes of intestinal barrier function and relationship with SIRS in patients with multiple injuries[J]. Med J Chin PLA, 2008, 33(12): 1407-1409. [张宏光, 孙士锦, 姚元章, 等. 多发伤肠屏障功能的改变及其与全身炎症反应综合征关系的研究[J]. 解放军医学杂志, 2008, 33(12): 1407-1409.]
[10]Wang CR, Liu XF, Cheng YG, et al. Protection of intestine function recovery decoction on intestinal mucosa injury for multiple organ dysfunction syndrom rats caused by infection[J]. J Zhengzhou Univ (Med Sci), 2008, 43(6): 1107-1111. [王春荣, 刘学飞, 程永刚, 等. 肠功能恢复汤对感染性多器官功能障碍综合征大鼠肠黏膜损伤的保护作用[J]. 郑州大学学报(医学版), 2008, 43(6): 1107-1111.]
[11]Lambert GP. Stress-induced gastrointestinal barrier dysfunction and its inflammatory effects[J]. J Anim Sci, 2009, 87(14 Suppl): E101-E108.
[12]Gathiram P, Wells MT, Brock-Utne JG, et al. Antilipopolysaccharide improves survival in primates subjected to heat stroke[J]. Circ Shock, 1987, 23(3): 157-164.
[13]Li X, Peng RY, Hu XJ, et al. Changes and significance of occludin expression in rats with blood-brain barrier injury induced by microwave radiation[J]. Med J Chin PLA, 2011, 36(7): 765-769. [李翔, 彭瑞云, 胡向军, 等. Occludin在微波辐射致大鼠血脑屏障损伤中的变化及意义[J]. 解放军医学杂志, 2011, 36(7): 765-769.]
[14]Friis LM, Keelan M, Taylor DE. Campylobacter jejuni drives MyD88-independent interleukin-6 secretion via Toll-like receptor 2[J]. Infect Immun, 2009, 77(4): 1553-1560.
[15]Dokladny K, Moseley PL, Ma TY. Physiologically relevant increase in temperature causes an increase in intestinal epithelial tight junction permeability[J]. Am J Physiol Gastrointest Liver Physiol, 2006, 290(2): G204-G212.
[16]Heller F, Fromm A, Gitter AH, et al. Epithelial apoptosis is a prominent feature of the epithelial barrier disturbance in intestinal inflammation: effect of pro-inflammatory interleukin-13 on epithelial cell function[J]. Mucosal Immunol, 2008, 1 Suppl 1: S58-S61.
[17]Anderson JM. Maintaining a defense as the injured leave the field: apoptosis and barrier function in the intestine[J]. Gastroenterology, 2000, 119(6): 1783-1786.
Effect of heat stress on intestinal barrier function of human intestinal epithelial Caco-2 cells
XIAO Gui-zhen1, YUAN Fang-fang2, GU Zheng-tao2, LIU Zhi-feng2, ZHANG Ya-li1*, SU Lei2*
1Key Laboratory of Gastroenterology of Guangdong Province, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
2Key Laboratory of Hot Zone Trauma Care and Tissue Repair of PLA, Department of Intensive Care Unit, General Hospital of Guangzhou Command, Guangzhou 510010, China
*
. ZHANG Ya-li, E-mail: zyl41531@163.com; SU Lei, E-mail: slei_icu@163.com
This work was supported by the grant from National Natural Science Foundation of China (81071529)
ObjectiveTo investigate the heat stress-induced dysfunction of intestinal barrier including intestinal tight junction and apoptosis of epithelial cells.MethodsHuman intestinal epithelial Caco-2 cell monolayers, serving as the intestinal barrier model, were exposed to different temperature (37-43℃) for designated time. Transepithelial electrical resistance (TEER) and horseradish peroxidase (HRP) flux permeability were measured to evaluate barrier integrity. Level of tight junction (TJ) protein occludin was analyzed by Western blotting. Cell apoptosis rate was determined using Annexin V-FITC/PI kit by flow cytometry.ResultsCompared with the 37℃ group, TEER lowered and the permeability for HRP increased significantly after heat exposure (P<0.01) in 39℃, 41℃ and 43℃ groups. The expression of occludin increased when the temperature was elevated from 37℃to 41℃, and it reached the maximal level at 41℃. However, its expression gradually decreased with passage of time at 43℃. Cell apoptosis was enhanced with elevation of the temperature (P<0.05 orP<0.01).ConclusionHeat stress can induce damage to tight junction and enhance apoptosis of epithelial cells, thus causing dysfunction of intestinal epithelial barrier.
heat stroke; intestinal mucosa; apoptosis
R594.12
A
0577-7402(2013)06-0472-04
2013-01-17;
2013-04-20)
(责任编辑:熊晓然)
国家自然科学基金(81071529)
肖桂珍,博士研究生。主要从事危重患者肠屏障功能的基础与临床研究
510515 广州 南方医科大学南方医院消化病研究所(肖桂珍、张亚历); 510010 广州 全军热区创伤救治与组织修复重点实验室、广州军区广州总医院重症医学科(袁芳芳、古正涛、刘志锋、苏磊)
张亚历,E-mail: zyl41531@163.com;苏磊,E-mail: slei_icu@163.com
