硅溶胶用作FCC催化剂粘结剂的研究现状
2013-07-26张士龙刘钦甫赫军凯康艳霞
张士龙, 刘钦甫, 赫军凯, 康艳霞
(中国矿业大学(北京)地球科学与测绘工程学院,北京 100083)
硅溶胶是二氧化硅纳米颗粒分散于水中形成的胶体。Schwerin在1915年以水玻璃为原料制备了硅溶胶,其SiO2浓度仅为2.4%,实际应用价值较低。Bird在 1941年以离子交换法制备了具有较高浓度及稳定性的硅溶胶,使之实现了大规模的工业化生产及应用。硅溶胶作为一种性能优良的无机粘结剂,在化工、精密铸造、纺织、造纸、涂料、食品、电子、选矿等诸多领域都有非常广泛的应用[1]。
粘结剂是催化裂化(FCC)催化剂的重要组成部分,其性能直接影响 FCC催化剂的各项性能指标。目前常用的粘结剂有铝溶胶、硅溶胶、硅铝溶胶、硅铝凝胶、磷铝溶胶等[2]。硅溶胶中的纳米SiO2颗粒粒径分布集中且容易控制,具有较大比表面积,相比富铝基质催化剂,具有高稳定性[3,4]、高强度[5]、良好的汽油及焦炭选择性[6]、较强的抗重金属污染能力[7]、可调控的催化剂孔结构[4]等特点,是催化裂化催化剂的优良粘结剂。
近年来,随着催化裂化原料油日趋重质化、劣质化,导致催化裂化的生焦率偏高、轻质油收率偏低,使用富硅基质的催化剂能降低非选择性裂化反应的发生,有利于改善催化裂化反应的焦炭选择性和汽油选择性[8]。富硅基质催化剂因其优异的性能正引起人们愈来愈多的重视。开发硅基粘结剂对丰富 FCC催化剂品种,提高催化剂的性能均具有重要意义。
1 硅溶胶的性质
硅溶胶的胶团结构可用图1表示。

图1 硅溶胶的胶团结构Fig.1 The structure of silica sol micelles
硅溶胶外观为灰白色半透明胶体溶液,分为酸性硅溶胶和碱性硅溶胶两种。硅溶胶中的SiO2浓度一般为10%~45%,粒径范围一般在10~30 nm,比表面积为50~400 m2/g。由于硅溶胶中的SiO2粒子含有大量的水及羟基,故硅溶胶化学式可表述为SiO2•nH2O。
式中m、n都很大,且m< 硅溶胶离子的表面状态如图 2所示[9]:其内部由硅氧烷基键(—Si—O—Si—)构成三维网络结构,粒子表面被硅氧醇基(—SiOH)和羟基(—OH)所包覆,它们同胶体中的碱金属离子一同构成扩散双电层。 图2 硅溶胶粒子的表面状态Fig.2 The surface state of silica sol 硅溶胶的制备方法主要分为化学法和机械法两种:化学法是利用溶液中含Si的离子或者基团成核、生长制备超微粒SiO2分散体系;机械法是将SiO2细颗粒在一定条件下分散于水中。按照制备工艺的不同,又可细分为单质溶解法、离子交换法、直接酸中和法、电解电渗析法、胶溶法和分散法[9]。 陈姚[10]等将单质硅粉在催化剂的作用下与水发生水解反应生成硅酸分子,制备工艺如图3所示。其反应方程式为: Si + 2OH-+H2O→SiO32-+ 2H2 图3 单质硅微粉溶解法制备硅溶胶工艺图Fig.3 The preparing method of silica sol by dissolving silicon micro powder 并研究了投料方式、体系pH值和硅粉用量对胶粒粒径的影响。研究表明,采用分批投料的方式,体系pH值稳定在9.5~10,根据产品所需粒径控制投料次数和硅粉用量,可制得粒径分布均匀的硅溶胶。且当硅溶胶浓度为 20%时,其铁离子浓度为7.851×10-6,与离子交换法相比降低了85%。 郑典模[11]等将这一工艺进行改进,以硅微粉和水玻璃为原料,同样在催化剂作用下水解单质硅,通过正交实验法研究了硅粉用量、水玻璃用量、反应温度和反应时间对硅溶胶粒径、硅粉转化率的影响。并在一次工艺流程中通过多次胶粒成长,制备了20, 40, 60, 80 nm 4种不同粒径的硅溶胶。其制备工艺如图4所示。 图4 改良单质水解法制备硅溶胶工艺Fig.4 The improved preparing method of silica sol by dissolving silicon micro powder 田华[12]等研究了单质硅溶解工艺对硅溶胶粘度、波美度和 pH值的影响,制备了粘度为 5.3 mPa·s、波美度为 15、pH值为 8.5的硅溶胶。许可荧[13]等以有机硅单体生产中回收的单质硅粉为原料,制备了浓度在30%(未浓缩)以上的硅溶胶,拓宽了单质硅水解法原料的来源,有利于资源回收利用,降低经济成本。 自Bird在1941年发明离子交换法,硅溶胶藉此实现了大规模的工业化生产及应用。20世纪 80年代末报道了吴大天[14]、吴本梅[15]等人对离子交换工艺的相关工艺进行了研究,包括原料选择、脱钠工艺、树脂再生工艺和溶胶的浓缩工艺等。此后鲜见此工艺的研究报道。离子交换法的基本制备工艺如图5所示[16]。 图5 离子交换法制备硅溶胶工艺Fig.5 The preparing method of silica sol by ionic exchange 直接酸中和法的制备工艺与离子交换法相类似,使用阳离子交换树脂脱除稀释水玻璃中的 Na+离子,再加热制备晶核,然后将稀释水玻璃及酸化剂加入到上述晶核溶胶中,控制适当的反应条件使晶核长大,制备出所需规格的硅溶胶。 电解渗析法是采用电化学方法,通过在配备合适电极(如析氢电极、氧阴极)的电解电渗析槽中反应进行硅溶胶制备的一种方法[16]。刘红梅[17]研究了电解电渗析法工艺中,温度、电流密度和pH值等反应条件对胶粒增长速率的影响,推导出各影响因素与胶粒粒径增长速率之间的关系式,为硅溶胶的电化学生产提供了理论依据。针对能源短缺的现状,刘红梅、衣宝廉[18]又研究了制备过程中的槽电压、电流、功耗和电极种类等影响因素,节约了16%左右电能。 胶溶法同样采用水玻璃为原料,但在制备工艺上与以上方法俱不相同。胶溶法先将水玻璃加酸凝胶化与溶液脱离,然后与溶解液混合置于高压釜中使凝胶重新溶解即制得硅溶胶产品。 与其它制备方法相比,采取分散法制备的硅溶胶具有纯度高、颗粒均匀、黏度小、分散性好等优点。李辉[19]等以沉降法表征硅溶胶的稳定性,研究了浓度、pH值及温度对分散法硅溶胶稳定性的影响。研究表明,当pH=5时,溶胶浓度对分散法硅溶胶稳定性影响不大,在碱性环境(pH=8.5)及部分酸性环境(pH=2~4)下较为稳定。另外溶胶稳定性随温度的升高而降低。 硅溶胶粒子表面被大量硅氧醇基、羟基包覆,界面原子吉布斯能大于内部原子,易发生偶联反应,所以硅溶胶处于亚稳状态,放置过程中会逐渐发生胶凝作用。杨丽静等[20]利用NMR和TEM研究了碱性硅溶胶粒子的Si-O键和胶凝过程。研究发现,硅溶胶粒子内部为—Si—O—Si—键,表面为—SiOH键和—Si(OH)2所覆盖。其胶凝过程可分为两个阶段,首先硅酸离子聚合为多硅酸离子,当聚合作用达到某一突变值的时候,多硅酸组成的粒子相互联结,在整个溶胶体系迅速形成三围网状结构,将全部溶胶包含在内使之失去流动性成为凝胶。后一阶段反应迅速,因而硅溶胶的胶凝时间主要取决于第一阶段。 虽然溶胶在热力学上为不稳定系统,但是通过合理调配SiO2粒径、体系pH值和表面活性剂等因素可增大胶粒间的相斥位能,使溶胶体系处于动力学稳定状态。 由硅溶胶的胶团结构式可知,胶团由胶粒及周围的扩散层构成,由于表面携带相同的电荷而彼此排斥不聚沉。胶体化学中的DLVO理论表明,两带电球形胶粒之间的相斥位能为 其中:ε—溶剂的介电常数; a—溶胶球形粒子半径; φ0—粒子表面电位,受溶胶体系的pH值及表面活性剂影响; k—电解质影响系数,受表面活性剂及溶胶中电解质的影响; H0—两球表面间距离,受溶胶浓度的影响。 相斥位能表达式表明,溶胶粒子间的相斥位能随φ0和a的增大而增大,随H0的增大而指数降低。 许念强[21]等对质量分数为25%的不同粒径酸性硅溶胶稳定性进行了研究。结果表明,2 与酸性硅溶胶不同,当pH值较低时,碱性硅溶胶的胶凝时间随pH值的升高而缓慢延长,但当pH值达到某一特定值后,胶凝时间显著延长,稳定性急剧上升[20]。 杨丽静[8]等应用小角X光散射研究了pH值对硅溶胶胶凝过程分形特征的影响,研究表明酸性硅溶胶和碱性硅溶胶均对Porod定律形成负偏离,属于非理想两相体系。前者的胶凝过程为1种结构的表面分形,聚集过程为反应控制的集团-集团聚集,而后者为2种不同结构的表面分形,簇团聚集过程为反应控制的集团-集团聚集,初级粒子的形成则由扩散控制转为反应控制。 许念强[23]等研究了SiO2粒子粒径对酸性硅溶胶稳定性、粘度的影响,研究发现,酸性硅溶胶的稳定性及粘度均随着SiO2粒径的增大而明显改善,当粒径在10~20 nm时,溶胶的胶凝时间随粒径增大呈现线性增长的趋势。 SiO2粒子粒径的增大会显著降低比表面积,表面活性基团的数目相应减少,表面吉布斯能也随之降低,同时降低了粒子表面离子吸附能力,进一步导致表面电位发生变化,这是稳定性随粒径增大而升高的原因。 田立朋与王力[24]通过减压蒸馏法制备了高浓度碱性硅溶胶,并考察了十二烷基苯磺酸钠、十二烷基磺酸钠、十二烷基硫酸钠、甘氨酸、聚丙烯酸钠共五种表面活性剂对硅溶胶稳定性的影响,探讨了其作用机理。研究发现,十二烷基磺酸盐可以有效避免高浓度产品过快凝胶。 电解质对硅溶胶的稳定性也有一定的影响。许念强[23]研究发现,当硅溶胶中 NaCl浓度大于 0.02 mmol/L时,胶凝时间随着NaCl浓度的增加呈现线性降低的趋势。但同时也指出,只有SiO2粒径较低时,硅溶胶的稳定性受电解质浓度的影响才会较为显著,当其粒径增大到20 nm时,即使NaCl浓度高达0.1 mol/L,硅溶胶的稳定性也降低不到15%。 杨丽静[20]等研究发现,同等条件下由盐酸制备的碱性硅溶胶其稳定性明显优于硫酸,但随着温度上升,这种差异逐渐减小。杨靖[25]通过研究发现,在相同H+条件下,不同种类的酸对溶胶粘度的影响顺序为HF>HCl>HNO3>H2SO4>HAC,对凝胶时间的影响顺序为HAC>H2SO4>HCl >HNO3>HF。 目前,我国催化裂化催化对焦炭和汽油的选择性尚有较大提升空间。而硅基粘结剂的催化剂具有较强的焦炭选择性及抗磨损能力。因此,加强对硅基粘结剂的研究具有重要意义。 硅溶胶用作FCC催化剂粘结剂时,要加强在提高硅溶胶稳定性的同时,又能使FCC催化剂的具有很好的抗磨损强度方面的研究。此外,要对影响硅溶胶稳定性的各项因素进行深入研究,探索其影响机理。 [1]田华,陈连喜,刘全文. 硅溶胶的性质、制备和应用[J]. 国外建材科技, 2007(2): 8-11, 17. [2]杨丽静,田辉平,严加松. 硅溶胶系列FCC催化剂制备技术研究[J].工业催化, 2006(7): 18-22. [3]匡跃平,何农跃,施其宏,等. 添加硅溶胶对超稳 Y沸石水热稳定性的影响[J]. 湘潭大学自然科学学报, 1994(1): 105-108. [4]朱超,乔晨生,王秋莹,等. 富硅超稳八面沸石研究──组成与结构参数及稳定性的关系[J]. 兰州大学学报, 1995(4): 127-132. [5]何农跃,施其宏,张信,等. 超稳Y沸石FSY水热稳定性改进研究[J]. 石油化工, 1995(3): 180-182. [6]臧高山,潘惠芳. 外加硅对REHY分子筛及其催化剂性能的影响[J].石油炼制与化工, 1998(2): 49-52. [7]高永灿,潘惠芳. 催化裂化催化剂抗重金属镍污染技术的进展[J].石油化工, 1998(4): 71-75. [8]杨丽静,田辉平,龙军,等. 硅溶胶胶凝过程的分形特征[J]. 石油学报(石油加工), 2010(6): 841-845. [9]殷馨,戴媛静. 硅溶胶的性质、制法及应用[J]. 化学推进剂与高分子材料, 2005(6): 35-40. [10]陈姚,任之君,杨淑敏,等. 单质硅溶解法制备电子级硅溶胶的影响因素研究[J]. 广州大学学报(自然科学版), 2011(5): 28-32. [11]郑典模,屈海宁,马纯超. 改良单质硅水解法制备硅溶胶的工艺研究[J]. 硅酸盐通报, 2010(4): 824-828. [12]田华,陈连喜,刘全文. 单质硅溶解法制备硅溶胶的研究[J]. 辽宁化工, 2007(8): 509-510. [13]许可萤,严云,胡志华. 回收超细硅粉制备高浓度硅溶胶的研究[J]. 非金属矿, 2011(4): 19-22. [14]吴大天,刘立成,陈泽民. 离子交换法制备硅溶胶的研究[J]. 无机盐工业, 1989(3): 28-30. [15]吴本梅,沈金浩,陈泽民. 离子交换法制备硅溶胶新工艺[J]. 离子交换与吸附, 1988(3): 207-211. [16]唐永良. 硅溶胶制备方法评述[J]. 浙江化工, 2003(5): 7-9. [17]刘红梅,衣宝廉. 电解电渗析法制备硅溶胶[J]. 化工学报, 1996(3):340-345. [18]刘红梅,衣宝廉. 氧阴极用于电解电渗析法制备硅溶胶研究[J]. 电化学, 1996(4): 73-77. [19]李辉,郭玉忠,王剑华,等. 分散法硅溶胶的稳定性研究[J]. 广西轻工业, 2007(10): 23-26. [20]杨丽静,田辉平,龙军,等. 碱性硅溶胶稳定性的研究[J]. 石油炼制与化工, 2010(6): 12-16. [21]许念强,顾建祥,罗康,等. 高浓度酸性硅溶胶的制备技术[J]. 化工进展, 2003(5): 512-515. [22]芦贻春,李再耕. pH值对硅溶胶凝胶化过程的影响[J]. 耐火材料,1995(6): 326-328. [23]许念强,顾建祥,罗康,等. 二氧化硅粒径对酸性硅溶胶稳定性的影响[J]. 华东理工大学学报, 2003(6): 642-645. [24]田立朋,王力. 高浓度碱性硅溶胶的减压蒸馏法制备研究[Z]. 山东东营: 2007. [25]瑢杨靖,陈杰 ,刘春晓. 二氧化硅溶胶的制备及性能影响研究[J].辽宁化工, 2007(4): 217-220.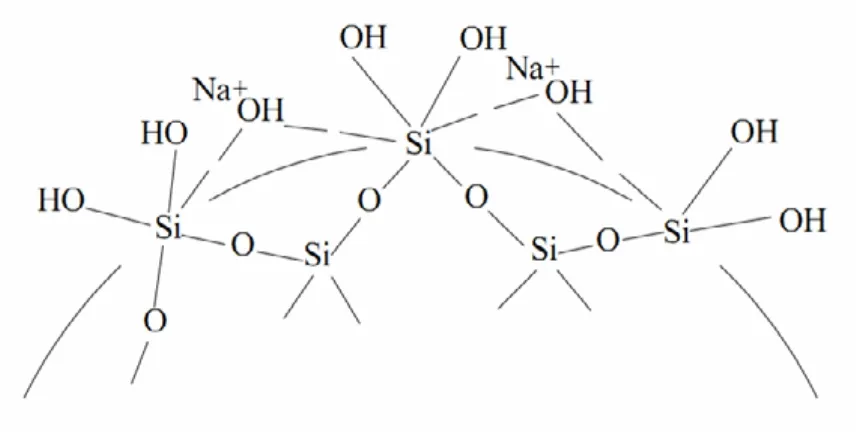
2 硅溶胶的制备
2.1 单质溶解法


2.2 离子交换法
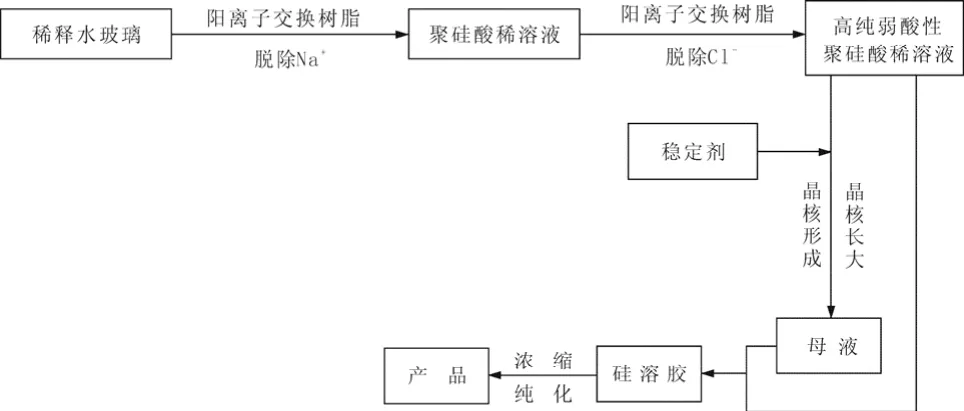
2.3 直接酸中和法
2.4 电解渗析法
2.5 胶溶法
2.6 分散法
3 稳定性影响因素

3.1 pH 值
3. 2 粒 径
3.3 助 剂
3.4 其他影响因素
4 结束语
