纯化工艺对乙肝宁复方中氨基酸影响
2013-07-25李仲秋李欢欢夏新华
李仲秋, 邹 龙, 刘 辉, 李欢欢, 夏新华
(湖南中医药大学药学院,湖南长沙410208)
在中药制剂制备工艺研究中,如何有效去除非药用部分,充分保留有效成分、同时降低制剂的吸湿性一直是研究的重要内容。醇沉法是运用较广泛的传统精制纯化方法。近年来,一些新材料、新技术已运用于中药水提液的纯化中,其中絮凝澄清法应用较多,该法在保留有效成分、降低吸湿性等方面优于传统醇沉法[1-3],尤其对麻黄碱、芍药苷、绿原酸、黄酮、多糖等成分较醇沉法具有更高保留率[4]。
关于壳聚糖絮凝澄清法和醇沉工艺优劣比较的研究较多[5-6],但尚未见有关两者对中药中游离氨基酸量影响的报道。乙肝宁复方是由黄芪、茵陈、白芍等十三味中药组成的治疗慢性迁延性肝炎的临床有效验方,具有健脾化湿、滋肾养肝、活血化瘀等作用。黄芪系方中君药,对于黄芪甲苷、芍药苷、川楝素等有效成分的测定方法已有相关报道[7-9],而对无效成分氨基酸未见相关研究。本课题以乙肝宁复方为模型药物,早期研究表明:壳聚糖絮凝澄清法较醇沉法可更好降低乙肝宁浸膏的吸湿性[3]。本实验旨在研究从乙肝宁复方水提液中分离得到的氨基酸的吸湿性强弱,以及上述两种工艺纯化乙肝宁复方水提液后3种氨基酸量变化,阐述在絮凝澄清法降低中药浸膏吸湿性中氨基酸的作用,为壳聚糖絮凝澄清工艺用于中药水提液的精制纯化提供依据。
1 仪器、材料和试药
1.1 仪器 Agilent 1200型高效液相色谱仪,配置G1329A自动控温进样器、Agilent 1200可调波长紫外检测器、HT-230A柱温箱、Agilent 1200工作站(Agilent公司);AR1140电子分析天平 (奥豪斯国际贸易有限公司);TD5A-WS台式低速离心机(湖南湘仪实验仪器开发有限公司);PHS-25实验室pH计 (上海理达仪器厂);DF101S集热式恒温加热磁力搅拌器 (巩义予华仪器有限责任公司);XW-80A微型旋涡混合仪 (上海沪西分析仪器厂有限公司)。
1.2 材料和试药 乙肝宁各味药材均购自安徽惠隆中药饮片有限公司,经鉴定符合《中国药典》2010年版一部规定;茚三酮 (上海山浦化工有限公司);氨水 (重庆川东化工有限公司);732号阳离子交换树脂 (国药集团化学试剂有限公司);活性炭 (天津市科密欧化学试剂有限公司);精氨酸、脯氨酸、赖氨酸 (Br,Amresco公司);异硫氰酸苯酯 (PITC)(上海金山亭新化工试);三乙胺 (湖南汇虹试剂有限公司);冰醋酸 (汕头市西陇化工有限公司);乙酸钠 (西安化学试剂厂);乙腈 (色谱纯);水为重蒸馏水,其余试剂均为分析纯。
2 方法与结果
2.1 乙肝宁复方总游离氨基酸的吸湿性考察
2.1.1 乙肝宁水提液的制备 参照2010版《中国药典》 “乙肝宁颗粒”处方比例称取214 g生药(除黄芪)[10],加10倍量水浸泡30 min,回流提取2 h,过滤,滤渣加8倍量水回流提取2 h,过滤,合并滤液,浓缩,备用。
2.1.2 总游离氨基酸的分离纯化 将上述乙肝宁复方水提液浓缩至一定体积,调pH值至2.50,上732号阳离子交换树脂柱,直至茚三酮反应为阴性,静置吸附2 h。蒸馏水洗涤,直至糖检测 (α-萘酚浓硫酸Molish反应)为阴性,pH值为中性。2%氨水溶液洗脱,收集茚三酮反应为阳性部分的洗脱液,减压浓缩,上颗粒活性炭柱,吸附一定时间后,用蒸馏水洗脱,收集茚三酮反应为阳性反应的洗脱液,浓缩,真空干燥,即得。
2.1.3 吸湿百分率的测定 配制氯化钠过饱和溶液,置于玻璃干燥器中,放入25℃的恒温培养箱内24 h,使其相对湿度达75%。取经上述方法分离纯化后的氨基酸分离物干浸膏和未经任何处理的原浸膏供试品适量,研细,分别置P2O5干燥器内干至恒定质量。精密称定已恒定质量的称量瓶,并放入厚约2 mm的供试品粉末,精密称定后置于上述玻璃干燥器内,25℃保存,定时称量,计算吸湿百分率,以吸湿百分率 (%)为纵坐标,时间(h)为横坐标作图。结果表明,氨基酸分离物吸湿性远远高于乙肝宁复方原浸膏,具有较强吸湿性(见图1),可能对乙肝宁浸膏吸湿性有影响。
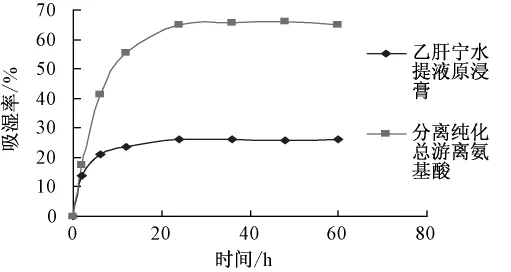
图1 乙肝宁复方总游离氨基酸及原浸膏吸湿曲线Fig.1 Moisture absorption curves of total free-amino acids in Yiganning compound prescription and untreated Yiganning aqueous extract
2.2 两种纯化方法对乙肝宁复方水提液中3种吸湿性氨基酸影响的考察
2.2.1 乙肝宁水提液的制备及其纯化处理
(1)乙肝宁水提液的制备 按2.1.1项下方法制备乙肝宁复方水提液,浓缩至1∶1.5(生药-药液),备用。
(2)乙肝宁水提液的醇沉处理 取上述乙肝宁水提浓缩液250 mL,稀释至1∶2,加乙醇使含醇量为70%,4℃静置过夜,抽滤,浓缩至100 mL,备用。
(3)乙肝宁水提液的絮凝澄清处理 取上述乙肝宁水提浓缩液250 mL,稀释至1∶6,调pH值至6.00,恒温至60℃,1300 r/min搅拌速度下缓慢加入1%壳聚糖溶液250 mL,继续搅拌10 min,静置过夜,离心并抽滤,浓缩至100 mL,备用。
2.2.2 乙肝宁水提液及其纯化样品液中2种氨基酸的测定
色谱条件 HypersilBDSC18色谱柱(4.6 mm×250 mm,5 μm);流动相 A为乙腈-水(4∶1),流动相B为0.1 mol/L醋酸钠缓冲溶液(pH6.5)-乙腈 (97∶3),梯度洗脱 (见表1);检测波长为254 nm;体积流量为1 mL/min;柱温32 ℃;进样量5 μL。
氨基酸混合对照品溶液的制备 取精氨酸(Arg)、脯氨酸 (Pro)、赖氨酸 (Lys)各约0.1 g,精密称定,分别置于10 mL量瓶中,重蒸水稀释至刻度,摇匀,备用。精密量取上述精氨酸对照品溶液与脯氨酸对照品溶液各0.7mL、赖氨酸对照品溶液1 mL,置于25 mL量瓶中,重蒸水稀释至刻度,摇匀,即得。

表1 流动相梯度洗脱程序Tab.1 Gradient elution program of mobile phase
样品溶液的预处理 取上述经两种纯化方法处理的乙肝宁样品溶液,各调pH值至2.50,分别上732号阳离子交换柱,静态吸附2 h,蒸馏水洗涤至无糖 (α-萘酚浓硫酸Molish反应为阴性),2%氨水洗脱,收集茚三酮反应为阳性部分,浓缩,真空干燥至恒定质量,研细,备用。另取250 mL乙肝宁水提液,浓缩至100 mL,同法进行预处理。
柱前衍生化供试品溶液的制备 精密称取上述预处理所得不同干膏粉各适量,分别置于10 mL量瓶中,重蒸水稀释至刻度,摇匀。精密量取1.4 mL,置于5 mL量瓶中,重蒸水稀释至刻度,摇匀。精密量取稀释后溶液2 mL,置于10 mL PEG管中,加入1 mol/L三乙胺乙腈溶液和0.1 mol/L异硫氰酸苯酯乙腈溶液各1 mL,涡旋1 min,暗反应1 h,加入4 mL正己烷萃取,涡漩1 min,静置10 min,吸取下层溶液,过滤,即得。
柱前衍生化的对照品溶液与空白对照液的制备精密量取氨基酸混合对照品溶液适量,置于5 mL量瓶中,重蒸馏水稀释至刻度,摇匀。精密量取稀释液2 mL,照上述“柱前衍生化供试品溶液的制备”方法进行处理,作为对照品溶液。另精密量取重蒸馏水2 mL,同法进行处理,作为空白对照液。
系统适用性试验 精密量取经衍生化反应后的混合对照品溶液、乙肝宁水提液供试品溶液及空白对照溶液各5 μL,按上述色谱条件进行测定。结果表明,3种氨基酸色谱峰分离良好,且空白对照未见干扰 (见图2)。
线性关系考察 分别精密量取氨基酸混合对照品溶液5、4、2、1、0.5、0.25 mL于5 mL量瓶中,按上述“柱前衍生化供试品溶液的制备”方法进行处理,每次进样5 μL,记录峰面积。以峰面积为纵坐标,对照品进样量为横坐标,绘制标准曲线,并进行线性回归,结果见表2。
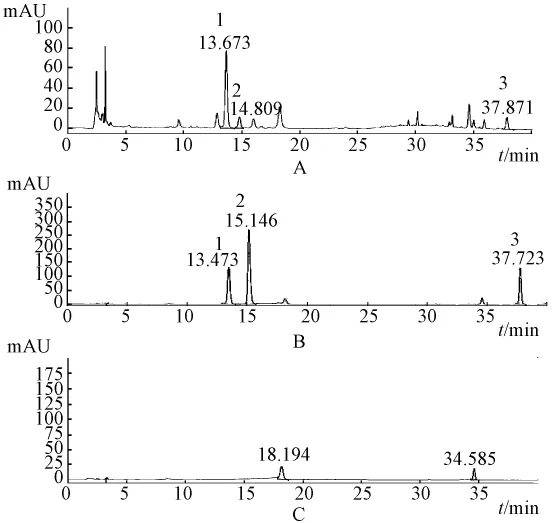
图2 精氨酸、脯氨酸、赖氨酸的HPLC图谱Fig.2 HPLC chromatograms of Arg,Pro,Lys
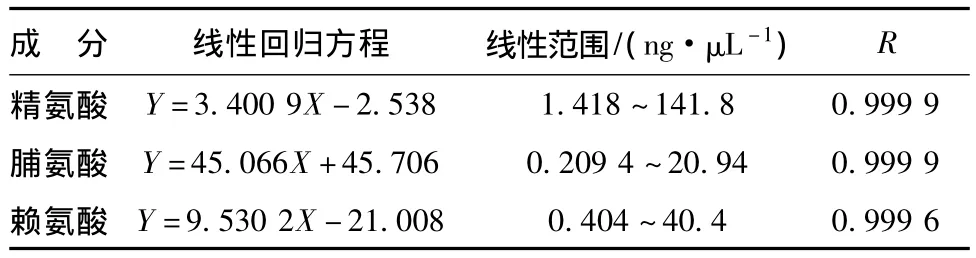
表2 3种氨基酸的线性关系Tab.2 Linear relationgship of three kinds of amino acids
精密度试验 精密吸取同一柱前衍生化供试品溶液5 μL,重复进样6次,结果Arg、Pro、Lys峰面积的RSD分别为0.68%、1.06%、2.50%。
稳定性试验 精密吸取同一柱前衍生化供试品溶液 5 μL,分别于 0、2.5、5、10、15、24 h进样,测定峰面积,计算 Arg、Pro、Lys峰面积的RSD分别为2.65%、1.92%、2.88%,表明供试品溶液在24 h内具有良好的稳定性。
重复性试验 取上述乙肝宁水提液预处理所得干膏粉约0.08 g,共6份,精密称定,依法测定3种氨基酸的量,计算Arg、Pro、Lys的RSD分别为2.87%、3.00%、2.68%。
加样回收试验 取已知含量的乙肝宁复方水提液预处理所得干膏粉适量,共6份,精密称定,分别精密加入精氨酸对照品溶液 (0.3546 mg/mL)1 mL,脯氨酸对照品溶液 (5.236 μg/mL),赖氨酸对照品溶液 (0.03535 mg/mL)各0.5 mL,定容至5 mL,按上述“柱前衍生化供试品溶液的制备”方法进行处理,依法测定,计算回收率,结果Arg、Pro、Lys的平均回收率分别为96.93%、97.99%、106.01%,RSD分别为1.79%、1.86%、2.52%。
样品的测定 取乙肝宁水提液及其两种纯化溶液经预处理后所得干膏粉适量,依法测定其精氨酸、脯氨酸、赖氨酸的量,并计算纯化过程3种氨基酸的保留率,结果见表3~4。
表3 不同干膏样品中3种氨基酸测定 (n=4,±s)Tab.3 Content of three kinds of amino acids in different dry extract samples(n=4,±s)
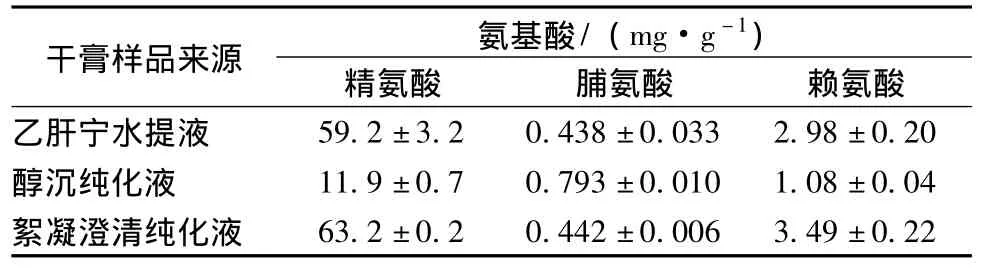
表3 不同干膏样品中3种氨基酸测定 (n=4,±s)Tab.3 Content of three kinds of amino acids in different dry extract samples(n=4,±s)
)干膏样品来源 氨基酸/(mg·g-1精氨酸 脯氨酸 赖氨酸乙肝宁水提液59.2±3.2 0.438±0.033 2.98±0.20醇沉纯化液 11.9±0.7 0.793±0.010 1.08±0.04絮凝澄清纯化液63.2±0.2 0.442±0.006 3.49±0.22
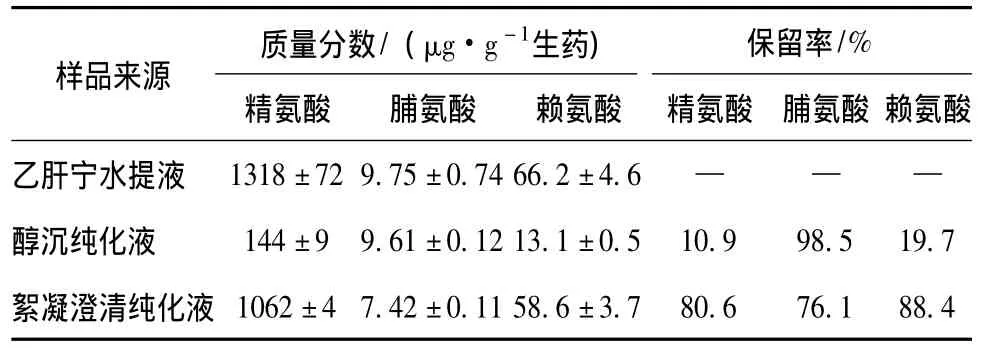
表4 不同药液样品中3种氨基酸量及其保留率Tab.4 Content and retention rates of three kinds of amino acids in different liquid medicine samples
3 小结和讨论
目前,测定中药材中氨基酸的方法主要有氨基酸自动分析仪测定法、蒸发光散射-高效液相色谱法 (ELSD-HPLC)、柱前衍生高效液相法等[11]。氨基酸自动分析仪、ELSD-HPLC均具有操作简单、分析时间短等优点,但前者价格昂贵,而后者灵敏度低,作者在预实验中曾尝试此法,较难测定样品中游离氨基酸的量,故选用灵敏度高的柱前衍生高效液相法。PITC柱前衍生法采用常规C18柱、UV检测器就可检测一、二级氨基酸,且产物稳定,因而本实验选用PITC作为衍生化试剂。
在色谱条件摸索中,对柱温和进样量进行考察,结果发现,两者对分离效果影响较大。当柱温过高或过低时,分离度均会降低,这可能是氨基酸性质相似,在一定温度范围内,它们洗脱速度接近,难分开;当进样量10 μL时,精氨酸、赖氨酸前沿峰显著,改为5 μL后,峰形得到显著改善,分析原因可能是进样溶液中含有约50%的乙腈,与初始流动相溶剂体系存在较大差距,进样体积越大影响越大,引起前沿峰。
20种常见氨基酸中只有精氨酸、脯氨酸、赖氨酸有吸湿性,且后两者吸湿性强于糖类。因此,本实验以上述3种氨基酸为指标,比较了两种纯化方法对乙肝宁复方水提液中氨基酸的影响。结果表明,壳聚糖絮凝澄清法对乙肝宁复方水提液中精氨酸、赖氨酸的保留明显优于醇沉法;而对于脯氨酸的保留,虽不如醇沉法,但仍有较高的保留率。此现象可能是由于精氨酸和赖氨酸的水溶性强 (极性大)、醇溶性小,而脯氨酸属一种非极性氨基酸,具有相对大的醇溶性所致。这与前期研究结果(壳聚糖絮凝澄清法对中药水提液中极性大的水溶性成分的保留优于醇沉法,而对低极性的亲脂性成分的保留则不如醇沉法)一致[3]。另外,由于3种氨基酸pKa较高,在弱酸性的中药水提液中大部分以阳离子形式存在,而根据壳聚糖絮凝澄清法原理[12],壳聚糖本身带有正电荷,同性相斥,故壳聚糖絮凝澄清法对水提液中的氨基酸的保留总体较高。据此,可认为壳聚糖絮凝澄清法相对于醇沉法可降低中药浸膏的吸湿性,不是通过影响氨基酸量的途径来实现的。李静对乙肝宁复方中糖类吸湿性进行了研究,发现糖类是影响乙肝宁吸湿性的重要因素之一,说明吸湿性降低机制可能与保留吸湿性弱的多糖相关[13]。
[1]侯向明,王桂英.吸附澄清剂在中药制剂中的应用[J].天津药学,2005,17(2):67-69.
[2]英锡相,田福珍,李绍维,等.心安胶囊工艺改进及山楂叶总黄酮含量的测定[J].辽宁中医杂志,2001,28(2):113.
[3]楚笑辉,唐路梅,夏新华.壳聚糖絮凝澄清工艺与醇沉工艺纯化乙肝宁复方水提液的对比[J].中国实验方剂学杂志,2011,17(21):1-4.
[4]李锋涛,潘金火.絮凝剂在中药制剂中的应用[J].时珍国医国药,2006,17(4):647-649.
[5]金 岩,张 字.壳聚糖用于五苓滴丸澄清工艺的考察[J].实用药物与临床,2010,13(3):341-343.
[6]孙运从,林桂涛.壳聚糖絮凝沉降法与乙醇沉淀法对炙甘草汤的纯化效果的比较[J].中成药,2011,33(1):173-175.
[7]曹湘萍,梁建宁,何晓艳,等.HPLC—ELSD法测定乙肝宁颗粒中黄芪甲苷含量[J].中成药,2005,27(2):165-167.
[8]李 丹,姜家书,付 彬.高效液相色谱法测定乙肝宁颗粒中芍药苷含量[J].河南中医,2010,30(5):450-451.
[9]张秋蓉,周 浓,杨 敏.HPLC测定乙肝宁颗粒中川楝素[J].中国实验方剂学杂志,2010,16(10):78-79.
[10]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:403-404.
[11]贾 薇,陈 涛.中药中氨基酸含量测定的研究概况[J].天津药学,2009,21(5):50-52.
[12]朱兴年.壳聚糖在中药提取液中的应用研究[J].时珍国医国药,2002,13(9):557.
[13]李 静.壳聚糖絮凝澄清对乙肝宁中糖类及其吸湿性的影响研究[D].长沙:湖南中医药大学,2012:40.
