太湖新银鱼卵巢发育不同阶段个体生化组成和能量密度研究
2013-07-24刘家寿刘宗娟柳谢松光
吴 朗 刘家寿 张 国 刘宗娟柳 明 谢松光
(1.中国科学院水生生物研究所, 中国科学院水生生物多样性与保护重点实验室, 武汉 430072;2.中国科学院大学, 北京 100049; 3.中国科学院水生生物研究所淮安研究中心, 淮安223002)
太湖新银鱼(Neosalanx taihuensisChen)隶属于胡瓜鱼目(Osmeriformes)、银鱼科(Salangidae), 浮游动物食性, 生命周期一般一年, 是长江中下游及其附属水体重要的小型经济鱼类[1,2]。由于其显著的经济价值, 自20世纪70年代末云南滇池引种获得成功后已被广泛引种到全国 20多个省市的湖泊和水库[3]。太湖新银鱼于1998年引入丹江口水库, 具有春秋两个繁殖群体, 以春群为主[4]。春群个体在 11月之前性腺一般处于Ⅱ期, 而秋群在9月、10月间性腺发育成熟[5,6]。本研究仅选择春群雌性个体进行研究, 将11月之前卵巢处于Ⅲ期及以上个体确定为秋群个体。
繁殖周期与机体物质和能量的储存-利用周期密切相关[7—8]。在卵巢发育过程中, 以蛋白质、脂类为主的卵黄不断地在卵细胞中积累, 在卵细胞成熟时能量储备达到峰值[10,11], 外界环境条件适宜(如水温、光照等)时产卵繁殖[12—15]。鱼类的性腺发育和繁殖的能量来源主要有3种模式: (1)由身体其他组织或器官中储存物质转化或转移而来, 这一类物种一般被称为保守主义者(Conservative species); (2)通过短期内大量的摄食直接为性腺发育提供能量, 这一类物种一般被称为机会主义者(Opportunistic species); (3)来源于其他组织或器官中储存能量的转移和外界摄食, 即前两者的综合[16—18]。本研究对丹江口水库太湖新银鱼雌鱼处于不同性腺发育阶段个体的性体指数、鱼体生化组成和能值进行比较研究,探讨个体在繁殖周期中的能量分配规律, 为了解其繁殖策略提供基础资料。
1 材料与方法
1.1 样品采集
2008年8月至2009年5月每月中旬在丹江口水库采集太湖新银鱼。样品用抬网(网目: 2 mm)通过灯光诱捕采集[3—5]。样品采集后立即带回室内处理。
1.2 样品处理与生物学测定
每尾鱼测量标准长(SL)、体重(BW), 并根据外部副性征初步鉴定性别(如外部难鉴别, 则通过解剖性腺确定)。对雌性个体解剖后, 肉眼观察性腺发育状况, 并结合卵巢组织学切片确定性腺发育时期。取出性腺, 称取性腺重量(GW)、去性腺体重(SW)和去内脏体重(BW′)。性体指数(GSI)按以下公式计算:

根据性腺分期将样品鱼分为5组(分别对应性腺Ⅱ期、Ⅲ期、Ⅳ期、Ⅴ期、Ⅵ期个体), Ⅱ期个体仅对全鱼测定生化组成和能值, Ⅲ期至Ⅵ期每组个体随机分为两份, 分别用于测定全鱼和去性腺鱼体中的生化组成和能量密度(单位重量鱼体的能值, 又称比能值)。样品测定前密封保存于−20℃冰箱中。
1.3 生化组成和能量密度测定
样品在高压蒸汽灭菌器(ES-315, TOMY KOGYO CO., Japan)120℃蒸30min, 捣烂充分混匀后置于70℃恒温烘箱中烘干至恒重, 采用失重法计算干物质含量; 将烘干的鱼样粉碎、磨细、混匀后, 装入密封袋保存于−20℃冰箱中待测。采用凯氏定氮法(2300 Kjeltec Analyzer Unit, FOSS TECATOR, Sweden)测定粗蛋白含量, 索氏抽提法(Soxtec system HT 1043,Tecator, Extraction Unit, Hoganas, Sweden)测定粗脂肪含量, 灰分采用马福炉(中国湖北英山县建力电炉制造厂)550℃焚烧法测定, 能值采用 Phillipson 微量能量计(Phillipson microbomb calorimeter, Gentry Instruments Inc., Aiken, South Carolina, U.S.A.)测定。每组样品重复测定至少3次, 以相对偏差低于2%的3个测定值的平均值为测定结果。采用以下公式计算各期全鱼总能值(E0)、去性腺鱼体能值(E1)以及性腺能值(E2):

公式中ED0代表全鱼能量密度,ED1代表去性腺鱼体能量密度。
1.4 数据处理
采用单因素方差分析(ANOVA)检验卵巢不同发育阶段个体标准长、体重、去性腺体重、性体指数、鱼体生化组成和能量密度差异显著性。当差异显著时, 再采用 Tukey’s HSD多重比较方法对平均数进行比较。结果中各变量采用平均数±SD表示, 显著水平为P< 0.05。统计分析采用STATISTIC 6.0进行。
2 结果
2.1 性腺发育
8—11月间卵巢均处于Ⅱ期, 12月份处于Ⅲ期,此后均为成熟卵巢(Ⅳ或Ⅴ期)或产后卵巢(图1)。卵巢发育的Ⅱ期和Ⅲ期, 太湖新银鱼体长和体重均显著增加, Ⅲ期以后, 则增幅不大。GSI随卵巢发育而增大, 最高达34.87; 产卵后GSI显著下降(表1)。
2.2 各期鱼体生化组成和能量密度
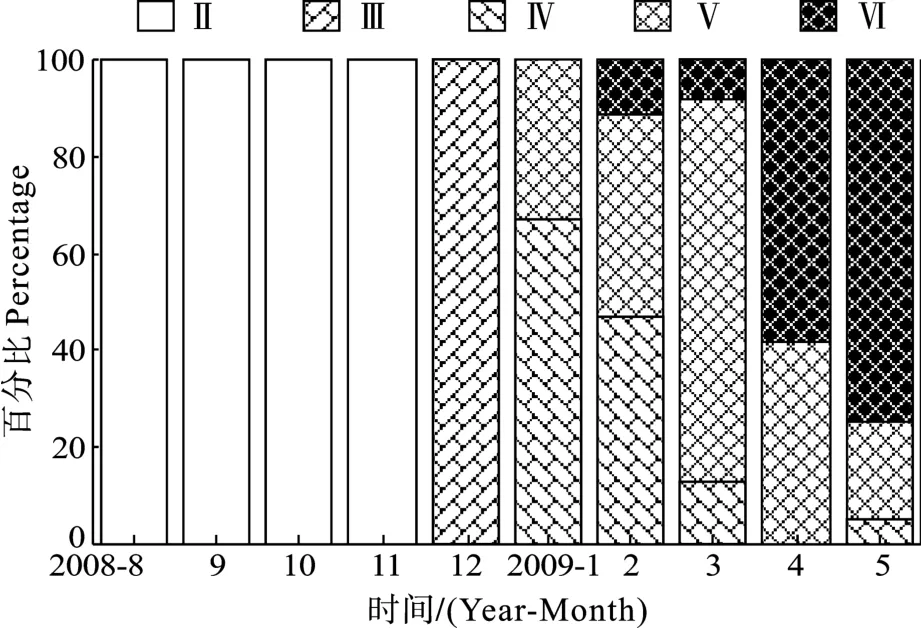
图1 丹江口水库2008年8月至2009年5月间太湖新银鱼卵巢不同发育阶段个体百分比Fig.1 Percentage of N.taihuensis at different ovarian maturity stages from August 2008 to May 2009
全鱼干物质含量为体重的11.19%—13.30%, Ⅱ期个体干物质含量最低, Ⅵ期个体最高, Ⅲ、Ⅳ和Ⅴ期个体差异不显著(表 2)。粗蛋白含量为体重的9.57%—10.90%, Ⅱ期个体粗蛋白含量最低,Ⅵ期个体最高, Ⅲ期个体显著高于Ⅳ、Ⅴ期个体(表2)。粗脂肪含量为体重的0.18%—0.63%, 随卵巢发育而显著增加, 繁殖后则急剧下降(表 2)。灰分含量为1.72%—2.17%, Ⅳ期前, 随卵巢发育而显著增加,Ⅳ期后则迅速下降(P< 0.05)。能量密度为 2.22—2.79 kJ/g体重, 其含量变化趋势与粗脂肪一致(P<0.05)。
干物质、粗蛋白和灰分含量分别为去性腺体重的 11.42%—13.27%、9.81%—11.01%和 1.72%—2.23%。三者都随卵巢发育而显著增加(P< 0.05)。粗脂肪含量为去性腺体重的0.27%—0.40%, Ⅲ期和Ⅳ期个体粗脂肪含量显著高于Ⅴ期和Ⅵ期个体(P<0.05)。去性腺鱼体的能量密度为 2.45—2.58 kJ/g,Ⅳ、Ⅴ期、Ⅵ期个体的能量密度显著高于Ⅲ期个体(表 3)。

表1 太湖新银鱼样本数量(N)、标准长(SL)、体重(BW)、去性腺体重(SW)和性体指数(GSI)Tab.1 Number of specimens (N), standard length (SL), body weight (BW), body weight without ovaries (SW) and the gonadosomatic index(GSI) of N.taihuensis

表2 太湖新银鱼卵巢不同发育阶段个体全鱼中的生化组成和能量密度(湿重)Tab.2 Chemical compositions and energy densities of whole fish (based on wet mass) of N.taihuensis at different ovarian maturity stages

表3 太湖新银鱼卵巢不同发育阶段个体去性腺鱼体中的生化组成和能量密度(湿重)Tab.3 Chemical compositions and energy densities of fish body without ovaries (based on wet mass) of N.taihuensis at different ovarian maturity stages
2.3 鱼体和性腺中物质和能量变化
全鱼中的总能量、粗蛋白和粗脂肪绝对含量随性腺发育的变化趋势基本一致: Ⅲ期个体发育到Ⅳ期个体时, 三者均明显增加, 其中总能量和粗蛋白绝对含量主要在去性腺鱼体中增加, 而性腺中增加不明显; 粗脂肪含量的增加主要在性腺中。由Ⅳ期发育到Ⅴ期时, 全鱼中的总能量、粗蛋白和粗脂肪绝对含量均略有增加, 其中去性腺鱼体中能量、粗蛋白和粗脂肪绝对含量均明显减少, 性腺中则明显增加。产后Ⅵ期个体全鱼中的总能量、粗蛋白和粗脂肪绝对含量均急剧降低, 其中能量和粗蛋白含量与Ⅲ期个体相近, 脂肪含量明显低于Ⅲ期个体(图2)。
3 讨论
GSI月变化及卵巢组织学切片分析表明, 丹江口水库太湖新银鱼春群繁殖时间主要为 1—4月,其中 2—3月为繁殖高峰期, 这和长江中下游其他水体中的太湖新银鱼春群繁殖时间是基本一致的[4]。在卵巢发育不同阶段, 太湖新银鱼雌鱼的生化组成和能量发生显著变化。卵巢发育成熟前, 全鱼和去性腺鱼体中的干物质、粗蛋白、粗脂肪、灰分含量和能量均显著增高, 但性腺中物质和能量的增加较少; 性腺由Ⅳ期发育为Ⅴ期时, 全鱼物质和能量增加不明显, 性腺中物质和能量含量明显增加, 而去性腺鱼体物质和能量含量明显减少。这些结果初步表明性腺成熟前鱼体机体物质和能量的积累是性腺发育成熟的主要物质和能量来源[19,20]。因此, 从能量来源模式看,太湖新银鱼繁殖可能以保守主义策略为主[17]。
产卵后, 太湖新银鱼全鱼中粗蛋白、粗脂肪绝对量以及总能量都急剧下降, 去性腺鱼体中粗蛋白绝对量以及能量也都大大减少, 这些说明太湖新银鱼在繁殖过程中需要消耗大量的能量。繁殖过程中能量的大量消耗可能是导致太湖新银鱼亲本繁殖后即迅速死亡的原因。这一现象与一些鲑鳟鱼类繁殖时大量的物质和能量消耗导致的产后死亡现象一致[12]。

图2 太湖新银鱼卵巢不同发育阶段个体去性腺鱼体和卵巢中的能量、粗蛋白和粗脂肪绝对含量Fig.2 Absolute mass of energy, protein and lipids in fish body with and without ovaries at different ovarian maturity stages
卵巢由Ⅱ期发育到Ⅲ期发生在12月之前, 期间丹江口水库水温较高, 食物丰富[21]。龚世园等[22]对长江中游富水水库太湖新银鱼的研究发现, 这段时期太湖新银鱼的摄食强度较大。性腺发育成熟阶段(Ⅴ期), 全鱼总能量、粗蛋白和粗脂肪绝对含量均增加较少, 全鱼的生化组成变化也不明显, 表明这一阶段个体通过摄食积累的能量有限。但Ⅴ期个体性腺中的能量、粗蛋白和粗脂肪绝对含量均明显较Ⅳ期个体增加, 而去性腺鱼体中的能量、粗蛋白和粗脂肪绝对含量均明显较Ⅳ期个体减少, 说明在这一阶段卵巢发育的物质和能量可能主要来源于鱼体的物质和能量积累。黎雨轩[23]通过比较刀鲚未成熟个体和成熟个体不同组织中的生化组成和比能值发现,肌肉、肝胰脏和肠系膜当中储存的脂肪是刀鲚生殖洄游和性腺发育重要的能量来源。李川等[11]也发现,瓯江彩鲤卵巢发育需要的大量脂肪也可能主要来源于肝胰脏。在本研究中由于银鱼个体规格较小, 操作较困难, 并未对去性腺鱼体中各个组织中生化组成和能量密度分别测量和分析, 有待今后进一步研究。
[1] Ni Y, Zhu C D.Fishes of the Taihu Lake [M].Shanghai:Shanghai Scientific & Technical Publishers.2005, 217— 221[倪勇, 朱成德.太湖鱼类志.上海:上海科学技术出版社.2005, 217—221]
[2] Wang X L, Xiang J G, Liu J S,et al.The influences to transplantation of icefish (NeosalanxtaihuensisChen) on earlylife feeding and growth ofHemiculterleucisculusbasilewsky.Acta Hydrobiologica Sinica, 2012, 36(2): 276—283 [王星璐,向建国, 刘家寿, 等.太湖新银鱼移植对早期摄食和生长的影响.水生生物学报, 2012, 36(2): 276—283]
[3] Hu C L, Chen W X, Liu J S.Situation and strategy research of icefish transplant in China [J].Reservoir Fisheries, 1998,(2): 3—7 [胡传林, 陈文祥, 刘家寿.我国银鱼移植增殖现状及对策分析.水利渔业, 1998, (2): 3—7]
[4] Wu L, Liu J S, Wang X L,et al.Identification of indi born in different spawning seasons using otolith microstructure to reveal life history ofNeosalanx taihuensis[J].Fisheries Sciences, 2011, 77(3): 321—327
[5] Gong W B, Li H T, Xie S Q,et al.Two spawning stocks of icefishNeosalanx taihuensisrevealed from annual reproductive cycle analysis [J].Fisheries Sciences, 2009, 75(5):1157—1165
[6] Gong W B, Wu L, Cheng F,et al.A comparative study on reproductive characteristics of the spring and autumn spawning stocks ofNeosalanx taihuensisChen in the Three Gorges Reservoir [J].Acta Hydrobiology Sinica, 2010, 34(5):1065—1068 [龚望宝, 吴朗, 程飞, 等.三峡水库太湖新银鱼春季和秋季繁殖群体的繁殖生物学特征比较.水生生物学报, 2010, 34(5): 1065—1068]
[7] Otero J, González A F, Sieiro M P,et al.Reproductive cycle and energy allocation ofOctopus vulgarisin Galician waters,NE Atlantic [J].Fisheries Research,2007, 85(1-2): 122—129
[8] Raymond J, Himmelman J H, Guderley H E.Biochemical content, energy composition and reproductive effort in the broadcasting sea starAsterias vulgarisover the spawning period [J].Journal of Experimental Marine Biology and Ecology, 2007, 341(1): 32—44
[9] Joaquim S, Matias D, Matias M,et al.Reproductive activity and biochemical composition of the pullet carpet shellVenerupis senegalensis(Gmelin, 1791) (Mollusca: Bivalvia)from Ria de Aveiro (northwestern coast of Portugal) [J].Scientia Marina,2011, 75(2): 217—226
[10] Rodríguez-González H, Hernández-Llamas A, Villarreal H,et al.Gonadal development and biochemical composition of female crayfishCherax quadricarinatus(Decapoda:Parastacidae) in relation to the Gonadosomatic Index at first maturation [J].Aquaculture,2006, 254(1—4): 637—645
[11] Ojea J, Pazos A J, Martínez D,et al.Seasonal variation in weight and biochemical composition of the tissues ofRuditapes decussatusin relation to the gametogenic cycle [J].Aquaculture,2004, 238(1—4): 451—468
[12] Yin M C.Fish Ecology [M].Beijing: Agricultural Publishers of China.1995, 111—112 [殷名称.鱼类生态学.北京: 中国农业出版社.1995, 111—112 ]
[13] Ren J S, Marsden I D, Ross A H,et al.Seasonal variation in the reproductive activity and biochemical composition of the Pacific oyster (Crassostrea gigas) from the Marlborough Sounds, New Zealand [J].New Zealand Journal of Marine and Freshwater Research,2003, 37(1): 171—182
[14] Dridi S, Romdhane M S, Elcafsi M.Seasonal variation in weight and biochemical composition of the Pacific oyster,Crassostrea gigasin relation to the gametogenic cycle and environmental conditions of the Bizert lagoon [J].Aquaculture,2007, 263(1—4): 238—248
[15] Dima J B, Vido N A, Leal G A,et al.Fluctuations in the biochemical composition of the Patagonian stone crabPlatyxanthus patagonicusA.Milne Edwards, 1879 (Platyxanthidae: Brachyura) throughout its reproductive cycle [J].Scientia Marina,2009, 73(3): 423—430
[16] Bayne B L.Aspects of reproduction in bivalve molluscs [A].In: Wiley M L (Eds.), Estuarine Processes [C].New York:Academic Press.1976, 432—448
[17] Liu W G, Li Q, Shirasu K,et al.Reproductive cycle and biochemical composition of the Zhe oysterCrassostrea plicatulaGmelin in an eastern coastal bay of China [J].Aquaculture,2006, 261(2): 752—759
[18] Najmudeen T M.Variation in biochemical composition during gonad maturation of the tropical abaloneHaliotis variaLinnaeus 1758 (Vetigastropoda: Haliotidae) [J].Marine Biology Research, 2007, 3(6): 454—461
[19] Castille F L, Lawrence A L.Relationship between maturation and biochemical composition of the gonads and digestive glands of the shrimpsPenaeus aztecusIves andPenaeus setiferus(L.) [J].Journal of Crustacean Biology, 1989, 9(2):202—211
[20] Li Q, Yang L, Ke Q Z,et al.Gametogenic cycle and biochemical composition of the clam Mactra chinensis (Mollusca: Bivalvia): Implications for aquaculture and wild stock management.[J].Marine Biology Research, 2011, 7(4):407—415
[21] Han D J, Peng J H, Jian D,et al.The assessment of food organism resources and trophic states of Danjiangkou Reservoir [J].Journal of Lake Sciences, 1997, 9(1): 57—62 [韩德举, 彭建华, 简东, 等.丹江口水库的饵料生物资源及水体营养状态评价.湖泊科学, 1997, 9(1): 57—62]
[22] Gong S Y, Wu M S, Jin D X,et al.Primary study on feeding habits ofNeosalanxtaihuensisin Fushui Reservoir [J].Reservoir Fisheries, 1999, 19(3): 7—9 [龚世园, 吴敏生, 金顶玄, 等.富水水库太湖新银鱼食性的初步研究.水利渔业.1999, 19(3): 7—9]
[23] Li Y X.Reproductive Ecology of AnadromousCoilia ectenesin the Yangtze River [D].Thesis for Doctor of Science.Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan.2009 [黎雨轩.长江洄游性刀鲚的繁殖生态学研究.博士学位论文, 中国科学院水生生物研究所, 武汉.2009]
