牙鲆IGF-IR基因5′调控区的克隆及功能初步分析
2013-07-24张俊玲施志仪陈晓武王晓竹
张俊玲 施志仪 程 琦 陈晓武 王晓竹
(上海海洋大学农业部淡水水产种质资源重点实验室, 上海 201306)
胰岛素样生长因子-I 受体(Insulin-like growth factor-I receptor, IGF-IR)是一种跨膜的酪氨酸激酶受体蛋白, 是IGF-I生物功能的关键调节因子之一。当配体IGF-I与其结合时激活酪氨酸激酶活性, 从而引起大多数细胞的促有丝分裂和抑制凋亡效应, 在细胞的正常生长和分化中起至关重要的作用。在生物体内,IGF-IR基因的表达受到多层次的调控, 其中以转录水平的调控为主。人IGF-IR基因的启动子是一个不含TATA框和CAAT框、高GC含量、“initiator” 型的启动子。P53、SP1、KLF16、c-Jun、ER-α和WT1等均是人IGF-IR基因5′调控区已鉴定的转录因子[1—4]。但是在低等生物包括鱼类中,IGF-IR基因的5′调控区序列及启动子特征很少有报道。
越来越多的研究表明, IGF-I通过与其受体IGF-IR结合在鱼类生长、发育、代谢、繁殖、渗透压调节及免疫等众多生理过程中发挥重要作用[5—7]。牙鲆(Paralichthys olivaceus)是我国重要的海水养殖鱼类之一, 也是变态发育、繁殖及内分泌生理研究较为集中的鱼类物种。我们先前的研究分析了IGF-I及IGF-IR在牙鲆发育生长过程中的时空表达及其与甲状腺激素(Thyroid hormone, TH)的作用关系[8,9], 因而在此基础上, 本研究克隆了牙鲆IGF-IR基因的 5′调控区序列, 并预测了其潜在的转录因子结合位点, 初步检测了该序列的启动子活性, 为深入研究鱼类IGF-IR基因的转录水平调控及探讨TH对其基因表达的调节提供基础资料。
1 材料与方法
1.1 实验材料与试剂
牙鲆成鱼购自上海市铜川路水产品市场, 解剖取其肌肉组织, 无菌水冲洗干净后立即用于基因组 DNA 的提取。DNA 提取试剂盒购自 Beyotime 公司, 胶回收试剂盒、质粒小提取试剂盒、无内毒素质粒大提取试剂盒、Lipofect Transfection Reagent、感受态细胞 DH5α、X-gal、IPTG、DNA Marker购自Tiangen 公司; pAcGFP1-1 载体购自 Clontech 公司; Genome Walking Kit、LATaq酶、限制性内切酶SalI、EcoR I、pMD18-T 载体、T4 DNA Ligase购自Takara 公司。LB培养基、抗生素购自上海生工生物工程技术公司, DMEM 培养基购自 GIBCO 公司, 0.25%胰酶-EDTA购自 Invitrogen 公司, 小牛血清购自杭州四季青公司, 293细胞购自中科院细胞库。
1.2 实验方法
基因组DNA 的提取 取约25 mg 的牙鲆肌肉组织, 剪切成尽可能小的碎片, 然后按照基因组 DNA小量抽提试剂盒说明书操作步骤提取基因组 DNA, 经紫外分光光度计和琼脂糖凝胶电泳检测其完整性, 并计算其浓度和纯度。
5′调控区的扩增 根据已知的牙鲆IGF-IRcDNA(GI: 18150107)5′UTR 序列设计三条特异性引物, GSP1:5′-CCTGGTGGTAACAACTGAGAATA-3′, GSP2: 5′-AGC AGCCTCCACAGAACAT-3′, GSP3: 5′-AATGGCGAGGA AGGGTGG-3′。接头引物 AP1、AP2、AP3、AP4 由 Genome Walking Kit 提供。
采用基于热不对称PCR的染色体步移技术扩增5′调控区序列。取适量基因组 DNA作为模板, 以接头引物AP(四种中的任意一种, 本研究经预实验选用的是 AP1)作为上游引物, 分别以IGF-IRGSP1、GSP2 和GSP3 作为下游引物, 进行三轮 PCR, 具体操作按照 Takara 公司的Genome Walking Kit说明书进行。扩增产物经过1%的琼脂糖凝胶电泳, 回收目的片段经过纯化、连接pMD18-T载体、转化 DH5α。蓝白斑筛选, 挑取阳性克隆, 经过菌落 PCR验证确实有大小正确的插入片段后进行测序, 测序由上海生工生物工程技术公司完成。
5′调控区的生物信息学分析 利用 3种基因启动子在线分析软件(http://www.cbs.dtu.dk/services/promoter/)、(http://www.fruitfly.org/seq_tools/promoter.html) 和 (http://bimas.dcrt.nih.gov/mol bio/proscan/) 预测启动子区域结构特征, 利用 TFSEARCH程序(http://www.cbrc.jp/research/db/TFSEARCH.html) 对转录因子数据库 TRANSFAC(http://transfac.gbf.de/TRANSFAC/)进行搜索, 寻找可能的转录因子结合位点。
重组报告基因表达载体pAcGFP1-IR的构建 根据 pAcGFP1-1 载体多克隆位点设计引物, 通过 PCR 扩增在牙鲆IGF-IR基因 5′调控序列两端加上酶切位点。IR913EcoR I : 5′-GCGGAATTC ACAGACAGAGGGAC-3′,IR913Sal I: 5′-CGCGTCGAC AATGGCGAGGAAG-3′, 其中下划线为引物中引入的酶切位点SalI和EcoR I, 斜体为保护碱基。
扩增产物首先经过纯化、连接 pMD18-T 载体、转化DH5α, 蓝白斑筛选、挑取阳性克隆、抽提质粒DNA。采用SalI、EcoR I 进行37℃ 双酶切鉴定, 确定是否包含IGF-IR基因 5′ 调控区片段及载体序列(大小分别为 913 bp 和 2.6 kb)。将鉴定正确的 PCR产物、启动子缺失的pAcGFP1-1 载体分别进行双酶切, 37℃过夜, 酶切产物回收后经T4 DNA Ligase 16℃连接过夜。连接产物转化DH5α, 37℃平板培养, 挑取阳性克隆, 双酶切验证重组载体。然后送上海生工生物工程技术公司测序验证。
pAcGFP1-IR的瞬时转染 将经鉴定正确的pAcGFP1-IR 重组质粒转化大肠杆菌DH5α, 培养200 mL菌液, 使用无内毒素质粒大提试剂盒提取不含内毒素的pAcGFP1-IR 重组质粒, 抽提步骤按照 TIANGEN 公司的无内毒素质粒大提试剂盒说明书进行, 用于细胞转染。
293 细胞置于37℃, 5% CO2的培养箱中常规培养。转染前一天, 胰酶消化细胞并计数, 取2×105细胞铺板在0.5 mL含血清、不含抗生素的正常生长的培养基中, 使其在转染时细胞密度为90%—95%。使用24孔板进行转染实验, 操作步骤按照 Tiangen 公司的 Lipofect Transfection Reagent说明书进行。分别在转染24h、48h后在倒置荧光显微镜下观察绿色荧光蛋白报告基因的瞬时表达情况并拍照。
2 结果
2.1 牙鲆 IGF-IR基因5′调控区的克隆
以牙鲆基因组DNA 为模板, 分别以IGF-IR基因的GSP1、GSP2、GSP3和AP1 为引物, 经过三轮 PCR扩增得到一段 936 bp的IGF-IR5′ 调控区序列(图 1)。
2.2 牙鲆 IGF-IR基因 5′调控区的序列分析
对克隆得到的牙鲆IGF-IR5′ 调控区序列进行生物信息学分析发现, 该序列有潜在的启动子区。如图2所示, 将评分为1.00的潜在启动子区起始子“A”规定为转录起始位点 TSS, 它位于翻译起始密码子 ATG上游的−637位, 该启动子既有典型的 TATA 框, 又含有“initiator”序列, 但无CCAAT框; 评分为0.98的潜在启动子区位于规定TSS上游的−589位, 无TATA和CCAAT框。搜索TRANSFAC 数据库, 找到93处最佳相互匹配的转录因子结合位点, 其中AP1、AP2、C/EBP、p300、E2F、多个 Sp1及c-Myb、Brn2、Oct-1、ER、GR、PR、MyoD和SRY等是诱导牙鲆IGF-IR基因转录的潜在作用因子。
2.3 牙鲆IGF-IR 5′调控序列的启动子活性检测
采用脂质体介导的转染方法, 将构建成功的pAcGFP1-IR转染293细胞, 倒置显微镜下观察细胞状态,可见细胞状态良好, 未见成片细胞脱落死亡。pAcGFP1-IR重组质粒转染细胞 24h后, 在倒置荧光显微镜下即可观察到绿色荧光信号(图3A), 48h后可观察到绿色荧光信号增强(图3B)。阳性对照采用转染pEGFP-N1质粒(图3C),阴性对照为转染启动子缺失的 pAcGFP1-1载体, 无绿色荧光表达(图3 D)。
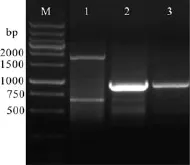
图1 牙鲆 IGF-IR 基因 5′ 调控区序列克隆Fig.1 5′ regulatory sequence cloning of IGF-IR gene from Japanese flounder by the technique of genome walking
3 讨论
本研究采用了一种基于热不对称 PCR的染色体步移技术获得牙鲆IGF-IR基因的5′调控区[10], 它可根据已知基因的 5′UTR序列设计三条同向且退火温度较高的特异性引物即 GSP1、GSP2和GSP3, 与试剂盒提供的四种经过独特设计的退火温度较低的兼并引物即AP1、AP2、AP3和AP4进行热不对称PCR反应, 通过三次巢式PCR即可获取已知序列的侧翼序列, 与以往传统方法相比, 具有高效、简便、特异性高等优点。为此, 本研究成功获得了一段936 bp大小的牙鲆IGF-IR基因5′调控区序列。经生物信息学分析发现, 获得的牙鲆IGF-IR基因5′调控区有2处潜在的转录起始位点, 其中位于翻译起始密码子ATG上游的−637位的区域评分较高, 且含有“initiator”序列, 无 CCAAT 框, 与人和小鼠IGF-IR基因的“initiator” 型启动子较相似[11—13], 不同的是除“initiator” 序列外,该区域还含有传统的 TATA框, 属含有TATA框和Inr的启动子, 这样TBP本身能结合于启动子的TATA框, 也可同TFDⅡ中的 TAF Ⅱ亚基一起结合。此外, 预测的第二处潜在转录起始位点前后序列与哺乳动物差异较大。本研究通过与绿色荧光蛋白报告基因表达载体重组, 脂质体介导瞬时转染 293细胞, 初步表明该序列具有启动子的活性。
转录因子结合位点预测发现, 牙鲆IGF-IR基因5′调控区不仅含有E2F、C/EBP、p300、AP2等潜在的转录因子, 还有较多的Sp1可能结合位点, 这与在人和小鼠中是相一致的[11—13]。转录因子 Sp1能和GC盒相结合, 在SC40启动子中有多个GC盒,它们均能和Sp1相结合, 然而含有GC盒的不同的DNA顺序与 Sp1的亲和力却各不相同。体外瞬时转染实验也表明Sp1能激活IGF-IR基因的表达[14]。重要的是, 本研究发现牙鲆IGF-IR基因5′调控区分布有ER、GR、PR、MyoD、Oct-1、c-Myb、Brn2、SRY等潜在的转录因子结合位点, 这些转录因子大多也在人和小鼠IGF-IR基因 5′调控区存在, 提示IGF-IR基因的转录调节元件在哺乳动物和鱼类中是相对保守的。其中ER、GR、PR和TR同属配体依赖型的核受体转录因子家族, 识别的半位点序列类似。有研究发现, 如果将ER和TR转录因子共转染CV1细胞, 当添加TH时会减弱雌激素响应的靶基因转录,且这种抑制效应具有配体依赖性, 使用不同亚型的TR(TRαA、TRαB、TRβ1 和 TRβ2)效应也不同[15]。在大多数组织细胞中, ER、GR、PR和 TR以及 RXR、VDR等核受体转录因子是共表达的, 因而它们之间可以形成“异二聚体”激活特定基因转录; 当某种激素或转录因子水平过高时, 彼此间产生竞争性抑制如ER和TR似乎也是很有可能的。因此, 尽管在克隆的牙鲆IGF- IR基因5′调控序列范围内尚未发现潜在的 TR结合位点(不排除在更上游存在这一位点的可能), 但甲状腺激素仍有可能通过上述核受体转录因子影响IGF-IR基因的表达。

图2 牙鲆IGF-IR 基因5′调控区序列及潜在的转录因子结合位点Fig.2 Sequences and potential transcript binding sites of 5′ regulatory region ofIGF-IR gene from Japanese flounder
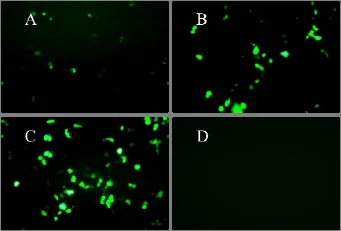
图3 pAcGFP1-IGF-IR在293 细胞中的表达Fig.3 Expression of pAcGFP1-IGF-IR in 293 cells
此外, MyoD 与 Myogenin、Myf5、MRF4 同属bHLH(basic helix-loop-helix)家族, 是专一性的生肌调节因子, 在肌肉发生与分化中起重要作用。研究表明MyoD基因调控区具有TR作用元件, 是甲状腺激素直接响应的基因, TH可通过调节MyoD的表达而调控肌肉的形态发生[16,17]。Oct-1是调控真核细胞生长的重要因子, 一旦Oct-1表达降低将会引起细胞周期停滞, 细胞暂时退出细胞周期并开始形态分化[18]。Dowling,et al.[19]在小鼠中发现当妊娠期内源甲状腺激素尚未分泌之前, T4处理能增加Oct-1 mRNA的表达; 并且从胎儿到成体期, TH均能调节Oct-1的表达。c-Myb起初被鉴定为原癌基因, 在未成熟的造血细胞表达量很高, 当细胞进行分化时其表达明显降低, 是一种调控细胞增殖的重要转录因子[16]。Brn2是调节表皮角质细胞分化的转录因子[20], 还可使皮肤成纤维细胞转化为神经细胞[21]。而SRY则为性别决定基因,它在牙鲆IGF-IR基因调控区的潜在出现提示了IGF-I可能与鱼类性别分化有关。
综上所述, 这些潜在转录因子的发现进一步支持了牙鲆IGF-I及受体基因在细胞周期调控、促进细胞分化与生长中发挥重要作用, 同时还暗示了甲状腺激素很有可能通过调节这些转录因子的表达而影响 IGF-I/IGF-IR系统的生物学功能。
[1] Beitner-Johnson D, Werner H, Roberts C T Jr,et al.Regulation of insulin-like growth factor I receptor gene expression by Sp1: Physical and functional interactions of Sp1 at GC boxes and at a CT element [J].Molecular Endocrinology,1995, 9(9): 1147—1156
[2] Rubinstein M, Idelman G, Plymate S R,et al.Transcriptional activation of the IGF-I receptor gene by the Kruppel-like factor-6 (KLF6) tumor suppressor protein: potential interactions between KLF6 and p53 [J].Endocrinology,2004,145(8): 3769—3777
[3] Idelman G, Glaser T, Roberts Jr C T,et al.WT1-p53 interactions in IGF-I receptor gene regulation [J].Journal Biological Chemistry,2003, 278(5): 3474—3482
[4] Sarfstein R, Belfiore A, Werner H.Identification of insulinlike growth factor-I receptor (IGF-IR) gene promoter-binding proteins in estrogen receptor (ER)-positive and er- depleted breast cancer cells [J].Cancers, 2010, 2(2): 233—261
[5] Wood A W, Duan C, Bern G A.Insulin-like growth factor signaling in fish [J].International Review of Cytology, 2005,243: 215—285
[6] Reinecke M, Björnsson B Th, Dickhoff W W,et al.Growth hormone and insulin-like growth factors in fish: where we are and where to go [J].General and Comparative Endocrinology, 2005, 142(1—2): 20—24
[7] Yada T.Effects of insulin-like growth factor-I on non- specific immune functions in rainbow trout [J].Zoological Science, 2009, 26(5): 338—343
[8] Zhang J L, Shi Z Y, Fu Y S,et al.Gene expression and thyroid hormone regulated transcript of IGF-I during metamorphosis of the flounderParalichthys olivaceus[J].Acta Hydrobiologica Sinica, 2011, 35(2): 355—359 [张俊玲, 施志仪, 付元帅, 等.牙鲆变态中IGF-I基因表达及甲状腺激素对其的调节作用.水生生物学报, 2011, 35(2): 355—359]
[9] Zhang J L, Shi Z Y, Cheng Q,et al.Expression of insulinlike growth factor I receptors at mRNA and protein levels during metamorphosis of Japanese fl ounder (Paralichthys olivaceus) [J].General and Comparative Endocrinology,2011, 173(1): 78—85
[10] Liu Y G, Robert F W.Thermal asymmetric interlaced PCR:automatable a amplification and sequencing of insert end fragment from Pl and YAC clones for chromosome walking[J].Genomics, 1995, 25(3): 674—68l
[11] Werner H, Stannard B, Bach M A,et al.Cloning and characterization of the proximal promoter region of the rat insulin-like growth factor-I (IGF-I) receptor gene [J].Biochemical and Biophysical Research Communications, 1990, 169(3):1021—1027
[12] Mamula P W, Goldfine I D.Cloning and characterization of the human insulin-like growth factor-I receptor gene 5′-flanking region [J].DNA Cell Biology, 1992, 11(1): 43—50
[13] Cooke D W, Bankert L A, Roberts CT Jr,et al.Analysis of the human type I insulin-like growth factor receptor I promoter region [J].Biochemical and Biophysical Research Communications, 1991, 177(3): 1113—1120
[14] Werner H, Bach M A, Stannard B,et al.Structural and functional analysis of the insulin-like growth factor I receptor gene promoter [J].Molecular Endocrinology, 1992, 6(10):1545—1558
[15] Zhu Y S, Paul M Y, William W,et al.Estrogen and Thyroid Hormone Interaction on Regulation of Gene Expression [J].Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(22): 12587—12592
[16] Muscat G E, Downes M, Dowhan D H.Regulation of vertebrate muscle differentiation by thyroid hormone: the role of themyoDgene family [J].Bioessays, 1995, 17(3): 211—218
[17] Muscat G E, Mynett-Johnson Lesley, Dowhan Dennis.Activation ofmyoDgene transcription by 3,5,3′-triiodo-L-thyronine: a direct role for the thyroid hormone and retinoid X receptors [J].Nucleic Acids Research, 1994, 22(4): 583—591
[18] Lakin N D, Palmer R, Lillycrop K A,et al.Down regulation of the octamer binding protein Oct-1 during growth arrest and differentiation of a neuronal cell line [J].Molecular Brain Research, 1995, 28(1): 47—54
[19] Dowling A L, Martz G U, Leonard J L,et al.Acute changes in maternal thyroid hormone induce rapid and transient changes in gene expression in fetal rat brain [J].Journal Neuroscience, 2000, 20(6): 2255—2265
[20] Shi G, Sohn K C, Choi D K,et al.Brn2 is a transcription factor regulating keratinocyte differentiation with a possible role in the pathogenesis of lichen planus [J].PLoS One, 2010,5(10): e13216
[21] Vierbuchen T, Ostermeier A, Pang Z P,et al.Direct conversion of fibroblasts to functional neurons by defined factors[J].Nature, 2010, 463(7284): 1035—1042
