洞头岛养殖区浮游植物群落特征研究
2013-07-24楼哲丰关万春
楼哲丰 孙 敏 关万春 张 鹏
(1.温州医学院生命科学学院海洋科学系, 温州 325035; 2.浙江省海洋水产养殖研究所, 温州 325005)
洞头位于温州瓯江口外约61 km的洋面上, 是全国12个海岛县之一, 由 103个岛屿和 259座礁石组成, 有“百岛县”之称。洞头属亚热带海洋性季风气候, 常年平均气温17.4℃。洞头列岛海域是浙江省重要的海洋水产养殖基地, 受江浙沿岸流和瓯江等径流的影响, 营养物质输入丰富。近几年随着洞头列岛海域周边地区经济的快速发展, 工业、农业(含水产养殖)和生活废水排放量不断增加,对洞头列岛海域的生态环境造成了一定的影响[1]。
浮游植物作为海洋主要的初级生产者, 通过生物泵将大气中 CO2沉降到大洋当中, 在全球碳循环过程中起着极其关键的作用, 并减缓温室效应。近岸水体由于受到人类活动的影响较大, 水体中营养盐浓度较高, 常暴发赤潮。如在2003—2005年, 洞头岛海域共发现了6起赤潮,且赤潮维持的时间越来越长, 规模越来越大。具有毒性的藻类引发的赤潮严重影响了该海域的生态环境和水产品质量安全[1]。因此, 本实验针对人为干预导致水体恶化的洞头沿岸典型养殖区进行调查, 观察水体基本参数以及浮游植物群落结构和生物量, 希望通过本项目的研究, 初步掌握洞头岛养殖区水体在6、7、8三个月份浮游植物群落结构的组成和多样性; 同时在观察月份交替过程中, 浮游植物群落演替的规律; 并通过与非养殖区水体的对比, 总结出人为干预对浮游植物多样性和群落结构组成的影响。
目前, 探讨浮游植物多样性和群落结构组成方面的研究, 主要是研究其对水温、营养盐浓度、水体盐度、酸碱度等环境因子的响应[2—4], 而针对洞头岛沿岸水体, 对比养殖区与非养殖区浮游植物生物多样性随月份变化的研究则很少见。因此, 本项目研究的目的不仅是为了掌握浮游植物多样性及其分布情况, 更重要是可以进一步了解营养盐浓度、环境因子对浮游植物群落组成和多样性影响的认识。同时, 浙江省已经被国务院批准为海洋经济发展示范区, 该项目的开展可以进一步深入了解浙江省近岸水体浮游植物群落结构和生物多样性情况, 有利于掌握近岸水环境的变化, 并提出针对性的改良方案, 为降低因浮游植物引起赤潮而带来的经济损失起到至关重要的作用。同时还可以为人类患海洋疾病的程度作出评价, 这将利于浙江省海洋经济示范区的建设和海洋产业的快速发展。
1 材料与方法
1.1 采样点的设定
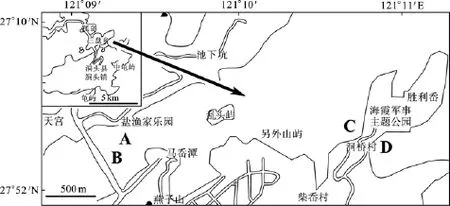
图1 洞头岛海域采样点图Fig.1 Sampling sites in Dongtou Islands Sea Area
洞头岛桐桥村近岸, 设定4个采样点, 即A、B、C、D四区, 采样点选择具有典型特点的区域(图1): A为渔排养殖区(受人类活动干预最显著的区域); B为临近养殖区;C为海藻养殖区(实验期间, 6—8月份, 大型海藻已经收获); D为非养殖区, 与外海相同, 海水交换量较大。
1.2 水样的采集
分别于2011 年6 月、7 月和8月在以上4 个采样点进行表层浮游植物样品的采集。利用1.5 L采水器分别采集距离岸边大约 40—50 m处表层水(水深小于 10 m),水样采集依据《海洋生物生态调查技术规程》所列的实验方法采样[5]。每个采样点采集4000 mL水样, 其中2000 mL加入中性福尔马林固定, 最终浓度为 4%, 用于浮游植物的分析。
1.3 各项检测指标及检测分析方法
带回实验室后, 逐步沉淀浓缩至 20 mL, 取出0.1 mL样品, 利用浮游植物计数框在普通显微镜(Olympus CH30RF200, Japan)下观察、测量细胞大小, 于倒置显微镜(Nikon ECLIPSE TS100, Japan)下计数, 并采用具有自动拍照系统(Nikon E4500, Japan)的荧光显微镜(Nikon E600W, Japan)拍照, 以便鉴定种类; 另外 2000 mL水样添加硫酸酸化保存, 用于检测水体中N、P的浓度。各项营养盐采用分光光度法测定[6,7], 其中铵盐(NH4+-N)采用次溴酸钠氧化法, 硝酸盐(NO3−-N)采用锌镉还原-偶氮比色法, 亚硝酸盐(NO2−-N)用重氮偶氮比色法, 磷酸盐(PO43−-P)用磷钼酸法。溶解无机氮(DIN)浓度为铵盐、硝酸盐和亚硝酸盐浓度值和。
采用YSI(YSI 556 MPS, USA)在原位测定水体温度、盐度、DO、pH。
1.4 数据处理
浮游植物群落的各项生态指数, 如丰富度(D)、优势度(C)、多样性(H′)和均匀度(J′)分别采用以下公式计算[5]:
丰富度D=(S−1)/log2(N)
优势度C=SUM(ni/N)2
多样性H′= SUM (ni/N)log2(ni/N)
均匀度J′=H′/log2S
式中S为浮游植物的物种数,N为所有物种的个体总数,ni为第i种的个体总数。
用同步观测到的水温、盐度, 以及后期在实验室内检测获得营养盐浓度等数据, 应用SPSS软件分析浮游植物细胞丰度与环境因子的相关性。
2 结果
2.1 浮游植物生物量
浮游植物细胞数量, 随月份更替,各区均呈现由6月至8月逐渐减少的趋势(图2)。同一月份内, 养殖区(A和C)细胞密度明显高于非养殖区(B和D)。

图2 各采样点6–8月份浮游植物细胞数曲线图Fig.2 Month variations of cell abundance of phytoplankton
2.2 浮游植物的种类组成
在洞头岛海域的 3个月份样品中, 共鉴定浮游植物72 种, 分别隶属于硅藻门、甲藻门和绿藻门三个门类。硅藻门种类最多, 观察到51 种; 甲藻门种类次之, 有20种; 绿藻门种类最少, 只有1 种(表1)。随着月份的更替,7、8月份浮游植物的种类数明显高于6月份。除8月外,其余两个月份浮游植物种类数皆为养殖区A最低。
洞头岛海域浮游植物种类名录(表2)。硅藻以圆筛藻属(Coscinodiscus)的种类多样性最高, 观察到 5种; 海链藻属(Thalassiosira)次之, 有 3种; 舟形藻属(Navicula)、曲舟藻属(Pleurosigma)、菱形藻属(Nitzschia)、海线藻属(Thalassionema)均为 2种。甲藻中以原甲藻属(Prorocentrum)的种类多样性最高, 有 4 种; 角藻属(Ceratium)次之, 有3种。
2.3 浮游植物的生态指数
在3个调查月份中, 浮游植物物种丰富度、多样性、均匀度及优势度的月份变化都较明显(表3)。不同月份之间丰富度的变化为: 调查期间, A区的丰富度(除 8月份)明显低于其他三区, 各区浮游植物多样性和均匀度从 6月份至8月份都逐渐增大。同一月份中4个采样点之间没有明显的规律。优势度随着月份的更替, 从6月至8月, 4
个区都呈现递减趋势。同一月份内, 养殖区与非养殖区物种优势度、多样性或均匀度都不呈明显的规律。

表1 浮游植物的种类组成Tab.1 Composition of phytoplankton in different investigation months
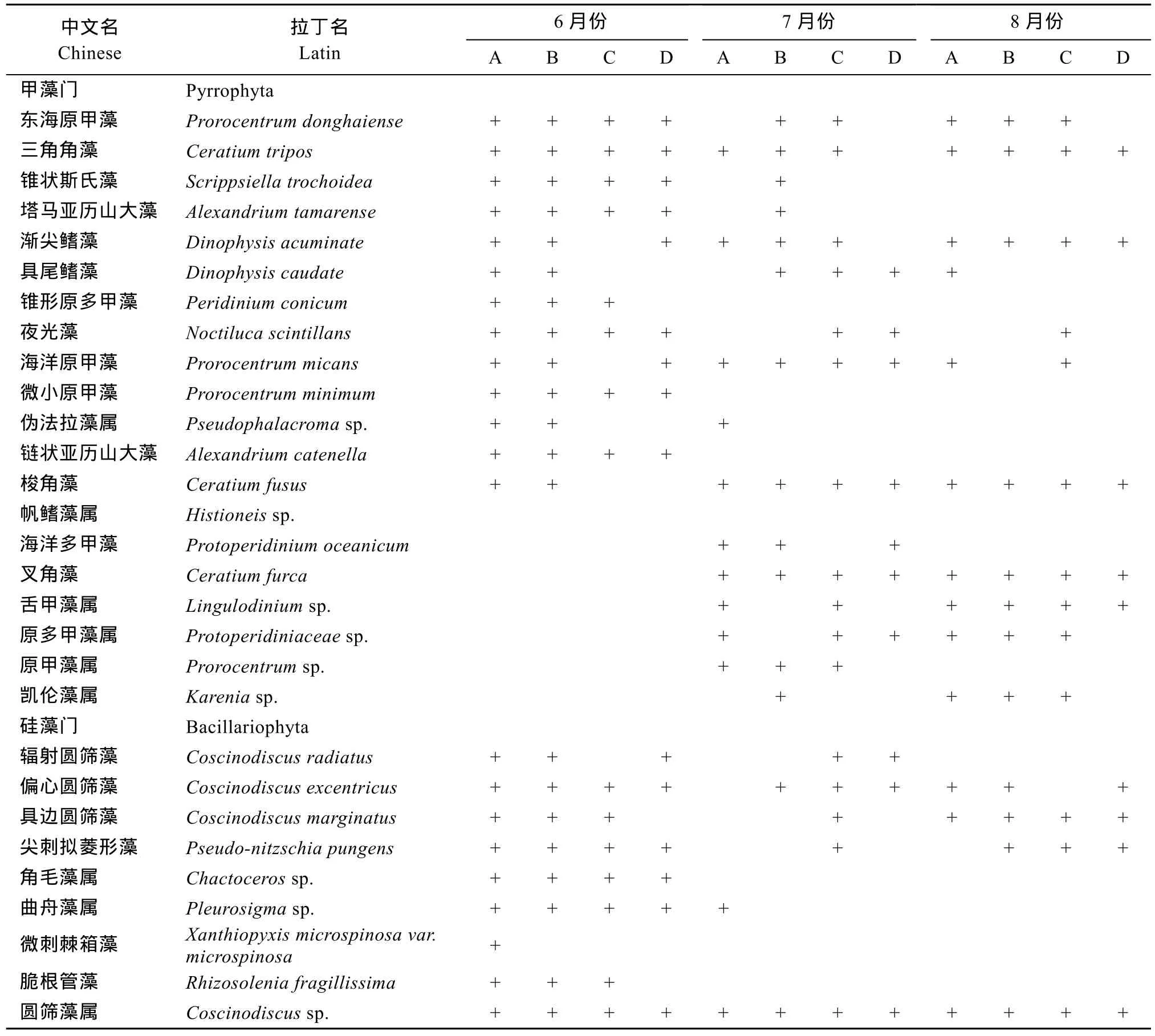
表2 浮游植物种类名录Tab.2 List of phytoplankton species

续表2
2.4 浮游植物的优势种群
各采样点浮游植物优势种类的月份变化明显(表4)。6月份时, 4个采样点的优势种群均为东海原甲藻(P.donghaiense), 且东海原甲藻的优势程度显著, 所占的细胞比例均在80%以上, 易形成东海原甲藻赤潮。在7月份,各区优势种群均为菱形海线藻(T.nitzschioides), 8月份,各区优势种群均中肋骨条藻(S.costatum), 且表现出优势种类多样性, 优势种类在浮游植物总细胞数中所占有比例都在20%以下。从优势种的角度分析, 养殖区与非养殖区没有差异。
2.5 浮游植物与环境因子的关系
在同一采样点内, 除pH外, 其他各项水质参数在不同月份内的波动显著; 而在同一月份内, 营养盐浓度在养殖区与非养殖区波动范围较大, 而水质环境参数波动范围较小 (表5)。6—8月, A、B、C、D各区磷酸盐浓度呈现逐渐升高趋势, 而各区 DIN则为 7月份最低。在月份更替过程中, 非养殖区(D区)DIN浓度和磷酸盐浓度均小于养殖区(A区)(表 5)。水体温度随着月份的更替逐渐升高, 由 6月的 20℃升高为 8月份的 29℃; 同一月份中各区水温差异不大; 盐度和溶解氧没有明显变化规律。利用SPSS 软件进行相关性分析, 显示N/P比值与多样性指数没有明显的相关性(R2<0.6)。
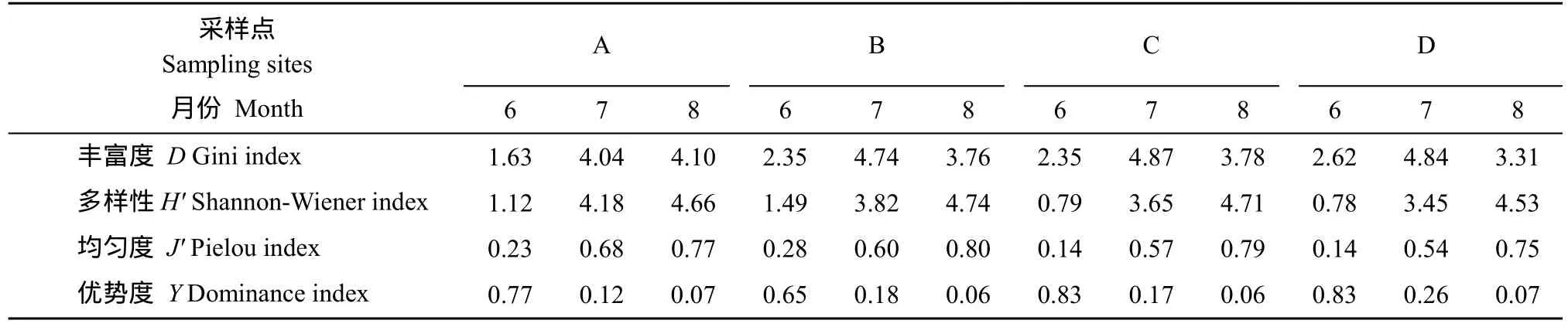
表3 不同月份浮游植物群落的生态指数Tab.3 Community indexes of phytoplankton in different months

表4 各采样点优势种类的细胞丰度及其占有比例Tab.4 List of dominant species and their cell densities, percentage in every sampling sites

表5 各项常规水质参数的月份变化Tab.5 Month variations and average values of chemical parameters
3 讨论
在水体浮游植物群落结构调查过程中发现, 浮游植物群落优势种从6月份的甲藻向7、8月份的硅藻演变, 这一现象无论在养殖区还是非养殖区都存在, 由 6月份绝对优势种类东海原甲藻(P.donghaiense)转变为8月份的中肋骨条藻(S.costatum)。这体现了藻细胞在月份交替过程中对环境因子改变的响应。东海原甲藻的最适水温是19—22℃, 最适盐度为25‰—31‰[8]; 而中肋骨条藻的适宜水温是28.2—28.7℃, 适宜盐度是31.66‰—32.95‰[9]。在本次调查中 6月份的水温刚好满足东海原甲藻的最适生长温度, 而7月份和8月份的水温升高为26—29℃, 满足了中肋骨条藻的最适生长温度。水体中 N/P比值也体现了优势种的演替特征。有研究表明甲藻(三角棘原甲藻)赤潮暴发期间对磷酸盐的需求高于氮盐[9], 本次调查中 6月份东海原甲藻成为优势种期间, 水体中磷酸盐浓度因此而降低; 7月份和8月份, 水体中硅藻(菱形海线藻和中肋骨条藻)成为优势种, 该藻对 N元素需求较高, 导致水体中N元素消耗较快[7,9], 因此, N/P比值高于6月份(表5), 且此时水体中磷酸盐浓度偏高, 不限制硅藻赤潮暴发。虽然实验获得 N/P比值(表 5)远低于 Redfield值(N∶P=16∶1)[9,10], 这可能跟实验的测定方法导致P浓度偏高有关, 但是 DIN和 P的绝对浓度是非常高的(表 5),对浮游植物的生长没有抑制作用, 且实验中测定的 DIN浓度与姚伟民的研究结果相接近[1], 这是因为调查区域为近岸水体, 受到人为干预、生活污水排放和地表径流的影响较为严重, 所以水体不存在营养盐限制的情况。因此,不同种类藻细胞的营养盐利用能力和营养储存能力的差异对藻类种群的生活策略以及种群在群落中的竞争结局都有重要的影响[11—15]。
通过对比 4个采样点水体营养盐浓度可以看出, 同一个月份内, 养殖区(A区)最高, 临近A区的B区营养盐次之, C区营养盐与D区接近, D区最低(表5)。将养殖区与非养殖区进行对比, 3个调查月份中, 无论哪个月份,鱼排养殖区 DIN浓度均高于非养殖区, 磷酸盐浓度均高于非养殖区(除8月份的小于B区); 浮游植物细胞密度养殖区(A、C两区平均值)高于非养殖区(B、D两区平均值)(图 2), 而浮游植物种类数则是养殖区(A区)低于非养殖区的(D区)(表 1)。导致以上结果出现的可能原因是鱼排养殖区受到人为投饵和养殖鱼类排泄物的影响, 水体富营养化程度高于非养殖区, 有利于浮游植物大量繁殖生长。同时, 养殖区水体受到鱼排网箱的影响, 流速较慢,水体交换量明显小于受人为干预小、与外海相接的非养殖区(D 区)。所以, 养殖区水质污染较严重, 从而导致浮游植物种类数下降(表1)。而作为养殖大型海藻的C区, 则不存在这一现象, 且 C区的营养浓度以及各种生态指数与非养殖区B和D较接近。这是因为大型海藻只在冬春两季养殖, 在实验阶段(6—8月份), 大型海藻已经收获,由于之前大型海藻对水体中营养盐的吸收和利用, 降低了C区营养盐浓度。通过以上数据可以证实, 在环境治理工作中, 选用种植大型海藻或高等植物, 吸收营养盐, 达到净化水体, 修复环境的目的是有可能实现的。在养殖方面采用大型海藻养殖以及鱼类网箱养殖交互混养的模式,可改善水体环境, 降低富营养化程度, 同时净化养殖水体, 改善水质, 提高养殖动物的品质。而大型海藻可以利用水产养殖带来的过多营养盐, 加快生长, 提高产量, 增加经济效益。
4 结论
(1)本次调查可以得出, 随着月份的交替、环境因子的变化(如营养盐、温度), 养殖区和非养殖区水体的优势种群都随之发生相同的演替, 由东海原甲藻演变为中肋骨条藻, 多样性和均匀度呈现升高趋势, 而优势度呈下降趋势, 丰富度没有明显规律。
(2)与非养殖区(D 区)进行对比, 人类的养殖行为增加了鱼类养殖区(A区)水体N、P营养盐浓度, 3个月平均N和P浓度分别是非养殖区的2.6倍和1.5倍, 且养殖区浮游植物细胞数量(3个月平均为2.1×105cells/L)大于非养殖区的(3个月平均为 1.8×105cells/L), 但前者的种类数(3个月平均为43种)小于后者(3个月平均为50种)。可见, 鱼类养殖对水体存在负面效应: 增加了富营养化程度, 降低了水体浮游植物种类数。
(3)海藻养殖区(C区)浮游植物物种多样性及生物量没有受到养殖行为的显著影响, 结果与非养殖区(D区)相近。因此, 海藻养殖区可以有效地降低水体营养盐浓度,达到净化水体的目的。
致谢:
感谢方留郁、林立本、刘叶文、许凯伦等同学在水样采集和样品分析方面的帮助。
[1] Yao W M, Zheng A R, Qiu J K.Eutrophication in Dongtou Islands, Zhejiang and the relationships between eutrophication and red tide [J].Marine Environmental Science, 2007,26(5): 466—469 [姚炜民, 郑爱榕, 邱进坤.浙江洞头列岛海域水体富营养化及其与赤潮的关系.海洋环境科学,2007, 26(5): 466—469]
[2] Zuo M, Li D.The variation of phytoplankton community structure in winter and spring in Lake Shahu at Wuhan [J].Acta Hydrobiologica Sinica, 2011, 35(2): 360—364 [左明,李敦.海武汉沙湖冬季和春季浮游植物群落结构的变化.水生生物学报, 2011, 35(2): 360—364]
[3] Wang Y, Lin M, Chen X Q,et al.Annual variation on phytoplankton in coastal waters of western Hainan Island and related affecting factors [J].Acta Hydrobiologica Sinica, 2012,36(4): 724—734 [王雨, 林茂, 陈兴群, 等.海南西部近岸浮游植物的周年变化及主要关联因素.水生生物学报,2012, 36(4): 724—734]
[4] Dai G Y, Li J, Li L,et al.The spatio-temporal pattern of phytoplankton in the north basin of Lake Dianchi and related environmental factors [J].Acta Hydrobiologica Sinica, 2012,36(5): 946—956 [代龚圆, 李杰, 李林, 等.滇池北部湖区浮游植物时空格局及相关环境因子.水生生物学报,2012, 36(5): 946—956]
[5] Liang Y, Ma M H, Wang C Y.The Method of Marine Biology Ecological Research Technology [M].Beijing: Ocean Press.2006, 84 [梁玉, 马明辉, 王长云.海洋生物生态调查技术规程.北京: 海洋出版社.2006, 84]
[6] Grasshoff K, Kremling K, Ehrhardt M.Methods of Seawater Analysis (3rd edition) [M].Weinhein: WILEY-VCH Verlag GmbH.1999, 203—233
[7] Zhang C S, Wang J T, Zhu D D,et al.The preliminary analysis of nutrients in harmful algal blooms in the East China Sea in the spring and summer of 2005 [J].Acta Oceanologica Sinica, 2008, 30(2): 153—159 [张传松, 王江涛, 朱德弟,等.2005年春夏季东海赤潮过程中营养盐作用初探.海洋学报, 2008, 30(2): 153—159]
[8] Zhang X F, Liu Y J.Advances in the biological study of DinoflagellateProrocentrum donghaienseLu [J].Ecologyand Environment, 2007, 16(3): 1053—1057 [张秀芳, 刘永健.东海原甲藻Prorocentrum donghaienseLu 生物学研究进展.生态环境, 2007, 16(3): 1053—1057]
[9] Li Y, Li H, Lü S H,et al.Species diversity and distribution of Phytoplankton in Nanji islands national nature reserve [J].Acta Hydrobiologica Sinica, 2010, 34(3): 618—628 [李扬,李欢, 吕颂辉, 等.南麂列岛海洋自然保护区浮游植物的种类多样性及其生态分布.水生生物学报, 2010, 34(3):618—628]
[10] Wang B D, Chen A P, Liu F.Study on redfield ratios in the world ocean [J].Advances In Science, 2003, 21(2): 232—235 [王保栋, 陈爱萍, 刘峰.海洋中Redfield比值的研究.海洋科学进展, 2003, 21(2): 232—235]
[11] Dortsch Q, Clayton JJR, Thoresen S S.Species differences in accumulation of nitrogen pools in phytoplankton [J].Marine Biology, 1984, 81: 237—250
[12] Kilham P, Hecky R E.Comparative ecology of marine and freshwater phytoplankton [J].Limnology and Oceanography,1988, 33: 776—795
[13] Anderson T, Schartau AKL, Paasche E.Quantifying external and internal nitrogen and phosphorus pools as well as nitrogen and phosphorus supplied through remineralization, in coastal marine plankton by means of a dilution technique [J].Marine Ecological Progress Series, 1991, 69: 67—80
[14] Thompson P A, Oh H M, Rhee G Y.Storage of phosphorus in nitrogen-fixingAnabaena flos-aquae(Cyanophyceae) [J].Journal of Phycology, 1994, 30: 267—273
[15] Lü S H, Li Y.Nutritional storage ability of four harmful algae from the East China Sea [J].The Chinese Journal of Process Engineering, 2006, 6(3): 439—444 [吕颂辉, 李英.我国东海4种赤潮藻的细胞氮磷营养储存能力对比.过程工程学报, 2006, 6(3): 439—444]
