毕赤酵母生孢诱导条件的优化研究
2013-07-23李莲年董秀涛王丽丽张春晓
李莲年,董秀涛,王丽丽,张春晓
(河北科技大学生物科学与工程学院,河北石家庄 050018)
毕赤酵母是单细胞真核微生物,在营养丰富的条件下,能够以单倍体或二倍体出芽的方式进行无性生殖,在营养贫瘠时,二倍体能够以有性生殖方式进行减数分裂,产生单倍体的子囊孢子[1]。尽管毕赤酵母已经成为生产外源蛋白特别是真核生物蛋白的理想宿主[2],然而酵母的经典遗传育种仍然起着极其关键的作用,如基因突变、回交以去除次级突变,基因功能的互补分析等,因此毕赤酵母单倍体的制备尤显重要。本文以毕赤酵母Pichia pastorisX33为研究材料,探讨影响子囊孢子形成的因素。
1 材料与方法
1.1 材料
1.1.1 菌种 巴斯德毕赤酵母(Pichia pastoris)X-33,购于invitrogen公司。
1.1.2 培养基 按以下配方配制,分别于121℃下灭菌20 min。①YPD固体培养基:蛋白胨2%,酵母粉1%,琼脂2%,葡萄糖2%,灭菌后倒平板备用;②乙酸钠诱导生孢培养基[3]:无水乙酸钠0.82%,氯化钾0.186%,复合微量元素溶液母液0.1 mL/100 mL,琼脂2 g/100 mL,pH值自然。微量元素复合液的组成:Na2B4O7·10H2O 0.8 mg,(NH4)6Mo7O24·4H2O 1.9 mg ,KI 10 mg,Fe2(SO4)3·6H2O 22.8 mg,MnCl2·4H2O 3.6 mg,ZnSO4·7H2O 30.8 mg,CuSO4·H2O 3.9 mg,蒸馏水100 mL,加入1 mol/L HCl使之不再浑浊为止;③SM培养基[4]:NaAc 0.5%,KCl 1%,葡萄糖1%,琼脂2%,pH值自然;④其他生孢培养基(A-O):分别配制葡萄糖25%,KCl 15%,NaAc 25%,KAc 25%,NaCl 15%,琼脂4%,复合微量元素母液,自来水。分别灭菌,根据实验需求配制所需离子浓度的生孢固体培养基,具体培养基成分见表1。
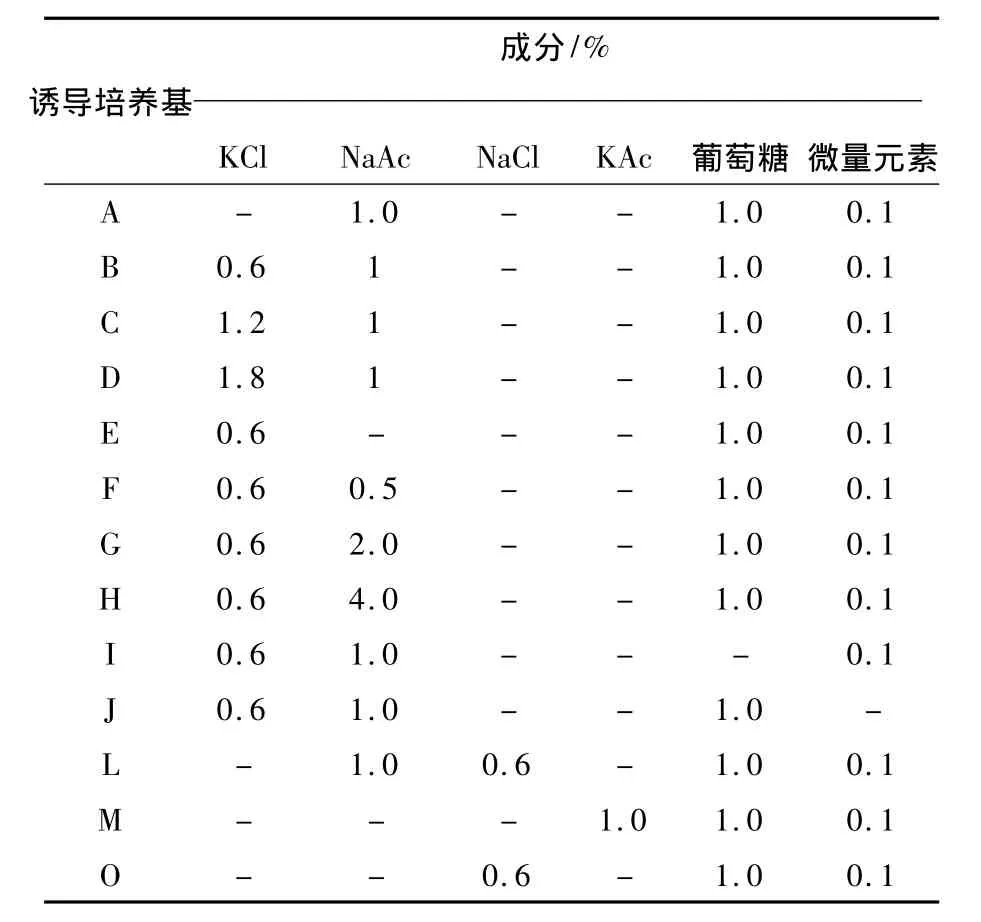
表1 诱导生孢培养基成分表Table1 The sporulation media
1.2 方法
1.2.1 毕赤酵母的活化 将毕赤酵母菌种划线于YPD培养基上30℃培养72 h后,再于YPD平板上连续传代1次或2次,第3代毕赤酵母的平板培养48 h备用。
1.2.2 子囊孢子诱导温度的确定 将菌涂布于乙酸钠诱导生孢培养基上,分别于25、28、30℃进行诱导培养,确定最适生孢温度。
1.2.3 子囊孢子的诱导 将上述平板上的菌苔分别涂布在不同的诱导培养基平板(表1)上进行培养,从48 h开始每24 h取1次样观察子囊孢子诱导情况。
1.2.4 子囊孢子的观察 采用单染色方法[5],菌体涂片,热固定,用2%碱性复红染色1 min,流水淋洗30 s,镜检制片,营养体为红色,子囊孢子为无色。分别选取4个视野记录子囊在视野中的百分比数,求其平均数确定为毕赤酵母生孢率。
2 结果与分析
2.1 毕赤酵母的预培养时间对生孢的影响
在对毕赤酵母的活化培养中发现,菌株的生长周期与传代次数有着密切的关系,从初期的活化到传代3次,菌株的生长周期是随着传代次数增多而变短,且在第3代时菌活力最好,最利于进行生孢培养。徐志彦[6]指出,孢子形成一般起源于富氮培养基(或称预培养基)上生长的细胞转入乙酸钾培养基,预培养基的营养越丰富,孢子形成的比例越高。故实验中选用了营养丰富的YPD培养基对毕赤酵母进行活化和预培养。实验结果证明经过3次传代的酵母生孢要比经过一次活化的酵母生孢率提高0.4倍左右(如图1所示)。
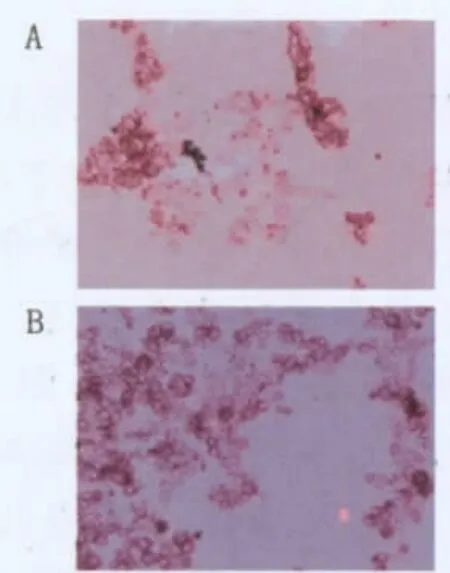
图1 P.pastoris X33不同活化次数对生孢的影响Fig.1 The sporulation of P.pastoris X33 by different times rejuvenation
2.2 温度对毕赤酵母生孢的影响
曾洪梅[7]曾经对面包酵母(Saccharomyces cerevisiae)菌株X-8进行生孢的最适温度筛选,结果发现菌株X-8在28℃时生孢最好,当温度小于20℃或大于32℃其生孢能力均明显下降,37℃时面包酵母完全不生孢。李华等[8]也对酿酒酵母(Saccharomyces cerevisiae)最适生孢温度进行了筛选,发现在25~28℃时酵母生孢效果好。这些研究结果均表明温度对面包酵母(即酿酒酵母)生孢有着很大的影响。基于以上研究将毕赤酵母生孢诱导温度筛选确定在25、28、30℃3个温度梯度上培养。
将同一平板上酵母菌分别均匀涂布于3个乙酸钠诱导生孢培养基上,分别放于25、28、30℃进行诱导培养,72 h后进行镜检观察。结果表明,在28℃时毕赤酵母的生孢量最高,其次是25℃的菌,生孢量最少的是30℃培养箱里诱导生孢的酵母。分析原因可能是毕赤酵母在略低于自己最适生长温度的环境里更适宜生孢,但是当温度过低时又会影响菌的生长,从而导致毕赤酵母生孢率的下降。因此,在后续的实验中将培养温度定在28℃,然后又对其他因子对毕赤酵母生孢的影响做了进一步的研究。
2.3 K+、Na+、Cl-、Ac-等离子对毕赤酵母生孢的影响
Cregg J M等[4]是利用SM培养基对毕赤酵母进行诱导生孢的,本研究也做了同样的诱导,发现生孢率不到40%。同样本研究也将毕赤酵母放在适合于酿酒酵母的乙酸钠诱导培养基上进行培养,生孢率也不到20%。因此,将这2种生孢培养基的成分进行了比较,结果发现除了碳源多加了1%的葡萄糖外,KCl成分的含量相差近5倍,故对KCl在毕赤酵母生孢上的影响做重点分析。
在其他成分不变的情况下改变KCl的浓度,见表1中A、B、C、D 4种培养基(KCl的浓度分别为0%、0.6%、1.2%、1.8%),将活化好的菌均匀涂布于这4个平板上,放于28℃培养箱中培养,从48 h开始每24 h取1次样进行镜检观察,结果显示(图2):KCl浓度为0.186%时(即乙酸钠诱导培养基)7 d生孢率不到20%;当KCl浓度为0.6%时毕赤酵母X-33的7 d生孢率达到最高为72%(B培养基);KCl浓度为1.2%(C培养基)生孢率明显开始下降,7 d仅为52%;而当KCl缺乏时毕赤酵母完全不生孢(A培养基),这说明KCl是影响毕赤酵母生孢的关键因子,但高浓度的KCl反而在一定程度上抑制生孢,因此K+可能调控与生孢有关蛋白的表达及其活性。
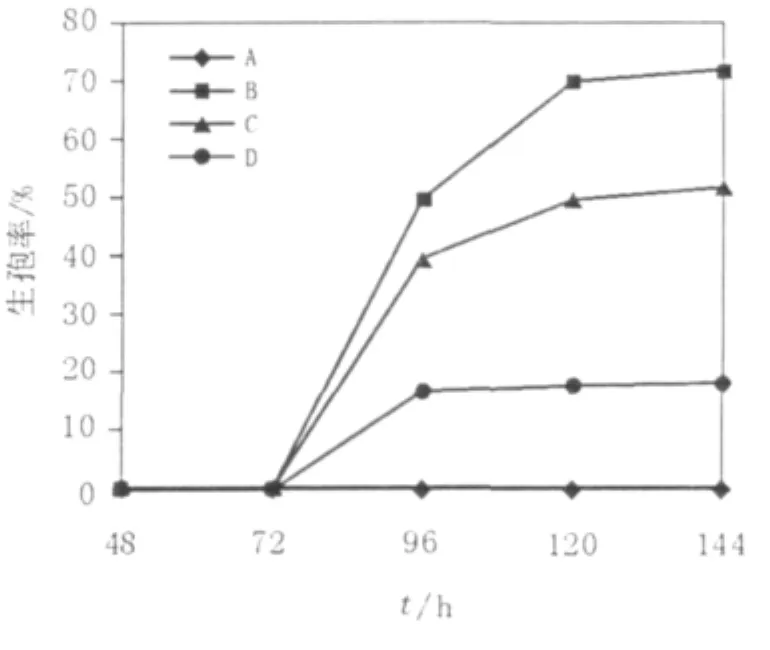
图2 KCl浓度对毕赤酵母生孢率的影响Fig.2 The Pichia sporulation efficiency influenced by KCl concentration
为进一步分析到底是K+、Cl-还是2种离子同时存在对毕赤酵母生孢产生诱导作用,配制L、M和O培养基进行更深入的分析。各培养基7 d诱导生孢率结果见图3,通过比较B和L培养基对毕赤酵母生孢诱导的结果,表明在2种培养基中Cl-同时存在时,只有Na+和K+的差别,当无K+而Na+存在(L培养基),不能诱导生孢,说明诱导生孢的关键因子不是Na+和Cl-,而是K+。
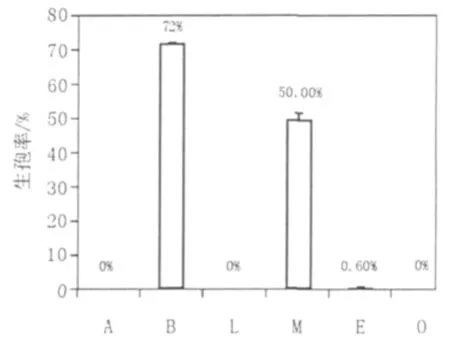
图3 K+、Na+等对毕赤酵母生孢率的影响Fig.3 The Pichia sporulation efficiency influenced by K+、Na+
A和M培养基同时存在Ac-,在无Cl-的情况下,A培养基上不生孢,M培养基上7 d生孢率能达到50%,表明Ac-并不是诱导毕赤酵母生孢的决定性因素。比较E培养基与M培养基,两者都含有K+,只有Ac-和Cl-的差别,其中仅含有Ac-的M培养基7 d生孢率为50%,而仅含有Cl-的E培养基其7 d生孢率仅为0.6%,可见Ac-在诱导毕赤酵母生孢过程中起到了促进作用。O培养基中只含有Na+和Cl-,毕赤酵母不能生孢从而进一步证明了Na+和Cl-对毕赤酵母生孢的影响不大。
2.4 碳源对毕赤酵母生孢的影响
酵母在部分缺乏碳源的培养基上孢子形成良好,但在碳源供应严重缺乏,酵母处于饥饿状态时就不能形成孢子,或极少形成孢子[9]。由此,在基于酿酒酵母中条件已经成熟的乙酸钠诱导生孢培养基上改变其碳源成分与含量来探讨诱导毕赤酵母生孢的最适碳源。
实验中先在以乙酸钠为唯一碳源的培养基中加入1%的葡萄糖,结果如图4所示。加入葡萄糖后生孢量明显增加,是未加葡萄糖培养基的10倍左右。然后在加了1%葡萄糖基础上改变乙酸钠的浓度来确定诱导毕赤酵母生孢的最适乙酸钠浓度,具体成分见表1中的E、F、B、G、H这5组培养基。结果见图5,当培养基中不含乙酸钠时毕赤酵母只有个别生孢(E培养基),而当乙酸钠含量大于2%时,生孢率也随着乙酸钠的浓度增大而降低(培养基G、H),只有当乙酸钠含量在1%左右时毕赤酵母的生孢率最高为72%左右(B培养基)。
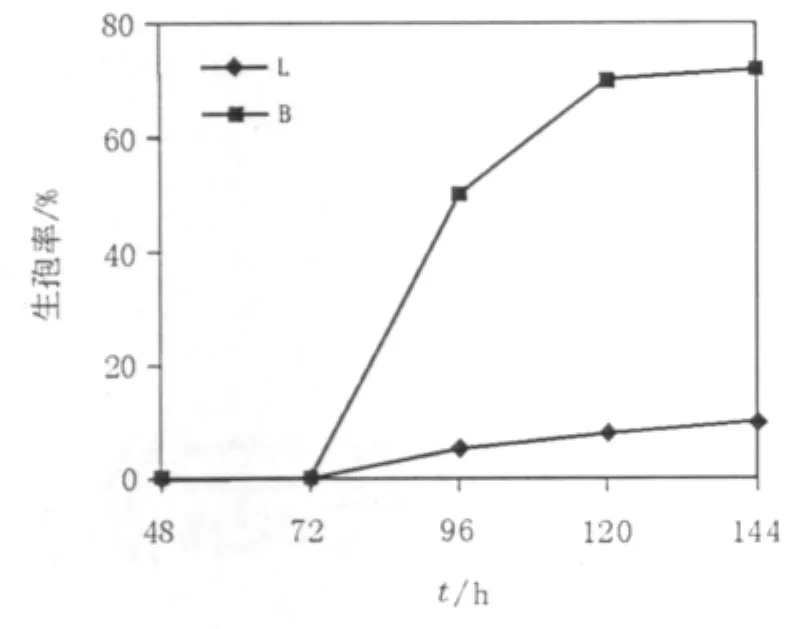
图4 乙酸钠培养基中葡萄糖对毕赤酵母生孢率的影响Fig.4 The Pichia sporulation efficiency influenced by glucose in sodium acetate medium
以上结果表明,毕赤酵母产生子囊孢子时需要一定的碳源来支撑自身基本的生长和营养需求,少量的葡萄糖可以给酵母提供能量促进子囊孢子生成。而乙酸钠则是作为一种诱导碳源来促进酵母大量产孢,缺少乙酸钠时产孢率极低,当其含量过大时又会影响子囊孢子的形成。
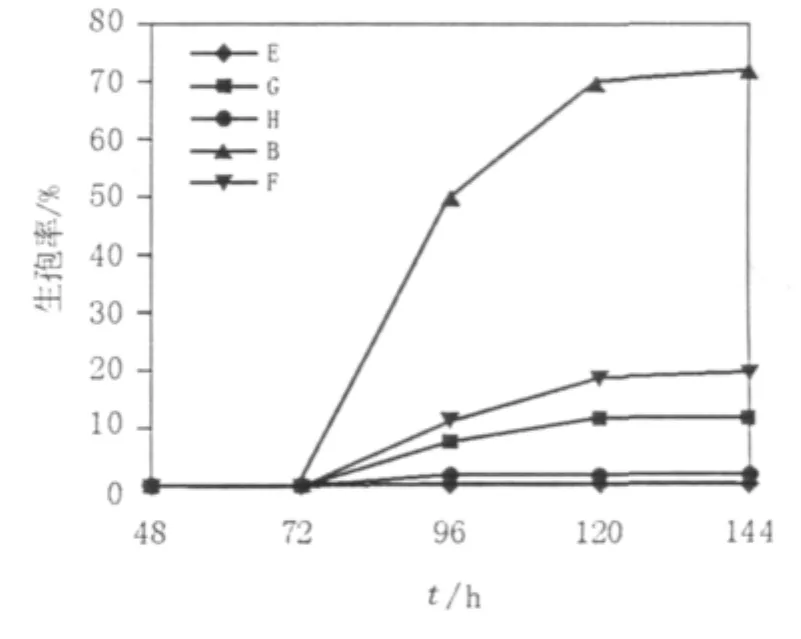
图5 乙酸钠的浓度对毕赤酵母生孢率的影响Fig.5 The Pichia sporulation efficiency influenced by sodium acetate
2.5 微量元素的影响
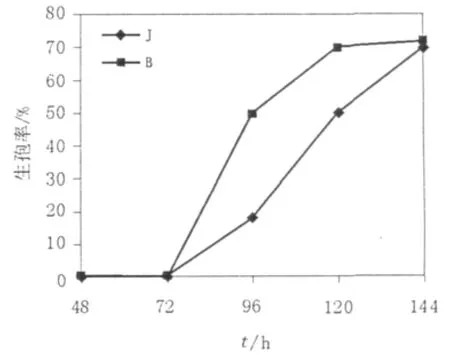
图6 微量元素对生孢率的影响Fig.6 The Pichia sporulation efficiency influenced by trace elements
关于乙酸钠培养基中微量元素的影响,王丽丽等[3]通过加大微量元素的量得出当其含量为0.1 mL/100 mL时诱导酵母生孢的效果很好,但如果不加微量元素生孢率将如何变化,因此本研究做了1组不加微量元素的培养基J,结果发现不加微量元素时生孢速度不如加微量元素的诱导培养基,但6 d后的生孢率基本趋于一致(图5)。由此可知微量元素的加入可以加快毕赤酵母的生孢速度,但对其长时间生孢的最终生孢率影响不大。
3 讨论
目前已有大量的文献[10-12]对酿酒酵母(Saccharomyces cerevisiae)等子囊孢子产生的条件进行了研究,本文基于酿酒酵母产孢应用条件成熟的乙酸钠诱导培养基来分析影响毕赤酵母生孢的条件,结果发现与酿酒酵母产生子囊孢子的许多影响因素基本相似,在生孢培养基的成分含量上稍微有些差异,总结目前毕赤酵母的最适生孢程序及条件:用含有酵母粉的丰富培养基如YPD培养基进行预培养,连续2次传代后将菌涂布于乙酸钠1%,氯化钾0.6%,葡萄糖1%,微量元素0.1%,琼脂2%的诱导培养基上,于28℃培养箱中培养,72 h子囊孢子就开始生成,7 d最高生孢率为72%左右。这个生孢率相对于酿酒酵母研究的生孢率[10-12]要低,这可能是因菌种的差别所致,适合于酿酒酵母的生孢培养基并不一定适用于其他的酵母菌种。
在对毕赤酵母子囊孢子生成条件的分析中发现,只添加乙酸钠和葡萄糖等碳源的培养基上毕赤酵母不生孢,而在以葡萄糖为碳源加有氯化钾的培养基上毕赤酵母只是极其少量的生孢,而只有在钾离子和乙酸根离子同时存在时生孢量才会大幅度增加,从结果分析来看,其生孢率最高能达72%,其中钾离子和乙酸根离子对毕赤酵母子囊孢子的诱导产生有明显的促进作用。这可能是由于钾离子的诱导作用或是它参与某些蛋白质的合成调控或其酶活性,具体原因目前还不太清楚,有待于进一步研究。
[1]Cregg JM.Pichia Protocols[M].Totowa:Humana Press Inc,2007.
[2]Cregg JM,Cereghino JL,Shi J,et al.Recombinant protein expression in Pichia pastoris[J].Molecular Biotechnology,2000,16(1):23-52.
[3]王丽丽,仪宏,侯建革,等.环境诱导酵母产生子囊孢子的营养条件研究[J].酿酒,2003,30(6):30-32.
[4]Cregg JM,Tolstorukov I,Kusari A,et al.Expression in the YeastPichia pastoris[J].Methods in Enzymology,2009,463:169-189.
[5]黄秀梨.微生物学实验指导[M].北京:高等教育出版社;德国:施普林格出版社,1999.
[6]徐志彦,王敏.啤酒酵母孢子形成研究的新进展[J].遗传,1989,11(3):43-45.
[7]曾洪梅.酿酒酵母子囊孢子的形成条件及细胞学研究[J].微生物学报,1993,33(2):92-97.
[8]李华,刘丽丽,李娟.酿酒酵母产孢培养基的筛选及单倍体的分离[J].酿酒科技,2008,168(6):22-24.
[9]Elisabeth Bautz Freese,Martha I.chu,Ernst Freese.Initiation of Yeast Sporalation by Partial Carbon,Nitrogen,or Phosphate Deprivation[J].Journal of Bacteriology,1982,149(3):840-851.
[10]张冬妮,曾云中,吴雪昌,等.酿酒酵母产孢最佳条件的研究[J].杭州大学学报,1994,21(4):452-457.
[11]侯红漫,吴怡莹,杨彬,等.K氏酵母与清酒酵母产孢率的研究及原生质体制备[J].大连轻工业学院学报,1994,13(2):85-90.
[12]吕红线,王晓红.酿酒酵母子囊孢子形成条件的研究[J].山东轻工业学院学报,1999,13(2):57-60.