肾虚质大鼠免疫相关因子含量变化与肾藏象理论的相关性研究*
2013-07-20孙理军党照丽陕西中医学院咸阳712046
孙理军 党照丽 王 震 陕西中医学院(咸阳712046)
本研究以中医学理论为指导,采用猫吓鼠的经典造模方法[1],造成具有中医体质理论特色的肾虚质动物模型,并在大量文献研究和临床研究的基础上,将肾藏象理论和现代免疫学知识结合,提出了肾虚体质防御、修复适应能力降低与免疫功能失调密切相关的假设,从差异性角度研究肾藏象理论,根据肾虚体质的生理病理特点,结合前期研究成果,以及细胞因子在免疫调节中的作用特性,进一步筛选出肾虚质的特异血清免疫分子标志物,为肾藏象理论的现代研究提供范式,丰富和发展肾藏象理论。
1 实验材料 1.1 实验动物 3月龄SPF级SD 雄性大鼠30只,体重350g±20g,3月龄SPF级SD 雌性大鼠30只,体重250g±20g,购自西安交通大学医学院实验动物中心,生产许可证是SCXK(陕)2007-001,自由饮食饮水,室温饲养。3月龄猫2只,凶狠善叫,喂食鲜活大鼠,室温饲养。
1.2 实验药物及试剂 桂附地黄丸(原名金匮肾气丸,兰州佛慈制药有限公司提供,批号10c7,每丸含生药量0.375g),水合氯醛(上海山浦化工有限公司,批号:20090205),氯化钠注射液(西安京西双鹤药业有限公司,批号091116122),无水乙醇(天津市红岩化学试剂厂,批号20091016),IFN-γ、TNFα、IL-6ELISA 试剂盒(均由上海西唐生物科技有限公司提供,批号分别为:1007231,1007181,1007271),IL-10ELISA 试剂盒(由武汉博士德生物工程有限公司提供,批号为:138658)
1.3 主要实验仪器及耗材 全自动酶标仪(美国Bio-Tek ELX808IU),电子精密天平(美国赛多利斯),医用低温冰箱(MDF-330,日本产),全自动高压灭菌器(日本三洋mLS-3780),低速离心机(科大创新股份有限公司KDC-40),电热恒温振荡水槽(上海一恒科学仪器有限公司DKZ系列)。
2 实验方法 2.1 模型建立 参照我们以往建立肾虚质大鼠模型的方法[2],经适应性饲养1周无异常后,将30只雌性大鼠随机分为2组:肾虚质雌鼠组20只,正常质雌鼠组10只,将雄性大鼠与雌性大鼠按1:1比例合笼配对5d后,检测雌鼠阴栓判断其是否怀孕,然后将肾虚质组孕鼠放于特制大鼠笼内,于每天定时进行恐吓,直到其生产为止。正常组孕鼠,不予恐吓,让其自然待产。待两组孕鼠分娩后,将生产的子鼠在不予恐吓的情况下饲养满60日龄后进行分组,随机选取正常组孕鼠所产雄性子鼠8只作为空白组,选取肾虚质组孕鼠所产雄性子鼠16只,随机分为模型组及药物组,每组8只。将模型组和药物组的16 只子代鼠于每日定时进行恐吓,持续1 个月。空白组不予恐吓,其余时间各组均置于同一实验室,保证非处理因素一致。
2.2 给药方法 大鼠给药量按文献折算[3],大鼠的用药量约为人的6.25倍。桂附地黄丸每8丸含生药量为3g,成人每日服生药量为9g,则大鼠每日服生药量为0.9375g/kg,用蒸馏水配成0.09375g/mL 混悬液,备用。对子代鼠恐吓的同时开始灌胃,药物组给予桂附地黄丸混悬液,空白组和模型组皆给予等量生理盐水,10mL/kg,每日1次,共30d。
2.3 标本采集与处理 灌胃60d后分别处死,处死前禁食12h,翌日采用心脏取血方式,取血2mL,然后将其以3000转/分离心15min,分离血清,置离心管内,保存于-20℃冰箱待测。
2.4 指标检测 IL-6、IL-10、IFN-γ、TNF-α的检测:使用美国Bio-Tek公司产品ELX808IU 型全自动酶标仪进行检测,试剂盒是采用双抗体两步夹心酶联免疫吸附法(ELISA),具体操作步骤按照R&D 公司的试剂盒说明书,进行检测及计算。
3 结 果各组大鼠血清IL-6、IL-10、IFN-γ、TNF-α的比较,见表1
表1 各组大鼠血清IL-6、IL-10、IFN-γ、TNF-α 的比较(±s)
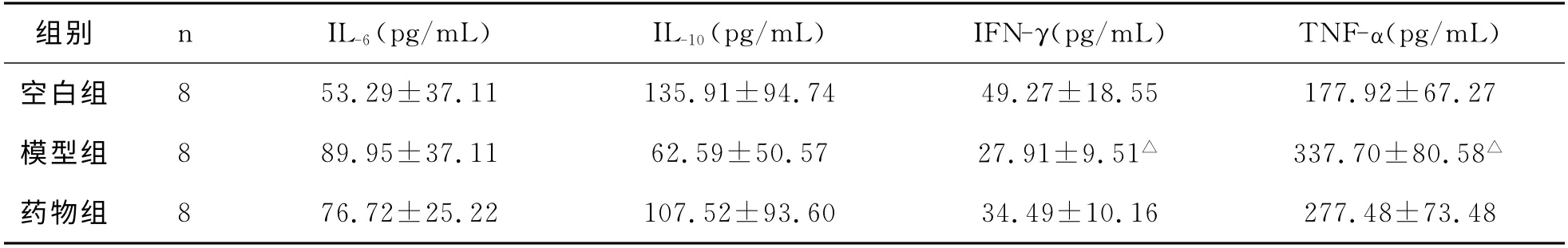
表1 各组大鼠血清IL-6、IL-10、IFN-γ、TNF-α 的比较(±s)
注:与空白组比较△P<0.05。
组别n IL-6(pg/mL)IL-10(pg/mL)IFN-γ(pg/mL)TNF-α(pg/mL)空白组8 53.29±37.11 135.91±94.74 49.27±18.55 177.92±67.27模型组8 89.95±37.11 62.59±50.57 27.91±9.51△337.70±80.58△药物组8 76.72±25.22 107.52±93.60 34.49±10.16 277.48±73.48
如表1所示,与空白组相比,模型组IL-10、IFN-γ的含量均降低,IL-6、TNF-α含量升高,其中IFN-γ的降低和TNF-α的升高有统计学意义(P<0.05)。与模型组比,药物组IL-10、IFN-γ的含量均升高,IL-6,TNF-α含量降低,均无统计学意义。
4 讨 论 肾为先天之本,正气之根,肾中精气的盛衰是决定机体正气强弱的重要因素。肾中精气充足,则正气旺盛,机体能够抵抗外邪的侵袭,不易发病;反之,肾中精气不足,则机体正气化生不足,致使防御能力下降,外邪易乘虚侵袭而发病。现代研究表明,肾与免疫功能密切相关[4],细胞因子的研究进展是免疫学研究中最为突出的成果之一。细胞因子在免疫-神经-内分泌调节网络中起着重要的介质作用,它的含量改变必然会破坏这一网络的平衡状态,进而破坏机体内环境的稳定及内外环境的统一,导致疾病的发生[5]。前期实验研究表明肾虚质与细胞因子参与免疫应答有一定的关系,为了全面探讨肾虚质大鼠免疫稳态失衡的分子机理,可深入研究在免疫调节中发挥着重要作用的细胞因子,进一步筛选出肾虚质的特异性免疫分子标志物。
本研究选择细胞因子中具有代表性的IL-6、IL-10、IFN-γ、TNF-α作为观察指标从分子水平研究其含量变化与肾藏象理论的相关性。其中IFN-γ和TNF-α是由Th1淋巴细胞分泌,介导细胞免疫应答;IFN-γ、TNF-α由Th2淋巴细胞分泌,辅助体液免疫应答,在过敏性疾病和感染性疾病中发挥作用。IFN-γ是重要的免疫调节因子,能通过增强Th1细胞的活性而增强细胞免疫;通过抑制Th2的细胞增殖而抑制体液免疫。通过其细胞表面受体,诱导产生多种蛋白和酶,通过不同途径、不同机制发挥抗病毒和免疫调节作用。IL-10是免疫过程中重要的负调节因子,具有很强的抗炎和免疫抑制活性,它能抑制IL-6、TNF-α等促炎因子的产生和释放[6]。TNF-α是炎症反应过程中出现最早、最重要的炎性介质,由活化的巨噬细胞和单核细胞分泌,能激活中性粒细胞和淋巴细胞,使血管内皮细胞通透性增加,可调节机体的免疫功能,参与炎症多方面病理变化。IL-6也是炎症反应中一种重要的细胞因子,可促进B 细胞增殖分化,并诱导其分泌抗体,促进T 细胞产生IL-2,并作为致热原刺激下丘脑体温调节中枢引起机体发热,参与调节免疫应答及机体的炎症反应。
本实验结果可见模型组大鼠IL-6、IL-10、的含量与空白组大鼠比均降低,IL-6、TNF-α含量与空白组大鼠比则升高。IFN-γ则可增强细胞免疫功能,而模型组大鼠可见其均降低,反映大鼠在受惊吓之后机体免疫功能的降低;IL-6、TNF-α为促炎因子,其血清含量的升高可提示大鼠在长期受惊吓的情况下会导致机体应激反应而产生促炎因子的升高,IL-10是公认的抑炎因子,模型大鼠IL-6、TNFα产生增多,IL-10生成减少,出现致炎因子与抑炎因子之间失衡,而致机体免疫系统紊乱。使用药物对模型组大鼠进行干预后,可见IL-10、IFN-γ的含量升高,IL-6,TNF-α含量降低,可证机体的免疫功能的降低及紊乱得到了一定的纠正。研究结果表明:肾虚质大鼠与细胞因子参与的免疫应答有一定的关系。
[1] 王米渠,马向东,段光周,等.“肾为先天之本”行为遗传中关于“恐伤肾”的表征[J].中国中医基础医学杂志,1997,3(4):23-25.
[2] 孙理军,李翠娟,王 震,等,肾虚质实验动物模型的构建方法与评价[J].时珍国医国药,2013,24(1):247-249.
[3] 施新猷.现代医学实验动物学[M].北京:人民军医出版社,2000:332-335.
[4] 孙理军,郝 蕊,薛 昶,等.肾虚质大鼠CD4+、CD8+T 淋巴细胞亚群表达水平的研究[J].陕西中医,2008,29(12):1671-1672.
[5] 朱长庚,李正莉.细胞因子与免疫-神经-内分泌调节网络[J].解剖学报,1996,27(4):339-344.
[6] Skapenko A,Gerald U,Niedobitek,J R,et al.Generation andregulation of human Th1-biased immune responsesin vivo:acritical role for IL-4and IL-10[J].J Immunol,2004,172(10):6427-6434.
