基于合成高分子的纳米药物载体的研究进展
2013-07-18余丽丽杨黎燕李仲谨
余丽丽,姚 琳,杨黎燕,杨 宽,李仲谨
(1.西安医学院药学院,陕西西安710021;2.陕西科技大学化学化工学院,陕西西安710021)
基于合成高分子的纳米药物载体的研究进展
余丽丽1,姚 琳1,杨黎燕1,杨 宽1,李仲谨2
(1.西安医学院药学院,陕西西安710021;2.陕西科技大学化学化工学院,陕西西安710021)
基于合成高分子的纳米微粒由于其良好的生物相容性、生物可降解性和粘膜粘附性等特点成为药物载体研究的热点。根据构建纳米药物载体的高分子聚合物结构的差异,将其分为:基于两亲聚合物的纳米微粒(胶团和囊泡)、脂质体、树枝状或超支化大分子、乳液聚合纳米微粒,并对上述纳米微粒作为药物载体在近年来的研究进展进行了归纳和总结,展望了其在药物缓释体系中的广阔应用前景。
高分子;纳米载体;药物控制释放
高分子纳米药物载体(Polymer-based nanoparticle drug carriers,PNDC)是指通过乳液聚合、聚合物的自组装或纳米材料的修饰而获得的一些能够用于药物、核酸或蛋白的包载和体内运输的纳米微粒。由于纳米微粒(NPs)在体内具有EPR效应(Enhanced permeability and retention effect)[1,2],因此,关于高分子纳米药物载体用作靶向药物载体的相关研究受到了广泛的关注[3]。目前,常见的载体材料主要包括聚合物胶团和囊泡、纳米脂质体[4]、树枝状大分子或超支化大分子、乳液聚合微粒[5]等。
作者对近年来各类PNDC的合成和应用研究进行综述,并对其应用前景进行了展望。
1 胶团和囊泡
两亲聚合物或两亲多嵌段聚合物在合适的条件下能够自组装形成胶团(O/W)或囊泡(W/O/W)[6](图1)。
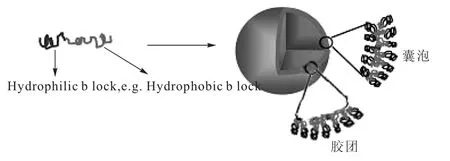
图1 两亲聚合物形成胶团或囊泡的示意图Fig.1 Micelles or polymersomes derived from amphiphilic polymer
1.1 胶团和囊泡的形成
两亲聚合物具有表面活性,因此在水溶液中能够自组装形成各种类型的胶团和囊泡。常见的亲水端有聚乙二醇或聚乙二醇单甲醚(PEG)、聚甲基丙烯酸(PMAA)、聚丙烯酰胺(PAM)等,而常见的疏水端有聚苯乙烯(PS)、聚甲基丙烯酸甲酯(PMMA)、聚乳酸(PLA)、聚ε-己内酯(PCL)、聚苯乙烯(PS)、聚苯硫醚(PPS)等。
根据聚合物的结构差异,可将两亲聚合物分为: (1)线性双嵌段共聚物,如Ghoroghchian等[7]通过开环聚合合成的PCL-b-PEG;(2)线性三嵌段共聚物,如Napoli等[8]合成了PEG-b-PPS-b-PEG,并验证了其自组装能力;(3)多嵌段共聚物或交联聚合物等,如Yu等[9]合成了具有光敏感交联结构的PEG-b-PMMA自组装两亲聚合物。可见,PEG是药物载体中最为常见的一种亲水端,这是由于PEG具有较好的生物相容性和生物可降解性,同时PEG的存在可有效地促进细胞对胶团或囊泡的吞噬,有利于药物载体的跨膜。此外, PEG还可抵抗蛋白吸收及细胞的粘附性,同时具有良好的变形性,这些性质均有利于延长载体在体内的循环时间,提高其体内运输的稳定性能。疏水端的选择则多数为容易聚合且具有良好生物相容性的聚合物链段[]。
通常采用分散法制备胶团或囊泡:将过量的水(可有效地溶解PEG)加入到溶有聚合物和药物的有机溶剂(如THF、DMSO、DMF)中,并通过减压蒸馏、透析等方式将溶剂去除,进而获得所需胶团。此外,为了有效地提高胶团的药物包载性能和稳定性,根据两亲聚合物的结构差异和药物的性能差异,载体亦可通过其它方式获得,如拉膜法[10]、药物吸附法、W/O/W型双乳法[11]等。
采用同样的制备方式,以相同的聚合物在不同的聚合度下可分别获得胶团和囊泡。以PEG为亲水端的聚合物为例,载体的形成取决于PEG链段在聚合物中的质量比(fPEG)(以水为介质)。当fPEG较小时,易自组装形成W/O/W型的囊泡,可用于水溶性药物的包载;当fPEG大于35%时,载体为胶团(圆柱形或球形),此时则可用于脂溶性药物的包载。
当然也存在例外,如Shen等[12]研究发现,选用PEG-b-PAA作为两亲聚合物时形成囊泡所需的fPEG比正常的情况要低,当fPEG为13%~17%时,样品较易形成囊泡,其它条件下均形成胶团。
1.2 胶团和囊泡作为PNDC的特征
关于胶团和囊泡作为PNDC的应用,近年来受到了越来越多的关注,这主要取决于该类载体的一些独特的性能:(1)聚合物的可控性较强,可通过疏水端聚合度的有效控制来实现对载体透气性、弹性和机械性能等指标的有效控制;(2)可通过聚合物分子量的控制提高其外膜的强度,从而有效地提高载体在体内的稳定性能,进而提高其在病灶位置的定点释放;(3)用于自组装的聚合物多为合成类聚合物或半合成类聚合物,可通过聚合物的结构设计为药物提供功能化载体[13];(4)胶团和囊泡具有较好药物包载性能、良好水溶性[14]、低细胞毒性[15];(5)胶团和囊泡可有效地避免肾排斥,进而延长了其在体内的运输时间,促进了药物在肿瘤或其它靶点处的被动累积[16]。这些性质都决定了其在医学、药学和生物技术中的潜在优势。
1.3 胶团和囊泡在PNDC中的应用
(1)胶团的应用
胶团可用作脂溶性药物或水溶性药物的包载,研究最多的是PLA-b-PEG[17]和PEG-b-PMMA。紫杉醇(PTX)是该类胶团研究过程中较为常见的一种脂溶性药物模型,将其包载至胶团(如PLA-b-PEG胶束)的疏水核心中可有效地改善其在水中的溶解性能。此外,近年来关于半合成类的新型两亲胶团的合成和应用研究也较为广泛,如Paramonov等[18]将Ⅳ-辛基-O-硫酸盐壳聚糖(NOSC)胶束用于PTX的包载运输, PTX-NOSC胶束的载药量和包封率分别达69.9%和 97.26%。
(2)囊泡的应用
囊泡可形成亲水核心,因此多用于水溶性药物的载负。囊泡的主要作用是防止药物在体内的酶解,提高其跨膜性和实现药物释放的靶向性。如胰岛素是一种蛋白类药物,在体内输送的过程中可被酶代谢,且对肠上皮细胞的跨膜性较差,导致口服胰岛素不易吸收不利,为了有效实现胰岛素口服,囊泡被引入胰岛素的包载运输研究中。Xiong等[19]制备了聚乳酸-聚醚-聚乳酸型胰岛素囊泡,以糖尿病大鼠为动物模型研究其口服给药,研究显示,与胰岛素溶液相比,囊泡型胰岛素溶液具有较优的降低血糖能力,4.5 h内血糖浓度从18.5 mmol·L-1降至5.3 mmol·L-1。
除了口服给药体系外,囊泡研究主要集中于局部给药体系和注射给药体系。Ahmed等[20]制备了PEG-b-PLA囊泡,并将其用于局部给药研究,结果表明该囊泡具有良好的细胞内出发释放能力。
2 脂质体
脂质体(Liposome)是一种人工双层脂质膜,脂质膜包围形成囊状结构,而囊状结构为聚合物提供了包载空间[21]。囊状结构是磷脂分子在水中通过疏水缔合自组装而成的,通常通过超声或搅拌等方式破坏已形成的生物膜获得,也可采用水合作用、反相蒸发法、冷冻干燥法、溶剂注入法等方式获得[22]。根据脂质体含双层脂质膜的差异性,可将其分为单室脂质体和多室脂质体(MIV)。单室脂质体根据粒径的差异又分为单室小脂质体(SUV,0.02~0.08μm)、单室大脂质体(LUV,0.1~1μm),多室脂质体粒径为1~5μm。
脂质体是进入临床研究较多的一类PNDC,这是由于其具有的独特性质:(1)双层或多层结构。脂质体的膜为类脂双分子膜,膜的层间和内核为水相,膜间为油相,因此,其在药物的选择性上优于胶团和囊泡,既可用于脂溶性药物(膜间)的包载又可用于水溶性药物(层间或内核)的载负;(2)高生物相容性。脂质体的双层膜多由生物膜制备,其与体内生物膜(如细胞膜)可融合,融合后可为负载的药物提供作用位点,并将其送入细胞内;(3)结构可设计性。通过脂质体的结构设计,可获得具有一定的环境刺激释放性的载体(如p H敏感性载体、光敏感性载体和氧化还原敏感性载体等)[23],也可通过对脂质体的结构修饰,使其键合一些特殊的配体,通过配体与细胞表面受体之间的作用促进载体的细胞内吞[24],或帮助载体有效地识别靶点位置,实现药物的靶向释放;(4)粒径和形态的可控性。可通过脂质体的粒径控制使其成为巨噬细胞的内吞目标;(5)肿瘤细胞靶向性。脂质体对部分肿瘤细胞具有主动识别能力[25],这是由于正常血管壁有内皮细胞的保护,限制了血液中大粒子(载体)的渗出和进入,而在肿瘤组织处则缺乏这种保护,因此,病灶处的血管渗透性较高,有利于纳米级别的脂质体在肿瘤组织处的累积,实现载体的被动靶向。目前,市售载抗癌药物的脂质体有阿霉素(DOX)脂质体、喜树碱脂质体和柔红霉素(Daunoxome)脂质体等[26],此外还有一些脂质体药物进入了临床阶段(表1)。
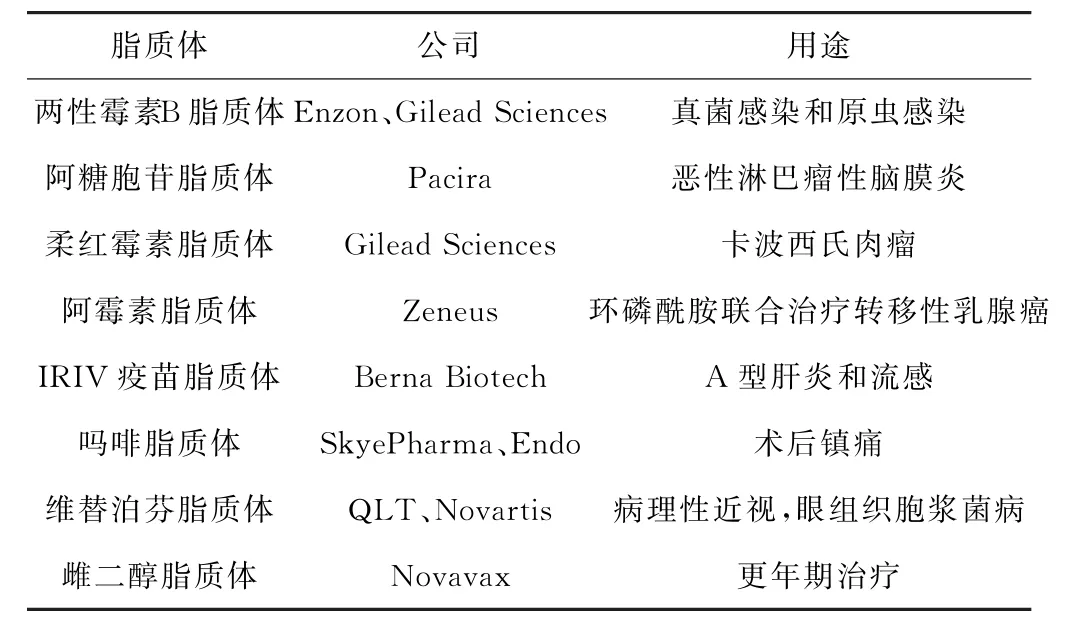
表1 临床获批药物脂质体[26]Tab.1 List of clinically-approved liposomal drugs
3 树枝状或超支化大分子
树枝状或超支化大分子是通过有机合成法获得的结构规整的大分子,形似树枝,表面堆砌致密,内部具有树枝状分子撑起的空隙,一般分子尺度在纳米级。树枝状或超支化大分子均具有较好的水溶性、单分散性和较优的包载性能,同时可以通过结构的设计和修饰在分子末端引入功能基,进而改善该类载体的各项性能。
根据载药形式的不同可将树枝状或超支化载体分为3种[27]:(1)共价键型载药,药物通过共价键键合至载体的表面,该类载药的药物释放需要通过体内环境的变化来切断共价键,因此表现出较好的缓释性能; (2)离子键型载药,药物通过离子键的形式连接到载体表面,离子键在水溶液中易解离引起药物突释;(3)胶团型载药,树枝状或超支化大分子亦可基于结构中亲水亲油基的两亲性自组装形成胶团,该类胶团多用作高活性药物载体,是一类具有潜力的输送体系,但与传统的胶团相比,还存在溶解性较差等问题,限制了其临床应用。
目前,树枝状或超支化大分子载体主要是作为具有生物活性的抗逆转录病毒的载体[28],该类载体具有抗逆转录病毒活性,可有效地增强其作为抗逆转录病毒药物载体的功效[29]。此外,该类载体还可作为DNA载体[30]。
4 乳液聚合纳米微粒
通过乳液聚合法制备纳米或微米级别的载体,是PNDC研究的重要方向之一。该类载体可以通过乳液聚合、微乳聚合、分散聚合、沉淀聚合、种子聚合以及悬浮聚合等方式制备。其中,纳米级别的载体通常需要通过微乳聚合法来制备。微乳聚合法是由Stoffer等[31]首次报道的,与常规乳化方式相比具有更优的粒径可控性。微乳聚合法根据其乳化方式的不同可分为正相微乳聚合(O/W型)法和反相微乳聚合(W/O型)法,通过这两种方式制备的NPs分别可用于脂溶性药物和水溶性药物的包载。
与传统的乳化方式相比,微乳聚合具有其特殊之处:(1)可快速合成高分子量载体,避免体系自由基聚合过程中出现的分子量和聚合速率折中的问题;(2)粒径分布均匀、可控性强,一般可控制粒径≤200 nm,是迄今为止最为经典的NPs合成方法。
微乳聚合法通常是通过自由基聚合的方式制备的,常用温度、UV、微波等方式诱导。其中温度诱导是最为常见的诱导方式。Bachelder等[32]通过高温诱导反相乳液聚合,获得了一系列用于蛋白质、DNA等水溶性大分子药物输送的纳米微凝胶。
近年来,微波和UV等诱导方式由于其高效性也受到了越来越多的关注。Griset等[33]以UV引发微乳聚合制备了一种新型的聚甲基丙烯酸甲酯NPs,并将其用作PTX载体,NPs的直径为120 nm且分布均匀,并且具有较高的包载率(85%);Ma等[34]通过UV诱导制备了p H响应型的纳米PNIPAAm/Dex-MA水凝胶,并探讨了其对盐酸阿霉素的包载能力。
5 展望
近年来,随着高分子材料科学研究的不断创新,材料科学、药学、生物学等学科交叉不断深入,越来越多功能化的新型PNDC得以制备,其作为药物载体的各项理化性能(包载药物效率、体外释放实验、细胞毒性实验、动物体内缓释)也得到了大量的研究。此外,近年来越来越多的纳米载体也逐步进入了临床研究阶段。
目前,真正通过临床实验应用至临床治疗的PNDC的品种仍然不多,并存在缓释控制效果不显著、可控释放性不强等问题,因此,需要进一步加强载体的构效关系研究,促进在动物水平具有潜力的载体在临床研究中的应用,相信会有越来越多的新型PNDC应用于临床治疗中。
[1] von Vlerken L E,Vyas T K,Amiji M M.Poly(ethylene glycol)-modified nanocarriers for tumor-targeted and intracellular delivery [J].Pharm Res,2007,24(8):1405-1414.
[2] Maeda H,Sawa T,Konno T.Mechanism of tumor-targeted delivery of macromolecular drugs,including the EPR effect in solid tumor and clinical overview of the prototype polymeric drug SMANCS[J].J Control Release,2001,74(1-3):47-61.
[3] Brigger I,Dubernet C,Couveur P.Nanoparticles in cancer therapy and diagnosis[J].Adv Drug Deliv Rev,2002,54(5):631-651.
[4] Xing J,Zhang D,Tan T.Studies on the oridonin-loaded poly(D,L-lactic acid)nanoparticles in vitro and in vivo[J].Int J Biol Macromol,2007,40(2):153-158.
[5] 王建新,张志荣.固体脂质纳米粒的研究进展[J].中国药学杂志, 2001,36(2):73-77.
[6] Iatrou H,Frielinghaus H,Hanski S,et al.Architecturally induced multiresponsive vesicles from well-defined polypeptides.Formation of gene vehicles[J].Biomacromolecules,2007,8(7):2173-2181.
[7] Ghoroghchian P P,Li G Z,Levine D H,et al.Bioresorbable vesicles formed through spontaneous self-assembly of amphiphilic poly(ethylene oxide)-block-polycaprolactone[J].Macromolecules, 2006,39:1673-1675.
[8] Napoli A,Boerakker M J,Tirelli N,et al.Glucose-oxidase based self-destructing polymeric vesicles[J].Langmuir,2004,20(9): 3487-3491.
[9] Yu L L,Lu C,Wu L Z,et al.Photosensitive cross-linked block copolymers with controllable release[J].Photochemistry and Photobiology,2011,87(3):646-652.
[10] Lee J C M,Discher D E.Deformation-enhanced fluctuations in the red cell skeleton with theoretical relations to elasticity,connectivity,and spectrin unfolding[J].Biophysical Journal,2001, 81(6):3178-3192.
[11] Beaune G,Dubertret B,Clément O,et al.Giant vesicles containing magnetic nanoparticles and quantum dots:Feasibility and tracking by fiber confocal fluorescence microscopy[J].Angew Chem Int Ed,2007,46(28):5421-5424.
[12] Shen H W,Eisenberg A.Block length dependence of morphological phase diagrams of the ternary system of PS-b-PAA/dioxane/ H2O[J].Macromolecules,2000,33(7):2561-2572.
[13] Discher D E,Ortiz V,Srinivas G,et al.Emerging applications of polymersomes in delivery:From molecular dynamics to shrinkage of tumors[J].Prog Polym Sci,2007,32(8-9):838-857.
[14] Wang Z Y,Song J,Zhang D S.Nanosized As2O3/Fe2O3complexes combined with magnetic fluid hyperthermia selectively target liver cancer cells[J].World J Gastroenterol,2009,15(24):2995-3002.
[15] Vauthier C,Labarre D.Modular biomimetic drug delivery systems[J].J Drug Del Sci Tech,2008,18(1):59-68.
[16] Meng F,Engbers G H M,Feijen J.Biodegradable polymersomes as a basis for artificial cells:Encapsulation,release and targeting [J].J Control Release,2005,101(1-3):187-198.
[17] Lin W J,Juang L W,Lin C C.Stability and release performance of a series of pegylated copolymeric micelles[J].Pharm Res, 2003,20(4):668-673.
[18] Paramonov S E,Bachelder E M,Beaudette,T T,et al.Fully aciddegradable biocompatible polyacetal microparticles for drug delivery[J].Bioconjugate Chem,2008,19(4):911-919.
[19] Xiong X Y,Li Y P,Li Z L,et al.Vesicles from pluronic/poly(lactic acid)block copolymers as new carriers for oral insulin delivery[J].Journal of Controlled Release,2007,120(1-2):11-17.
[20] Ahmed F,Pakunlu R I,Srinivas G,et al.Shrinkage of a rapidly growing tumor by drug-loaded polymersomes:p H-Triggered release through copolymer degradation[J].Mol Pharm,2006,3 (3):340-350.
[21] Barani H,Montazer M.A review on applications of liposomes in textile processing[J].Journal of Liposome Research,2008,18 (3):249-262.
[22] Sharma A,Straubinger R M.Novel taxol formulations:Preparation and characterization of taxol-containing liposomes[J]. Pharm Res,1994,11(6):889-896.
[23] DamgéC,Maincent P,Ubrich N.Oral delivery of insulin associated to polymeric nanoparticles in diabetic rats[J].J Controlled Release,2007,117(2):163-170.
[24] Caracciolo G,Pozzi D,Cammiti R.Structural characterization of a new lipid/DNA complex showing a selective transfection efficiency in ovarian cancer cells[J].Eur Phys J E Soft Matter, 2003,10(4):331-336.
[25] Petri B,Bootz A,Khalansky A,et al.Chemotherapy of brain tumor using doxorubicin bound to surfactant-coated poly(butylcyanoacrylate)nanoparticles:Revisiting the role of surfactants [J].J Controlled Release,2007,22(1):51-58.
[26] Zhang L,Gu F X,Chan J M,et al.Nanoparticles in medicine: Therapeutic applications and developments[J].Clinical Pharmacology and Therapeutics,2008,83(5):761-769.
[27] Tekade R K,Dutta T,Gajbhiye V,et al.Exploring dendrimer towards dual drug delivery[J].Journal of Microencapsulation, 2009,26(4):287-296.
[28] Dutta T,Jain N K.Targeting potential and anti-HIV activity of lamivudine loaded mannosylated poly(propyleneimine)dendrimers[J].Biochimica et Biophysica Acta,2007,1770(4):681-686.
[29] Dutta T,Garg M,Jain N K.Targeting of efavirenz loaded tuftsin conjugated poly(propyleneimine)dendrimers to HIV infected macrophages in vitro[J].Eur J Pharm Sci,2008,34(2-3):181-189.
[30] Fu H,Cheng S,Zhang X.Dendrimer/DNA complexes encapsulated in a water soluble polymer and supported on fast degrading star poly(DL-lactide)for localized gene delivery[J].Journal of Control Release,2007,124(3):181-188.
[31] Stoffer J O,Bone T.Polymerization in water-in-oil microemulsion systems[J].Journal of Polymer Science:Polymer Chemistry Edition,1980,18(8):2641-2648.
[32] Bachelder E M,Beaudette T T,Broaders K E,et al.Acetal-derivatized dextran:An acid-responsive biodegradable material for therapeutic applications[J].J Am Chem Soc,2008,130(32): 10494-10495.
[33] Griset A P,Walpole J,Liu R,et al.Expansile nanoparticles:Synthesis,characterization,and in vivo efficacy of an acid-responsive polymeric drug delivery system[J].J Am Chem Soc,2009,9 (131):2469-2471.
[34] Ma N,Wang Y P,Wang B Y,et al.Interaction between block copolymer micelles and azobenzene-containing surfactants:From coassembly in water to layer-by-layer assembly at the interface [J].Langmuir,2007,23(5):2874-2878.
Research Progress of Polymer-Based Nanoparticle Drug Carriers
YU Li-li1,YAO Lin1,YANG Li-yan1,YANG Kuan1,LI Zhong-jin2
(1.Department of Pharmacy,Xi'an Medical University,Xi'an 710021,China;2.College of Chemistry and Chemical Engineering,Shanxi University of Science&Technology,Xi'an 710021,China)
Polymer-based nanoparticles have attracted more and more attentions as drug carriers in recent years because of their good biocompatibility,biodegradability and mucoadhesive ability.According to the polymer structures,the nanoparticles were divided into four types,including amphiphilic polymer-based nanoparticles(micelles and polymersomes),liposomes,dendrimers and nanoparticles prepared by emulsion polymerization.And then the research progress of the application of these polymer-based nanoparticles as drug carriers was summarized.And the broad application prospect of these polymer-based nanoparticle drug carriers in the drug controlled release system was looked forward to.
polymer;nanoparticle carrier;drug controlled release
O 636
A
1672-5425(2013)03-0006-04
10.3969/j.issn.1672-5425.2013.03.002
陕西省教育厅科研计划资助项目(11JK0694),西安医学院博士科研启动基金资助项目(2011DOC05),陕西省教育厅产业化培育项目(08JC18),陕西省卫生厅科研资助项目(2012D14)
2012-12-06
余丽丽(1983-),女,浙江衢州人,博士,讲师,研究方向:新型高分子材料,E-mail:yulili0218@163.com。
