帕瑞昔布钠切皮前给药对胃癌根治术患者细胞免疫功能的影响
2013-07-16战爱玲向红秦成名
战爱玲 李 清 罗 向红 向 勇 秦成名
免疫功能减低容易引起肿瘤的发展与转移,手术创伤及术后疼痛会引起免疫功能减低,在围术期使用镇痛药物可以减轻手术创伤和术后疼痛引起的免疫功能减低[1,2]。不同的术后镇痛药物对免疫功能影响不同[3]。本研究旨在观察帕瑞昔布钠术前给药联合患者自控静脉镇痛对肿瘤患者术后免疫功能的影响,为肿瘤患者选择合适的联合镇痛方案,免疫抑制副作用最小,术后免疫调节平衡提供参考。
1 资料与方法
1.1 一般资料 选择ASAⅠ或Ⅱ级胃癌根治术患者40例,年龄40~65岁,体重55~75 kg,既往无麻醉药过敏史,无明显心肺疾病,术前未进行过化学治疗和放射治疗,近3个月内未使用过镇痛药物。随机分为帕瑞昔布钠组和对照组,每组20例。帕瑞昔布钠组切皮前15 min静脉注射帕瑞昔布钠40 mg,术毕2组患者均采用舒芬太尼患者自控静脉镇痛(PCIA)。2组患者的性别比、年龄、体重、ASA分级、手术时间之间差异均无统计学意义(P >0.05)。
1.2 麻醉与术后镇痛方法 术前30 min肌内注射苯巴比妥钠0.1 g和阿托品0.5 mg。采用静脉复合气管内插管全麻。麻醉诱导用药为丙泊酚 2 mg/kg、芬太尼 3 μg/kg、维库溴铵0.15 mg/kg气管插管后机械通气。麻醉维持为丙泊酚5 mg·kg-1·h-1根据瑞芬太尼 0.1 ~0.2 μg·kg-1·min-1静脉泵连续输注,吸入1%~3%七氟醚及间断给予维库溴铵维持肌松。术毕待患者自主呼吸恢复后,应用新斯的明2 mg和阿托品1 mg拮抗残余肌松药作用,拔除气管导管。帕瑞昔布钠切皮前镇痛组患者于切皮前15 min静脉注射帕瑞昔布钠40 mg,对照组不给予任何药物,术毕2组患者同时行舒芬太尼PCA,PCA泵配置方案为:舒芬太尼2 μg/kg+0.9%氯化钠注射液共100 ml,镇痛泵参数设定为:负荷量 0.1 μg/kg持续输注量2 ml/h,PCA量2 ml,锁定时间为10 min。术后48 h停用镇痛泵。
1.3 观察指标与检测方法分别于麻醉(T0)、术毕4 h(T1)、术毕8 h(T2)、术毕12 h(T3)、术毕24 h(T4)、术毕48 h(T5)6个时间点抽取外周静脉血10ml,用FACS流式细胞仪(美国BD公司)检测T淋巴细胞亚群细胞分化抗原(CD3+、CD4+、CD8+、CD4+/CD8+)及NK细胞活性(美国BD公司单克隆抗体)。采用视觉模拟评分法(VAS)评估手术后 4、8、12、24、48 h 2组患者的疼痛评分,0分为无痛,10分为无法忍受的剧痛。评价:VAS<3分为镇痛效果良好,3~4分为镇痛效果基本满意,>5分为镇痛效果差。同时观察术后24 h内不良反应,如恶心呕吐、尿潴留、头晕、胸部不适、呼吸抑制等。
1.4 统计学分析应用SPSS 13.0统计软件,计量资料以±s表示,采用t检验,组内不同时间点的比较采用重复测量方差分析,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组镇痛效果的比较 与对照组比较,镇痛组术后4、8、12、24、48 h VAS 评分明显降低(P <0.05或 <0.01)。见表 1。
表1 2组术后各时间点VAS评分比较n=20,±s

表1 2组术后各时间点VAS评分比较n=20,±s
注:与 B 组比较,*P < 0.05,#P <0.01
组别T1 T2 T3 T4 T5 A 组 2.8 ±0.5* 2.2 ±0.4# 1.8 ±0.3# 1.3 ±0.2# 1.0 ±0.2*B组3.6 ±0.8 3.8 ±0.4 3.1 ±0.6 2.0 ±0.5 1.5 ±0.3
2.2 不良反应 对照组不良反应的总例数为8例,镇痛组发生不良反应为2例,2组比较差异无统计学意义(P<0.05)。见表2。
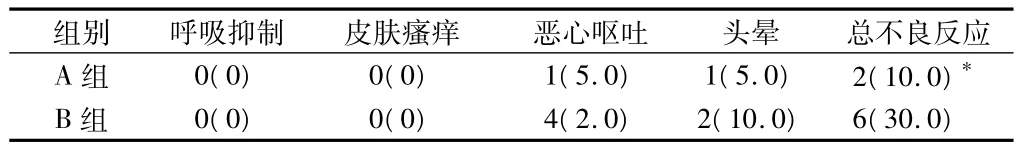
表2 2组患者术后不良反应发生情况n=20,例(%)
2.3 2组T淋巴细胞亚群及NK细胞的比较 2组患者两组T1~T4 时 CD3+、CD4+、CD8+、CD4+/CD8+、NK 细胞值较 T0均显著降低(P <0.05),至T5时基本恢复至T0水平,但A组在 T1、T2、T3、T4 时 CD3+、CD4+、CD8+、CD4+/CD8 及 NK 细胞下降幅度均显著低于B组(P<0.05)。见表3。
表3 2组各时间点T淋巴细胞亚群及NK细胞比较n=20,±s
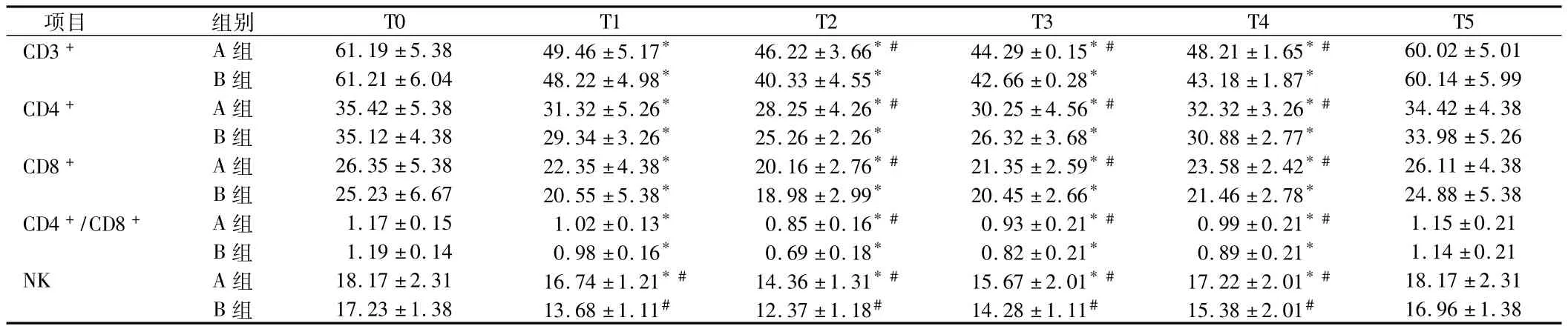
表3 2组各时间点T淋巴细胞亚群及NK细胞比较n=20,±s
注:与T0比较,*P < 0.05;与B组比较,#P < 0.05
T0 T1 T2 T3 T4 T5 CD3+ A 组 61.19 ±5.38 49.46 ±5.17* 46.22 ±3.66*# 44.29 ±0.15*# 48.21 ±1.65*#项目 组别60.02 ±5.01 B 组 61.21 ±6.04 48.22 ±4.98* 40.33 ±4.55* 42.66 ±0.28* 43.18 ±1.87* 60.14 ±5.99 CD4+ A 组 35.42 ±5.38 31.32 ±5.26* 28.25 ±4.26*# 30.25 ±4.56*# 32.32 ±3.26*# 34.42 ±4.38 B 组 35.12 ±4.38 29.34 ±3.26* 25.26 ±2.26* 26.32 ±3.68* 30.88 ±2.77* 33.98 ±5.26 CD8+ A 组 26.35 ±5.38 22.35 ±4.38* 20.16 ±2.76*# 21.35 ±2.59*# 23.58 ±2.42*# 26.11 ±4.38 B 组 25.23 ±6.67 20.55 ±5.38* 18.98 ±2.99* 20.45 ±2.66* 21.46 ±2.78* 24.88 ±5.38 CD4+/CD8+ A 组 1.17 ±0.15 1.02 ±0.13* 0.85 ±0.16*# 0.93 ±0.21*# 0.99 ±0.21*# 1.15 ±0.21 B 组 1.19 ±0.14 0.98 ±0.16* 0.69 ±0.18* 0.82 ±0.21* 0.89 ±0.21* 1.14 ±0.21 NK A 组 18.17 ±2.31 16.74 ±1.21*# 14.36 ±1.31*# 15.67 ±2.01*# 17.22 ±2.01*# 18.17 ±2.31 B 组 17.23 ±1.38 13.68 ±1.11# 12.37 ±1.18# 14.28 ±1.11# 15.38 ±2.01#16.96 ±1.38
3 讨论
研究发现,癌痛患者自身免疫功能低下,同时精神因素、麻醉、手术创伤、术后疼痛对机体的刺激等,经过机体的下丘脑-垂体-肾上腺皮质轴系及交感神经-肾上腺髓质系统的兴奋,进一步使机体免疫功能受到抑制,这可使感染的易感性和残留肿瘤细胞的生存机率增加[1];同时应激引起的内源性儿茶酚胺、糖皮质激素和前列腺素增加均可造成机体免疫功能下降,导致术后残余肿瘤细胞扩散或转移机率增加[2]。使用临床常规阿片类镇痛药可抑制术后疼痛应激反应,但另一方面这些药物本身也对免疫系统功能产生直接或间接的影响[3]。因此,使用有效的联合镇痛方案缓解术后疼痛不仅可减轻患者主观感觉上的痛苦,更能适宜地调节机体应激反应,减轻免疫抑制,以达到降低术后感染和肿瘤转移的目的。
帕瑞昔布钠是唯一可静脉注射的COX-2抑制剂,伐地昔布(Valdecoxib)的水溶性非活性前体药物,起效时间为7~13 min,具有强大的镇痛作用。帕瑞昔布钠已被广泛用于口腔科、骨科、关节外科和妇科的术后急性疼痛[4]。在一项随机、对照研究中,静脉注射帕瑞昔布钠40 mg比吗啡4 mg显示了更强的镇痛作用,持续时间更长[5]。在骨科术后多模式镇痛中,帕瑞昔布钠40 mg能够节约阿片类用量的39%。超前镇痛是指在伤害性刺激发生前给予镇痛治疗,防止中枢敏感化发生,从而减轻伤害后疼痛,减少伤害后镇痛药用量。本研究中,于切皮前15 min静脉给予帕瑞昔布钠40 mg,结果显示,配合使用帕瑞昔布钠组术后24 h VAS评分显著低于对照组,舒芬太尼用量明显减少。
外科手术和术后疼痛可使血浆皮质醇、儿茶酚胺、前列腺素的分泌急剧增加,从而降低围术期的免疫功能,T淋巴细胞在免疫应答、免疫调节中占有重要角色[6],CD3+代表细胞免疫的总体水平,成熟T淋巴细胞可分CD4+和CD8+两个亚群,CD4+可协助B细胞产生抗体和辅助其他细胞参与免疫应答,为辅助T淋巴细胞,CD8+可抑制B细胞产生抗体和抑制其体细胞的免疫功能,CD4+/CD8+降低提示免疫功能低下,是疾病恶化和预后不良的重要标志。NK细胞具有广泛的抗肿瘤作用,下降表示机体免疫功能受到抑制。本研究表明,胃癌根治术患者T淋巴细胞亚群和NK细胞的数量在手术开始后4 h开始下降,术后24 h达到最低,术后48 h回升至麻醉前水平,提示帕瑞昔布钠超前镇痛对机体的免疫功能有保护作用。
舒芬太尼是芬太尼的N-4噻芬基衍生物,是一种高选择性的受体激动药,亲脂性约为芬太尼的2倍,更易透过血-脑脊液屏障,其与阿片受体亲和力高,镇痛作用是芬太尼的5~10倍[7],是目前芬太尼家族中镇痛作用最强的人工合成类阿片药,用于术后PCA镇痛作用确切,并具有安全范围宽、起效快、镇痛作用强、持续时间久、心血管稳定性好、呼吸抑制短而弱、无组胺释放等优点,临床上应用术后PCA已逐渐增多,但舒芬太尼并非理想的术后镇痛药物,大量使用阿片类药物会引起许多围术期不良反应,如呼吸抑制、困倦和镇静、术后恶心呕吐、瘙痒、尿潴留、肠梗阻和便秘,甚至可以引起药物的依赖性,是限制其单独用于术后镇痛的主要原因。本研究结果显示,帕瑞昔布钠联合舒芬太尼多模式镇痛,镇痛效果佳,免疫抑制低,有助于患者术后恢复,值得临床应用和推广,但具体用法、用量及作用机制还有待于进一步研究。
1 Wieseler-Frank J,Maier SF,Watkins LR.Immune-to-braincommunication dynamically modulates pain:physiological andpathological consequences.Brain Behav Immun,2005,19:104-111.
2 Ranganathan AC,Adam AP,Aguirreghiso JA,et al.Opposing roles of mitogenic and stress signaling pathways in the induction of cancer dormancy.Cell Cycle,2006,5:1799-1807.
3 陈东生,王宏梗.术后镇痛与免疫.中国误诊学杂志,2009,9:517-519.
4 Riest G,Peters J,Weiss M,et al.Preventive effects of perioper-ative parecoxib on post-discectomy pain.Br J Anaesth,2008,100:256-262.
5 Barton SF,L angeland FF,Snabes MC,et al.Efficacy and safety of intravenous parecoxib sodium in relieving acute postoperative pain following gynecologic laparotomy surgery.Anesthesiology,2002,97:306-314.
6 梁振涛,王宪沛,曾秋棠,等.胺碘酮对KV1.3通道电流的阻断和体外激活T淋巴细胞表型的影响研究.中国药房,2008,19:1464.
7 庄心良,曾因明,陈伯銮主编.现代麻醉学.第3版.北京:人民卫生出版社,2004.524.
