高效液相色谱-串联质谱法测定人尿液中5种酚类内分泌干扰物
2013-07-13夏同伟刘良坡张文静申河清
夏同伟,刘良坡,张文静,申河清
(1.中国地质大学(武汉) 环境学院,湖北 武汉 430074;2.中国科学院 城市环境研究所,福建 厦门 361021;3.厦门大学 海洋与地球学院,福建 厦门 361005)
环境内分泌干扰物(Endocrine disrupting chemicals,EDCs)指一些外源性物质,它们会导致未受损伤的有机体发生逆向健康影响,或使有机体后代的内分泌功能发生改变。EDCs具有生殖发育毒性,有些还具有持久性和生物累积性[1]。生物检测结果表明人体的尿液、乳汁、血液和精液等体液及组织(如胎盘)中均含有双酚 A(BPA)[2-7]和三氯生(TCS)[8-11]。BPA 对大鼠和小鼠具有发育毒性[12],并且能干扰雄性生殖活动的某些机制,影响机体的免疫功能[13]。TCS能在各种生物体内累积和富集,且能够诱发DNA损伤,具有遗传毒性[14]。炔雌酮(EE2)、雌酮(E1)、雌二醇(E2)属于类固醇类环境内分泌干扰物,具有更强的内分泌干扰能力[15-17],其中,E1是E2在体内的主要代谢产物,EE2是人工合成的雌激素,具有极强的雌激素活性,且具有生物蓄积性[18-20]。
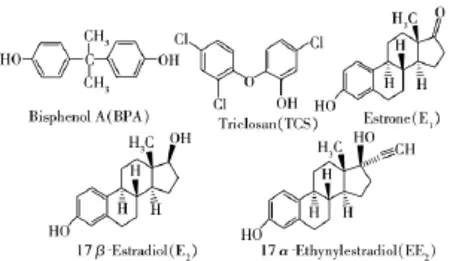
图1 5种酚类化合物的结构式Fig.1 Chemical structures of five phenolic endocrine disrupting chemicals(EDCs)
目前检测水环境中BPA、TCS、E1、E2和EE2的方法已较为成熟[21-22]。配备通用电喷雾离子源的高效液相色谱-串联质谱(HPLC-ESI MS/MS)技术具有较高的灵敏度、选择性和重现性,可确保复杂基质中目标分析物的准确定量,也是目前分析环境内分泌干扰物的常用检测方法[14,23]。但鲜有采用HPLCESI MS/MS技术同时测定人尿液中这5种污染物的相关文献报道。本研究运用液-液萃取的前处理方法,建立了HPLC-ESI MS/MS结合稳定性同位素稀释的分析技术,并将其应用于成人尿液中BPA、TCS、E1、E2和EE25种酚类化合物的含量测定(化学结构式见图1),同时对成人尿液中上述酚类化合物的暴露情况作了初步评价。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪(日本岛津);Applied Biosystems/MSD SCIEX质谱仪(美国应用生物系统公司);氮吹仪(天津市恒奥科技发展有限公司);涡旋振荡器(海门市其林贝尔仪器制造有限公司);Mikro22k离心机(德国Hettich公司);超纯水装置(美国Pall公司)。
标准品:BPA(美国AccuStandard标准品公司);TCS和E1(纯度均>98%,美国Sigma-Aldrich公司);E2和EE2(德国Dr.Ehrenstorfer化学标准品公司);3种定量内标溶液为13C12BPA、13C12TCS(Cambridge Isotope Laboratories Ins,USA)和 E2- D4(C/D/N Isotopes,Inc,Pointe - Claire,Quebec,Canada);E1、E2和EE2用E2-D4作为内标进行定量。乙腈、甲醇、正己烷、丙酮(色谱纯,美国Honeywell公司);甲酸(分析纯,中国上海试剂总厂);超纯水(Cascada TM AN,美国Pall公司)。
1.2 实验条件
1.2.1 质谱条件 离子源:电喷雾离子源(ESI+);检测方式:多反应监测(MRM);离子源温度:450℃;离子喷雾电压:4 500 V;气帘气:10.0 psi;碰撞活化解离:中度。5种酚类化合物及内标物的质谱参数见表1。
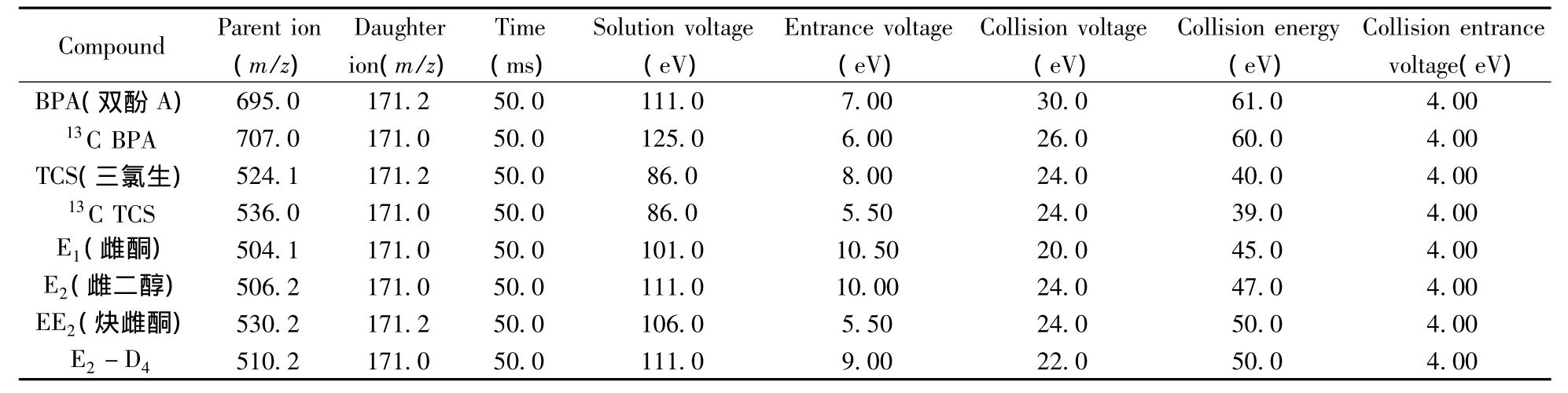
表1 5种酚类化合物及内标物的质谱参数Table 1 Optimized parameters of five EDCs and internal standard substances
1.2.2 色谱条件 色谱柱:Phenomenex Kinetex C18(3 μm,100 mm×4.6 mm i.d.);流动相:0.1%甲酸水溶液(A)-甲醇(B),线性梯度洗脱:0~5 min,由55%B线性变为95%B,然后保持5 min,最后6 min由95%B线性降至55%B;柱温:35℃;进样体积:20 μL;洗脱流速:0.6 mL/min。
1.3 样品处理
1.3.1 酶 解 将储存于-80℃的尿液自然解冻,准确移取1 mL尿液于15 mL试管中,依次加入20 μL 5 μg/L的定量内标溶液和1 mL pH 4.5的NaAc-HAc(0.15 mol/L)缓冲溶液以及10 μL的葡萄糖酸(150 units/mL的β-葡萄糖酸酶+4.2 units/mL的硫酸酯酶),混合均匀,37℃条件下酶解2 h。
1.3.2 衍 生 酶解后的尿样采用液-液萃取法提取目标物,每次加3 mL正己烷,萃取2次,合并正己烷萃取液,氮气吹干后,依次加入0.5 mL丙酮、100 μL 1 mg/L溶解于丙酮的丹磺酰氯,以及100 μL pH 10.5的Na2CO3(0.1 mol/L)缓冲溶液,混合均匀,50℃温浴30 min进行衍生反应。衍生后,用正己烷再次萃取,每次加3 mL,萃取2次,离心分层,合并正己烷萃取液,氮气吹干;用甲醇定容至200 μL;7 000 r/min离心或过膜,收集上清液,待HPLC-ESI MS/MS分析。
1.4 定性与定量分析
以相对保留时间和被测物相应的监测离子的丰度进行定性分析。分别将系列标准溶液和试样注入HPLC-MS/MS系统,记录5种酚类化合物的峰面积以及相应的同位素的峰面积。利用1.5 Version analyst software软件建立的定量分析方法,以各系列标准液的进样浓度与对应的内标峰面积比绘制线性定量曲线,根据定量分析软件进行定量分析。
1.5 质量控制与保证(QA/QC)
为保证测定结果的准确性,每批14个样品,包含2个方法空白和4个质量控制(两个低浓度和两个高浓度),实际样品的含量扣除空白值。样品处理前均加入同位素内标。空白加标进行回收率实验,测定结果进行回收率校正。
2 结果与讨论
2.1 样品前处理条件的选择
参考相关文献,本实验选择正己烷作提取溶剂,采用液-液萃取法提取,取得了较好的效果。由于所研究酚类化合物在尿液中主要以葡萄糖醛苷或硫酸芳酯结合的不同形式存在,所以需要对样品进行酶解[24],将待测目标物从其共轭化合物中完全释放出来。比较了加入不同单位的酶的效果,发现加入10 μL葡萄糖酸(150 units/mL的β-葡萄糖酸酶+4.2 units/mL的硫酸酯酶)后可使目标化合物从其共轭化合物中完全释放。由于尿液中目标分析物的含量很低(μg/L级),为了提高液相色谱-质谱的检测灵敏度和准确度,采用丹磺酰氯[25]对待测物进行衍生化处理。考察了加入不同体积(10、50、100、150 μL)质量浓度为1 g/L的丹磺酰氯作衍生剂时对目标物强度的影响,结果显示,目标物的信号强度随着丹磺酰氯体积的增加而增强,当加入量大于100 μL时目标化合物的响应强度无明显变化,本实验选择加入100 μL 1 g/L的丹磺酰氯为衍生剂。
2.2 流动相的选择
目标分析物的良好分离对于检测方法的建立有着重要作用。参考血浆中有关雌激素的测定方法[25-28],通过预实验,优化流动相、流动相比例。考察了乙腈-水和甲醇-水两组流动相体系对目标化合物的离子化程度及分离效果的影响。结果发现,以甲醇-水体系梯度洗脱时5种酚类化合物的分离效果较好,因此实验选用甲醇-水作为流动相。正离子检测模式下,为提高待测物的离子化效率,获得最佳的分辨率和较高的灵敏度,在流动相中加入0.1%(体积分数)甲酸进行缓冲以增加5种酚类化合物的电离效率和抑制色谱峰拖尾。
2.3 质谱条件的选择
为了获得高灵敏度的质谱条件,采用流动注射分析仪将经丹磺酰氯衍生后的1 mg/L的5种酚类化合物及其同位素单标溶液直接注入质谱检测器,先用全扫描(Scan)模式得到准分子离子,再采用选择离子(SIM)方式进行采集,以获得较好的质谱条件。5种酚类化合物的监测离子参数见表1。5种酚类化合物及其同位素的标准提取离子流色谱图如图2所示。成人尿液中5种酚类化合物的提取离子流色谱图如图3所示。
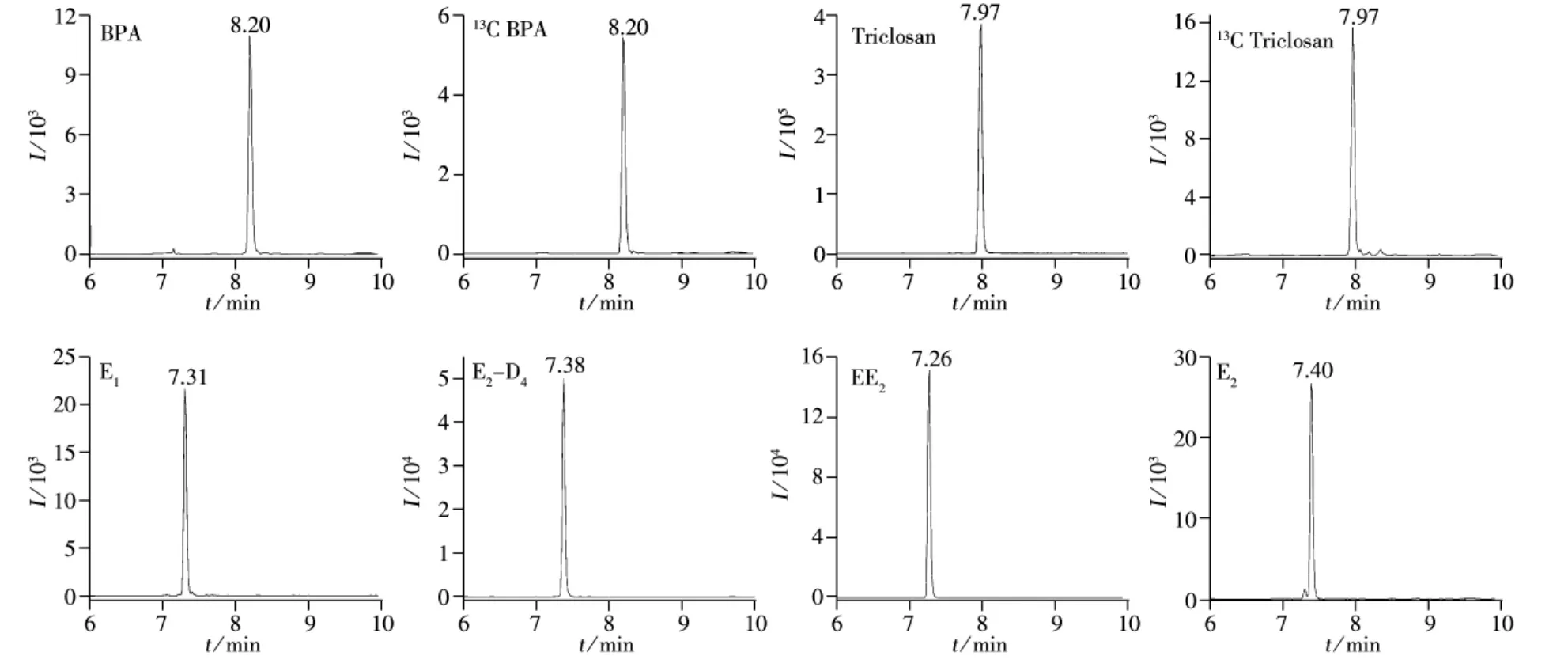
图2 5种酚类化合物的标准提取离子流色谱图Fig.2 Extracted ion chromatograms of five EDCs standard
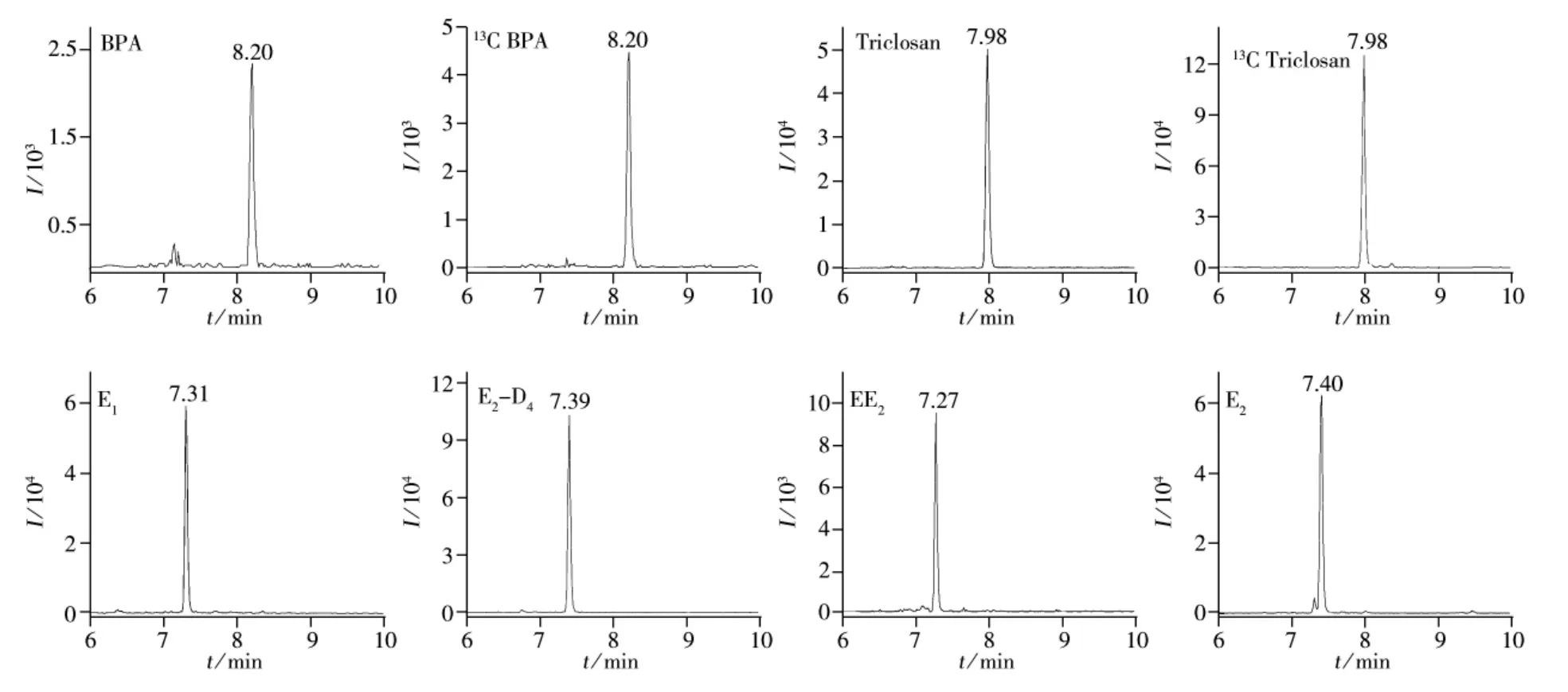
图3 成人尿液中5种酚类化合物的提取离子流色谱图Fig.3 Extracted ion chromatograms of five EDCs in adult urine
2.4 空白基质的选择
采用含5种酚类化合物浓度极低的尿液作为基质空白。将加入一定量活性炭粉末的尿样于4℃条件下恒温搅拌10 h,以充分吸附酚类化合物。3 000 r/min离心分离10 min后,取上清液,过滤膜后得到含极低浓度的5种酚类化合物的空白尿液,4℃条件下保存待用。
2.5 线性关系与检出限
以甲醇配制浓度分别为0、0.05、0.2、1.0、5.0、25、50、100 μg/L的5种酚类化合物混合标准系列溶液,内标浓度均为5.0 μg/L。以各目标化合物与内标物峰面积的比值(Y)对目标化合物的质量浓度(X)绘制标准曲线,目标物信号强度在0.2~100 μg/L浓度范围内呈良好的线性关系,相关系数r2值均不低于0.998。以信噪比S/N=3作为仪器的检出限(LOD),S/N=10作为仪器的定量下限(LOQ),结合样品前处理的稀释倍数计算得到各化合物的检出限为0.02~0.27 μg/L,定量下限为0.07~0.87 μg/L。表2为5种酚类化合物的线性方程、相关系数、检出限及定量下限。

表2 5种酚类化合物的线性方程、线性范围、相关系数、检出限及定量下限Table 2 Regression equations,linear ranges,correlation coefficients(r2),LODs and LOQs of five EDCs
2.6 准确度与精密度
为评价本方法的准确度,采用“2.4”含有低浓度目标物的尿液进行回收率实验,并以多次测定结果的相对标准偏差(RSD)评价方法的精密度。计算回收率结果时扣除样品的本底值。在空白基质中分别添加低、中、高3个水平的目标分析物,每个加标水平重复测定3次,计算平均加标回收率和相对标准偏差,结果见表3。由表3可见,加标水平为5~50 μg/L时,目标分析物的回收率在85%~125%之间,RSD在0.53%~14.4%之间,表明该方法的准确度和精密度良好。

表3 5种酚类化合物的回收率与精密度(n=3)Table 3 Recoveries and precisions of five EDCs(n=3) /%
2.7 实际样品分析
将建立的方法应用于40个健康成人志愿者尿液中5种酚类化合物的含量测定。结合样品前处理的稀释倍数计算5种酚类化合物的含量,酶解后的测定结果见表4。暴露水平以及相关性分析等后续处理及分析均基于表4所列数据。
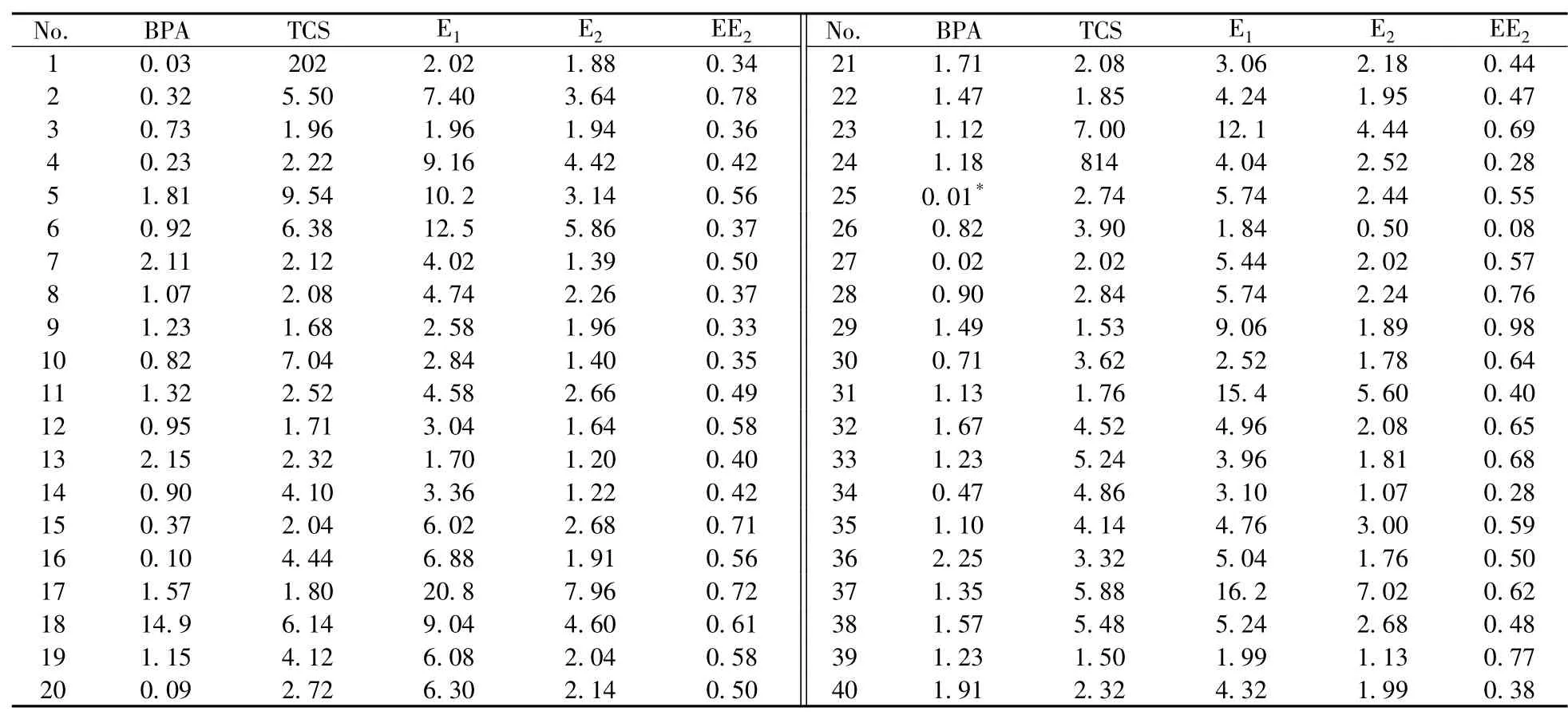
表4 40个志愿者尿液中5种酚类化合物的定量结果Table 4 Quantitative results of five EDCs of 40 volunteers ρ/(μg·L-1)
2.7.1 成人尿液中5种酚类化合物的暴露水平 比较了成人尿液中BPA、TCS、E1、E2和EE2之间的差异,酶解后尿液中酚类化合物的暴露水平如表5所示。结果显示,这5种酚类化合物在所研究人群的尿液中广泛存在,且个体间不同污染物的暴露剂量存在明显差异。不同酚类化合物的暴露剂量不同,平均浓度依次为TCS>E1>E2>BPA>EE2。
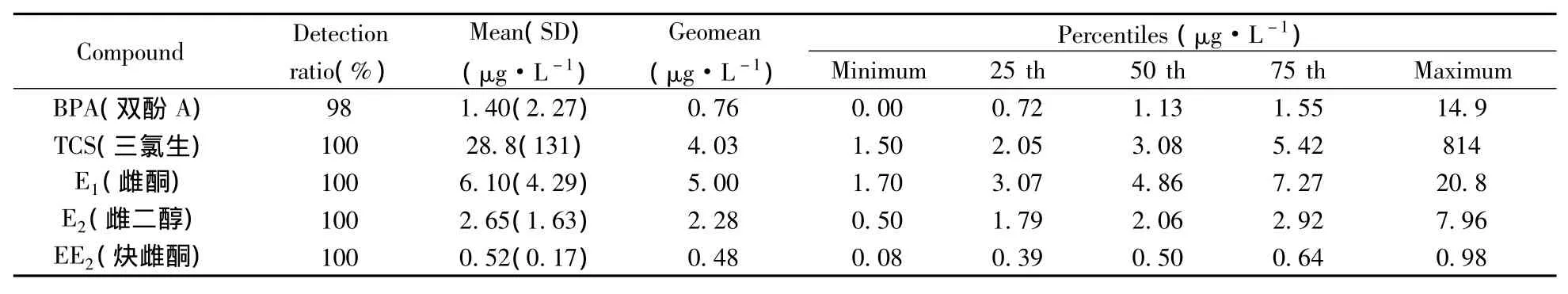
表5 成人尿样中5种酚类化合物暴露水平(n=40)Table 5 The exposure level of five EDCs in adult urine(n=40)
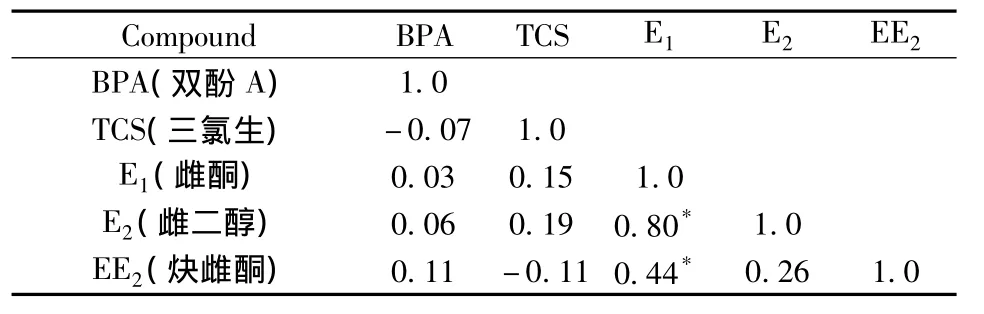
表6 成人尿液中5种酚类化合物的Spearman相关性Table 6 Spearman correlations of five EDCs in adult urine
2.7.2 成人尿液中5种酚类化合物的相关性分析 采用SPSS软件中Shapiro-wilk s W检验对暴露数据进行正态性检验分析,数据呈非正态性,经自然对数转换后仍呈非正态。由于数据呈非正态性,因此采用软件(SPSS 13.0)中的Spearman非参数相关性分析对5种EDCs的数据进行相关性分析,结果见表6。相关性结果显示,E1与E2、EE2呈显著正相关(r=0.80,0.44);E1与BPA和TCS无显著性差异。研究结果表明,E1与E2、EE23种化合物可能具有共同的暴露源,初步的研究结果需要扩大样本量进一步验证。
3 结论
本研究运用液-液萃取的前处理方法,通过优化色谱、质谱条件,建立了用于测定成人尿液中5种酚类化合物的HPLC-ESI MS/MS结合稳定性同位素稀释的分析方法,并对尿样中5种酚类化合物的暴露水平进行了评价。实验结果表明,所研究人群广泛暴露于这5种酚类化合物,且E1与E2、EE2相关性较高,它们可能具有共同的暴露源。该方法灵敏度高、重现性好、回收率高、操作简单,适合于尿液中5种酚类化合物的暴露评价分析。
[1] Liu Z T,Xu J B,Yang L.Res.Enviorn.Sci.(刘征涛,徐静波,杨丽.环境科学研究),2001,14(3):1-3.
[2] Sch nfelder G,Wittfoht W,Hopp H,Talsness C E,Paul M,Chahoud I.Environ.Health Perspect.,2002,110(11):A703-A707.
[3] Inoue K,Yamaguchi A,Wada M,Yoshihiro Y,Tsunehisa M,Hiroyuki N.J.Chromatogr.B,2001,765(2):121-126.
[4] Otaka H,Yasuhara A,Morita M.Anal.Sci.,2003,19(12):1663 -1666.
[5] Inoue K,Wada M,Higuchi T,Oshio S,Umeda T,Yoshimura Y,Nakazawa H.J.Chromatogr.B,2002,773(2):97-102.
[6] Calafat A M,Kuklenyik Z,Reidy J A,Caudill S P,Ekong J,Needham L L.Environ.Health.Perspect.,2005,113(4):391-395.
[7] He Y,Miao M,Herrinton L J,Wu C,Yuan W,Zhou Z.Environ.Res.,2009,109(5):629 -633.
[8] Calafat A M,Ye X,Wong L Y,Reidy J A,Needham L L.Environ.Health Perspect.,2008,116(3):303-307.
[9] Allmyr M,Adolfsson-Erici M,McLachlan M S,Gunilla S E.Sci.Total.Environ.,2006,372(1):87-93.
[10] Kim K,Park H,Yang W,Lee J H.Environ.Res.,2011,111(8):1280-1285.
[11] Wu J,Leung K F,Tong S F,Lam C W.Rapid.Commun.Mass Spectrom.,2012,26(2):123-132.
[12] Morrissey R E,George J D,Price C J,Tyl R W,Marr M C,Kimmel C A.Fund.Appl.Toxicol.,1987,(8):571-582.
[13] Sakazaki H,Ueno H,Nakamuro K.Toxicol.Lett.,2002,133(2/3):221 -229.
[14] Li L P,Ma H M,Hu J J,Li Y H,Wang Y P,Sheng G Y.Ecol.Environ.Sci.(李林朋,马慧敏,胡俊杰,黎玉华,王艺陪,盛国英.生态环境学报),2010,19(12):2897-2901.
[15] Hanselman T A,Graetz D A,Wilkie A C.Environ.Sci.Technol.,2003,37(24):5471 -5478.
[16] Grover D P,Zhang Z L,Readman J W,Zhou J L.Talanta,2009,78(3):1204-1210.
[17] Yan W,Lin J M.Chin.J.Anal.Chem.(严炜,林金明.分析化学),2010,38(4):598-606.
[18] Segner H,Navas J,Sch fers C,Wenzel A.Ecotoxicol.Environ.Safe.,2003,54(3):315 -322.
[19] Zhang H,Kong F X,Wang S H,Yu Y,Zhang M.Environ.Toxicol.,2009,24(5):484-491.
[20] Pérez M R,Fernandino J I,Carriquiriborde P,Somoza G M.Environ.Toxicol.Chem.,2012,31(5):1 -6.
[21] Jia Y B,Wang H Q,Han L M.J.Instrum.Anal.(贾彦博,王红青,韩里明.分析测试学报),2011,30(7):808-812.
[22] Ding B,Yin P H,Liu Y F,Li Q.J.Instrum.Anal.(丁博,尹平河,刘玉芳,李蔷.分析测试学报),2010,29(11):1190-1193.
[23] Chen T,Yun X,Na G S,Zhang Y M,Yao Z W.Chin.J.Anal.Lab.(陈彤,云霞,那广水,张月梅,姚子伟.分析试验室),2009,28(11):41-44.
[24] Jan F V B,Karine M C,Willy E L,Leenheer A P D.Clin.Chem.,1997,43(4):627-634.
[25] Hong C,Yi W,Jonathan N,Zhang X W,Steve W,Markus H,Michael H W L,John P G,Jones P D.J.Chromatogr.A,2010,1217(4):506-513.
[26] Hoover R N,Hyer M,Pfeiffer R M,Adam E,Bond B,Cheville A L,Colton T,Hartge P,Hatch E E,Herbst A L,Karlan B Y,Kaufman R,Noller K L,Palmer J R,Stanley J,Robert C R,Strohsnitter W,Linda T E,Troisi R N.Engl.J.Med.,2011,365(14):1304-1314.
[27] Tatsuya K,Jeffrey W F,Kurunthachalam K.Anal.Chem.,2011,83(1):417-424.
[28] Mark M K,Alan L R,Jonas B,Marina V,William L R,Yue B F,Bunker A M,Wayne M.Am.J.Clin.Pathol.,2008,129(4):530-539.
[29] Liu L P,Bao H Q,Liu F,Zhang J,Shen H Q.Environ.Int.,2011,42:78-83.
