以离子液体作流动相添加剂高效液相色谱法分离辣椒素类生物碱
2013-07-13边敏,杨勇,周昊
边 敏,杨 勇,周 昊
(1.南京工业大学 理学院,江苏 南京 210009;2.南京中医药大学 药学院,江苏 南京 210046)
辣椒素类生物碱是一类由茄科植物辣椒的成熟果实中提取得到的辛辣有效成分,主要包括辣椒碱(Capsaicin,CAP)、二氢辣椒碱(Dihydrocapsaicin,DHC)和降二氢辣椒碱(Nordihydrocapsaicin,NDHC),其中辣椒碱与二氢辣椒碱为辣椒中的主要成分,约占辣椒总含量的90%[1]。3种化合物结构式见图1。
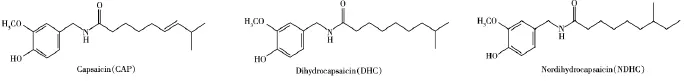
图1 辣椒素类生物碱的化学结构式Fig.1 Chemical structures of capsaicin-type alkaloids
目前辣椒素类生物碱在临床上已有较多应用[2-5],分离测定方法主要有HPLC、GC-MS和LCMS[6-8]。其中GC-MS在测定时为增加样品的挥发性,需要提前衍生化,LC-MS的测定成本较高,故辣椒素类生物碱的分离测定以液相色谱为主。为了提高分离度,现多采用增加色谱柱长度和梯度洗脱的方法来实现分离。本课题组前期的研究结果表明,以室温离子液体(RTILs)为流动相添加剂分离生物碱可获得良好的分离效果[9],故本研究拟利用离子液体作为流动相添加剂分离辣椒素类生物碱,考察分离条件及影响因素,并利用溶质计量置换保留模型(SDM-R),初步探讨分离机理,为此类生物碱的分离提供了新的方法和思路。
1 溶质计量置换保留模型
溶质计量置换保留模型的简化数学表达式为[10]:

其中k'为容量因子,αD为流动相中置换剂的活度,线性参数lgI和Z均为常数。lgI表示1 mol溶质对固定相的亲和势,Z表示1 mol溶剂化溶质被溶剂化固定相吸附时在两者的接触表面上释放出置换剂的摩尔总数。
根据该模型,实验中分别考察了甲醇及离子液体浓度变化与组分容量因子的关系,以此确定在此保留过程中的置换剂,初步探讨离子液体在分离过程中的作用机理。
2 实验部分
2.1 仪器与试剂
Shimadzu高效液相色谱系统:LC-20AD泵,SPD-20A检测器,7125进样器,Class-VP色谱工作站。pHs-3C精密pH计、E-201-C pH复合电极(上海精密科学仪器有限公司)。
辣椒碱、二氢辣椒碱标准品(美国Sigma公司);离子液体CnminBF4(n=1、2、4、6、8、10、12),1-丁基-3-甲基咪唑氯化盐(BmimCl)根据文献报道合成[11-12],经莫尔法、分光光度法测定纯度大于97%;甲醇(色谱纯,Concord);磷酸(优级纯,国药集团化学试剂公司);实验用水为三蒸水(自制)。
2.2 实验方法
2.2.1 溶液的配制 分别精密称取辣椒碱、二氢辣椒碱标准品适量,置于25 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,得辣椒碱质量浓度为407 mg·L-1、二氢辣椒碱质量浓度为411 mg·L-1的标准品贮备液。移取两种贮备液各5.0 mL至250 mL容量瓶中,甲醇稀释定容,摇匀得标准品混合液。标准溶液保存于4℃冰箱内。使用时放至室温,过0.45 μm滤膜。
2.2.2 色谱条件 色谱柱:ODS柱(4.6 mm×150 mm,5 μm,Agilent TC-C18),等度洗脱,流动相:甲醇-水(30∶70),流速:0.7 mL·min-1,检测波长:280 nm,柱温:25℃。另向流动相中以5.2 mmol·L-1的浓度加入 BmimBF4。
3 结果与讨论
3.1 色谱条件的优化
分别以甲醇-水(30∶70)、甲醇-水(40∶60)、甲醇-水(30∶70,加入BmimBF4作添加剂)为流动相,考察了不同流动相体系对辣椒素类生物碱的保留效果及影响(见图2)。由图可知:①CAP与DHC在无添加剂的甲醇-水系统中即可达基线分离,峰形基本对称(图2A、B)。这是因为两者在结构上仅饱和度不同,与DHC相比,CAP增加1个不饱和双键,保留减小。同时由于其碱性较弱,在此分离条件下多数呈非质子化形式,与反相柱的残余硅羟基作用较弱,故几乎无拖尾;②CAP与NDHC在无添加剂流动相体系中无法达到基线分离(图2A、B)。这是因为与CAP相比,NDHC虽然少了不饱和双键,保留增大,但同时碳链变短,疏水性减弱,保留减小。总的作用结果使得两者在甲醇-水体系中的保留特性接近;③在流动相中加入低浓度的BmimBF4(5.2 mmol·L-1)后,可使CAP在NDHC之前出峰,并达到基线分离,同时3种生物碱的保留均有所减小,峰形得到改善,分离效率显著提高(图2C)。说明在此类生物碱的分离过程中,离子液体的加入使各组分的保留减小,但同时也可选择性地使NDHC的保留相对增大,提高了其与CAP的分离度。

图2 辣椒素类生物碱的色谱图Fig.2 Chromatograms of capsaicin type alkaloids
3.2 流动相中甲醇含量对分离特性的影响
根据公式(1),如将有机溶剂设为置换剂,且有机溶剂浓度与组分保留值之间呈线性关系,则说明有机溶剂是优先将固定相溶剂化,并作为流动相的强溶剂在分离过程中起主导作用,而离子液体的作用则以离子对试剂为主。将室温离子液体设为置换剂,若离子液体的浓度与组分保留值满足公式(1),即说明在整个分离过程中,离子液体优先被吸附到固定相上,将固定相溶剂化,其与被分离组分之间的作用以竞争吸附为主。故在实验中,分别配制含不同比例甲醇的流动相,考察有机相比例对分离的影响。结果见图2A、B。当甲醇含量降低时,组分的保留相应增强,分离度略有提高,但无法使CAP与NDHC达到基线分离。向流动相中加入5.2 mmol·L-1的BmimBF4,并分别配制体积比为25∶75、30∶70、35∶65、40∶60的甲醇-水流动相,考察甲醇含量对组分保留的影响。结果显示各组分的保留随甲醇含量的减少而增加,分离效率基本不变。根据式(1),将组分容量因子与甲醇体积比求对数线性关系,得SDM-R线性参数(见表1)。
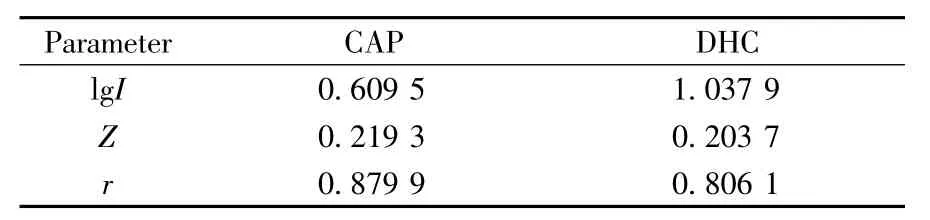
表1 甲醇作置换剂时SDM-R各参数值Table 1 Stoichiometric parameters of different analytes with methanol as displacer
结果显示,在此分离系统中,若以甲醇为强溶剂,并作为分离过程中的置换剂,组分容量因子与甲醇浓度之间的对数线性关系较差(r<0.9)。说明在此吸附保留过程中,甲醇对固定相的溶剂化作用并不占主导地位,不参与组分在固定相上的竞争吸附。即在此流动相体系中,甲醇仅作为洗脱剂,改变流动相的洗脱能力,但并未参与组分的竞争吸附和保留过程。
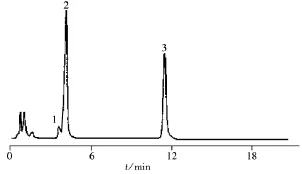
图3 BmimCl为添加剂时的分离色谱图Fig.3 Chromatogram of capsaicin-type alkaloids with mobile phase containing BmimCl
3.3 离子液体种类的选择
分别考察了不同烷基链长度阳离子和不同离液序列阴离子对分离的影响。结果发现,当离子液体阴离子为低离液序列的Cl-时,无论烷基链长度如何变化,均无法实现CAP与NDHC的基线分离,结果见图3。
由图3可见,虽然各组分的峰形明显改善,分离效率提高,但NDHC仍在CAP前出峰,且未达基线分离。只有当阴离子离液序列较高时(如,),两者的出峰顺序改变,并达到基线分离。这可能是因为NDHC与CAP的结构中相差一个不饱和双键,其形成的π电子云与p-π电子云共轭,导致CAP支链上局部电子云密度下降,碱性降低。故在相同化学环境下,CAP大部分以中性分子形式存在,仅有少部分质子化,且质子化的比例小于NDHC。当高离液序列阴离子存在时,CAP形成离子对的比例小于NDHC,保留减小。而低离液序列阴离子无法形成中性离子对[13-14],故无法使两个碱性略有差异的组分分离。因此,本实验采用高离液序列阴离子组成的离子液体,即CnminBF4为添加剂,并进一步考察了CnminBF4链长变化对分离特性的影响,结果见表2。

表2 不同烷基链长离子液体作添加剂分离辣椒素类生物碱的色谱参数值Table 2 Chromatographic parameters with RTILs having different length of alkyl groups as a dditives
由表2可见,随着烷基链长度(n)的增加,各组分的容量因子减小,同时有效理论塔板数增大,CAP与NDHC的分离度先增大后减小。这可能是因为随着烷基链长度的增加,离子液体的疏水性增大,导致离子液体与固定相表面的吸附力更强,与组分竞争吸附的能力增大;同时离子液体的表面张力减小,流动相的表面张力随之减弱且洗脱力增加,组分保留减小。若以有效理论塔板数和分离度为指标衡量分离效率,对于pKa<2的酰胺类生物碱,由高疏水性的长烷基链阳离子和高离液序列阴离子组成的离子液体更适合,且分离时间短、分离效率高。
3.4 离子液体浓度的影响
改变离子液体BmimBF4的浓度(2.6~83.4 mmol·L-1),考察了各组分保留的变化,结果见表3。由表3可见,各组分的保留随离子液体浓度的增大而减小。

表3 不同浓度下不同烷基链长的离子液体作添加剂时各组分的保留值Table 3 Chromatographic parameters with RTILs having different length of alkyl groups and different concentration as additives
将lgk'~lgαD求线性,得SDM-R第一线性方程,各参数值见表4。由表4可见,当n=10时,组分保留随离子液体浓度变化的线性关系下降(r<0.99),说明当烷基链长度增加到一定值时,离子液体在固定相上的亲和势增大,形成的溶剂化层不再是理想的单分子层,组分被吸附至固定相时,被置换到溶液中的溶剂分子数目不再遵循SDM-R中的线性关系。
此外,n=4~8的良好线性关系表明,相比于苦参类生物碱[9],酰胺类生物碱的lgk'与lgαD的线性拟合程度更高,基本可达到r>0.99。这是因为此类生物碱的碱性更弱,在分离过程中以非质子化中性分子存在的比例更多,组分与离子液体的置换吸附作用更强,所以线性关系更明确。该结果进一步证明了当离子液体作添加剂时,非质子化组分分子与离子液体置换剂之间的作用符合SDM-R。

表4 离子液体浓度变化时各组分SDM-R模型的参数值Table 4 Stoichiometric parameters of different analytes with different concentration ionic liquids as displacer
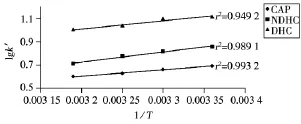
图4 柱温的影响Fig.4 Effect of column temperature
3.5 柱温的影响
考察了柱温(298、303、308、313 K)对组分保留的影响。根据范特霍夫方程(lgk'=ΔH/(RT)+ΔS/(RT)+lgφ),将各组分容量因子的对数与柱温的倒数进行线性拟合,结果见图4。由图可知,柱温升高导致各组分的容量因子依次降低。以lgk'~1/T作图,可得良好的线性关系,符合范特霍夫公式。造成这种现象的原因可能是由于温度对各组分电离常数的影响所致。即随着温度升高,电离常数减弱,形成质子化的比例减小,相应的中性离子对的比例减小,保留减小。故在保证分离度的前提下,此类生物碱的分离可选择在一定温度下进行,本实验选择柱温25℃。
4 结论
本文首次以离子液体为添加剂,建立了以辣椒碱、二氢辣椒碱与降二氢辣椒碱为代表的酰胺类生物碱的分离分析方法,并考察各种因素对分离的影响,利用各组分的色谱参数值建立分离模型,初步探讨其分离机理。结果表明当向流动相中加入由高疏水性的长烷基链阳离子和高离液序列阴离子组成的离子液体时,各组分的峰形得到改善,分离效率明显提高,同时保留减弱。此外,离子液体作为置换剂,其链长、浓度与组分保留值的变化与SDM-R拟合程度较好,即分离作用过程完全符合溶质计量置换模型。
[1] Tu D W,Li Y F.Chin.Agric.Sci.Bull.(屠大伟,李沿飞.中国农学通报),2008,(24):145-148.
[2] Dong J,Zhang G H,Wang H T.Food Sci.Technol.(董静,张国辉,王洪涛.食品科技),2006,(31):601-603.
[3] Zhao R B,Cui T,Guo X M.J.Agric.Univ.Hebei(赵仁邦,崔同,果秀敏.河北农业大学学报),2002,(25):134-136.
[4] Zheng C Q.Chin.J.Ophthalmol.Otolaryngol.(郑春泉.中国眼耳鼻喉科杂志),2001(6):125-127.
[5] Watson C P,Tyler K L.Clin.Ther.,1993,15:510 -526.
[6] Gerardo F B,Miguel P,Carmelo G B.Anal.Chim.Acta,2006,578:227 -233.
[7] Ute S,Reinhold C,Andreas S.Anal.Chim.Acta,2006,557:236 -224.
[8] Manirakiza P,Covaci A,Schepens P.J.AOAC Int.,1999,82:1399 -1406.
[9] Bian M,Zhang Z J,Yin H.J.Pharm.Biomed.,2012,58:163 -167.
[10] Geng X D,Regnier F E.J.Chromatogr.,1984,296:15 -30.
[11] Dyson P J,Srinivasan M C,Vine T,Welton T,Williams D J,White A J P,Zigras T.J.Chem.Soc.Dalton Trans.,1997,19:3465-3469.
[12] Suarez P A Z,Dullius J E L,Einloft S,De Souza R F.Dupont J.Polyhedron,1996,15:1217 -1219.
[13] Hisham H,Thomas J.J.Chromatogr.A,2006,1133:69-75.
[14] Zhao J G,Yao C,Wei Y M,Geng X D.Chin.J.Chromatogr.(赵建国,姚丛,卫引茂,耿信笃.色谱),2001,19:481-484.
