BRD7逆转录病毒稳定系的构建及其功能评价
2013-07-12张如华胡开顺武远众康铁邦
张如华 胡开顺 武远众 康铁邦
•论 著•
BRD7逆转录病毒稳定系的构建及其功能评价
张如华 胡开顺 武远众 康铁邦★
目的探索BRD7(bromodomain-containing protein 7)是否具有抑癌基因的功能。方法根据NCBI提供的BRD7基因序列设计特异性引物扩增其编码区序列,经酶切、连接转化后进一步挑取单克隆菌落进行菌液PCR筛选及测序鉴定得到阳性重组质粒。共转293T细胞后收集浓缩病毒上清并感染U2OS细胞,24 h后用嘌呤霉素(puromycin)筛选稳定表达BRD7的细胞株。结果菌落PCR扩增及DNA测序分析证明重组pMSCV-BRD7-GFP质粒克隆成功。GFP绿色荧光结果显示,绝大部分细胞成功整合了pMSCV-GFP或pMSCV-BRD7-GFP外源质粒;Western blotting检测发现感染重组质粒pMSCVBRD7-GFP的细胞株中BRD7蛋白的表达水平显著高于对照组。功能结果显示,过表达BRD7显著抑制U2OS细胞的增殖,促进下游靶基因p21与MDM2的表达。结论本研究成功构建了针对BRD7基因的逆转录病毒稳定系,且初步证明了BRD7发挥抑癌基因的功能,为下一步深入研究其被调控的机制与功能奠定了基础。
BRD7;病毒载体;稳定株;抑癌基因
Bromodomain蛋白是一类进化上高度保守的由110个氨基酸组成的蛋白元件,对乙酰化的赖氨酸具有高度的亲和性。这种蛋白多数存在于染色质相关蛋白,其名字来源于在果蝇中首先被鉴定的同源蛋白Brahma[1]。因这种Bromodomain结构域能够与特异的乙酰化赖氨酸结合,提示了其可能参与了一些蛋白-蛋白之间的相互作用,特别存在于染色质重建及转录激活过程中[2,3]。组蛋白的乙酰化作为控制开关参与了染色质转录的激活与抑制,乙酰化通过中和组蛋白的正电荷减弱了与DNA的相互作用,从而使得染色质结构松散,增加了转录因子与DNA的结合促进相关基因的转录[4]。含Bromodomain结构域的蛋白常常通过HATs、HDACs与其它一些染色质重建蛋白(Swi2/Snf2,SWI/SNF复合物亚基 ATPase)发挥一系列的染色质修饰作用[5,6]。
BRD7作为一个75 kDa,从低等的果蝇到高等的人类均具有一个保守的bromodomain结构域,与人类锌指蛋白Peregrin、BR140具有最大的相似性,高表达于睾丸精原细胞[7]。BRD7包含一个Bromodomain,提示其在染色质重建及转录调控中发挥重要作用。而且BRD7与超乙酰化的组蛋白H3和H4共定位,与乙酰化Lys14的H3紧密结合而与非乙酰化的或乙酰化Lys9结合松散[8,9]。BRD7也与激活的DNA聚合酶Ⅱ共定位而不是SWI/SNF染色质重建复合物的成分BRG1[9]。BRD7不具有组蛋白乙酰转移酶活性,其过表达并不能增加组蛋白的乙酰化进而不能大范围地参与染色体的重建过程[10]。对于BRD7在细胞周期的功能及作用机制目前报道很少。在本研究中,拟选用骨肉瘤细胞系U2OS构建BRD7高表达的逆转录病毒载体pMSCV-BRD7-GFP,并构建能稳定高表达BRD7的细胞系,为进一步研究BRD7在细胞周期中被调控的机制与功能奠定基础。
1 材料和方法
1.1 材料与试剂
U2OS和HEK293T细胞由中山大学肿瘤防治中心保存。pMSCV-GFP逆转录病毒载体(含有嘌呤霉素抗性基因)及病毒包装质粒E vector、G vector为中山大学孙逸仙纪念医院尹东教授馈赠。BglⅡ、Xho I 内切酶以及逆转录试剂盒均为Fermentas公司产品, 高保真酶PrimeSTAR Max DNA Polymerase与T4 DNA Ligase购自Takara公司,质粒小提试剂盒和切胶回收试剂盒均购自Qiagen公司。Trizol试剂和脂质体转染试剂Lipofectamine2000购自Invitrogen公司。兔抗人BRD7多克隆抗体为Bethyl公司产品, 鼠抗人GAPDH 抗体购自Santa Curz 公司,感受态细胞DH5α以及HRP羊抗兔和鼠二抗均购自北京鼎国生物技术有限公司。PEG-8000、Polybrene和puromycin均购自Sigma公司。
1.2 实验方法
1.2.1 293T细胞总RNA 的提取
按照Trizol 试剂说明书步骤提取总RNA。收集所培养的U2OS细胞,6孔板中每孔加入1 mL Trizol试剂,冰上静置5 min。加入氯仿0.2 mL,充分混匀,冰上静置2~3 min 后,4℃12 000 g离心15 min。将上清转移到一个新的无RNA酶的EP管中,加入500μL的异丙醇,充分混匀,冰上静置10 min。4℃,12 000 g离心10 min。弃上清,加入75%乙醇1 mL,4℃7 500 g/min 离心5 min。弃上清,室温干燥5~10 min,加入40 μL DEPC 处理水,所得的RNA保存于- 80℃。
1.2.2 引物设计
根据GenBank的基因序列(NM_001173984),设计特异性引物扩增BRD7编码区。上、下游引物中分别引入BglⅡ、XhoI酶切位点,同时在N端加入Flag标签肽段。所有引物均由Invitrogen公司合成。引物序列见表1。
1.2.3 逆转录聚合酶链反应(RT-PCR)
RNA用分光光度计测浓度后行逆转录反应,选用MBI Fermentas 公司的RevertAid First Strand cDNA Synthesis Kit按试剂说明书操作。合成的cDNA置于-20℃保存。 取1.5 μL cDNA进行PCR反应,反应条件:94℃预变性5 min; 94℃变性30 s,60℃退火30 s, 72℃延伸2 min,共30个循环。再于72℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳鉴定,然后切胶回收。胶回收根据Qiagen公司的胶回收试剂盒说明书进行。

表1 引物序列Table 1 Primer Sequence
1.2.4 pMSCV-BRD7-GFP重组逆转录病毒载体构建
1.2.4.1 目的基因片段和载体双酶切
用BglⅡ、XhoI酶分别双酶切回收的BRD7目的片段以及载体pMSCV-GFP,37℃酶切30 min。
1.2.4.2 切胶回收
双酶切后的产物经切胶回收,按试剂说明书操作。
1.2.4.3 目的片段与pMSCV-GFP表达载体的连接
将回收的目的基因BRD7片段以及载体pMSCV-GFP在T4 DNA 连接酶作用下连接,16℃水浴反应过夜。
1.2.4.4 质粒转化
各取5μL过夜连接产物转化感受态细胞DH5α,分别涂布于含氨苄抗性的LB 平板上,37℃恒温箱培养过夜。从每个培养皿上各挑取3个单克隆菌落接种于6 mL含氨苄抗性的LB 培养液中,37℃恒温摇床培养过夜。
1.2.4.5 质粒提取与酶切鉴定
按照质粒小提试剂盒说明书提取质粒,并分别用BglⅡ、XhoI酶做酶切鉴定,同时也做PCR扩增验证。酶切产物和PCR产物行1.5% 琼脂糖凝胶电泳。
1.2.4.6 测序鉴定
将酶切及PCR扩增鉴定正确的克隆送Invitrogen公司测序分析。
1.2.5 制备病毒上清液
转染前一天,10 cm平皿铺板HEK293T细胞,待细胞密度达到30~50%左右时进行转染。转染对照质粒pMSCV-GFP vector或pMSCV-BRD7-GFP和包装质粒E vector、G vector,操作按Lipofectamine2000说明书进行。转染后将细胞置于37℃,5% CO2的培养箱中培养,48 h后,收集病毒上清液,用0.45μm过滤器过滤得到病毒上清。
1.2.6 病毒上清液的浓缩
按每20 mL病毒上清加入5.5 mL PEG-8000(44%)与2 mL NaCl(4M)的比例充分混匀,使得PEG-8000终浓度为8.5%,NaCl终浓度为0.3 M;静置4℃过夜后,3 000 rpm离心15 min;小心吸掉上清,剩下乳白色的病毒沉淀,最后用150μL PBS重悬,保存于-80℃。
1.2.7 稳定细胞株的建立
铺板U2OS细胞于6 cm板中,培养过夜。待细胞密度达到50%时开始感染病毒。每孔加入上述浓缩病毒液,同时补加培养基置2 mL(含8 μg/mL polybrene),37℃培养箱中培养。12 h后,弃去病毒液,换正常培养基过夜。培养24 h后,用嘌呤霉素(0.8μg/mL)筛选3天,收集细胞提取蛋白,Western blotting检测目的蛋白表达。同时用荧光显微镜检测GFP表达的分布情况。
1.2.8 Western blotting检测
收集U2OS细胞对照组和转染组细胞,提取蛋白,用Bradford法测定蛋白浓度并定量, 用10% 聚丙烯酰胺凝胶进行电泳,电泳结束后转膜200 mA, 2 h,用含5% 脱脂奶粉的TBST室温封闭1 h,孵育BRD7一抗(1:2000)和GAPDH(1:1 000)4℃过夜;PBST洗涤3次,每次10 min,加入辣根过氧化物酶标记的二抗,室温孵育1.5 h;PBST 洗涤同前,X光片压片,显影、定影。
2 结果
2.1 目的基因BRD7的扩增
将HEK293T细胞的RNA,经反转录得到其cDNA。以该cDNA为模板,用pMSCV-BRD7-F与pMSCV-BRD7-R引物进行PCR扩增,电泳结果显示在2 000 bp左右处有一条明显的条带(图1),与预期扩增的BRD7片段大小相符。
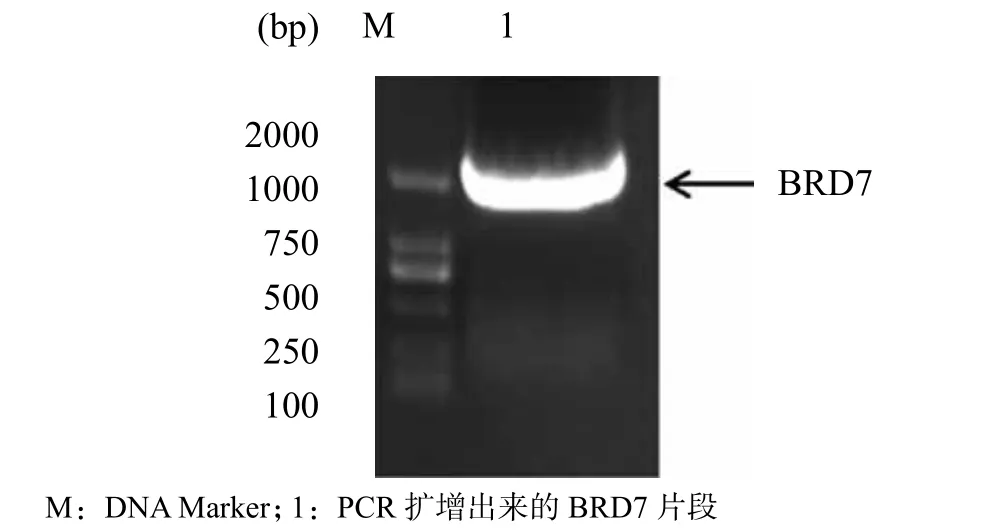
图1 PCR扩增BRD7编码区的电泳结果Figure 1 Encoding region of BRD7 was ampli fi ed by PCR
2.2 重组质粒的菌液PCR鉴定
将PCR扩增的BRD7片段回收后,用BglⅡ与XhoI双酶切后与同样经双酶切的逆转录病毒载体pMSCV-GFP 载体连接过夜后,连接产物经转化后涂LB 氨苄固体平板。待长出菌落后,挑单个菌落进行小摇,4 h后进行菌液PCR验证阳性克隆。结果如图2所示,在所挑取的4个单克隆菌落里,其中菌落3在2 000 bp 处有明显的条带,说明扩增的目的片段连接进入了目的载体。

图2 挑选菌落经菌落PCR扩增后的电泳结果Figure 2 The result of electrophoresis of randomly selected colonies by PCR
2.3 重组质粒的测序鉴定
将菌液PCR验证正确连接的重组质粒送去Invitrogen公司测序,以确定连接进入载体的目的片段是否与NCBI数据库中人类BRD7 cDNA序列一致(中间加测反应的测序引物序列为BRD7-W1F:AGCTGTTGCACTCAGGAATG)。测序结果表明,克隆的BRD7片段成功插入pMSCV-GFP 载体的多克隆位点,而且中间的开放读码框序列与GenBank中的BRD7碱基序列完全一致。(图3,红色框标示为BRD7的起始密码子位置)。

图3 pMSCV-BRD7-GFP的测序结果Figure 3 The sequencing result of pMSCV-BRD7-GFP
2.4 pMSCV-BRD7-GFP过表达稳定系的鉴定与功能研究
将浓缩好的病毒颗粒感染U2OS细胞,24 h后观察GFP荧光,同时加入嘌呤霉素(0.8 μg/mL)筛选,72 h后得到稳定表达目的蛋白的阳性细胞株。筛选后的细胞继续培养并传代后观察GFP荧光表达的情况,同时提取细胞蛋白做Western blotting鉴定。结果表明,无论对照组还是实验组,U2OS细胞均显示较强的绿色荧光,说明绝大部分的未被感染细胞都被筛除(图4A);同时,Western blotting的结果表明,感染含BRD7病毒的细胞株其内源BRD7的表达水平明显高于对照组(图4B)。这些结果证实稳定过表达BRD7的U2OS细胞系构建成功。利用已构建好的BRD7过表达稳定系,进一步分析了其对增殖与下游靶基因的影响。结果发现,BRD7过表达稳定系的增殖能力显著低于对照组,且显著促进下游靶基因p21与MDM2的表达(图4B和图4C)。
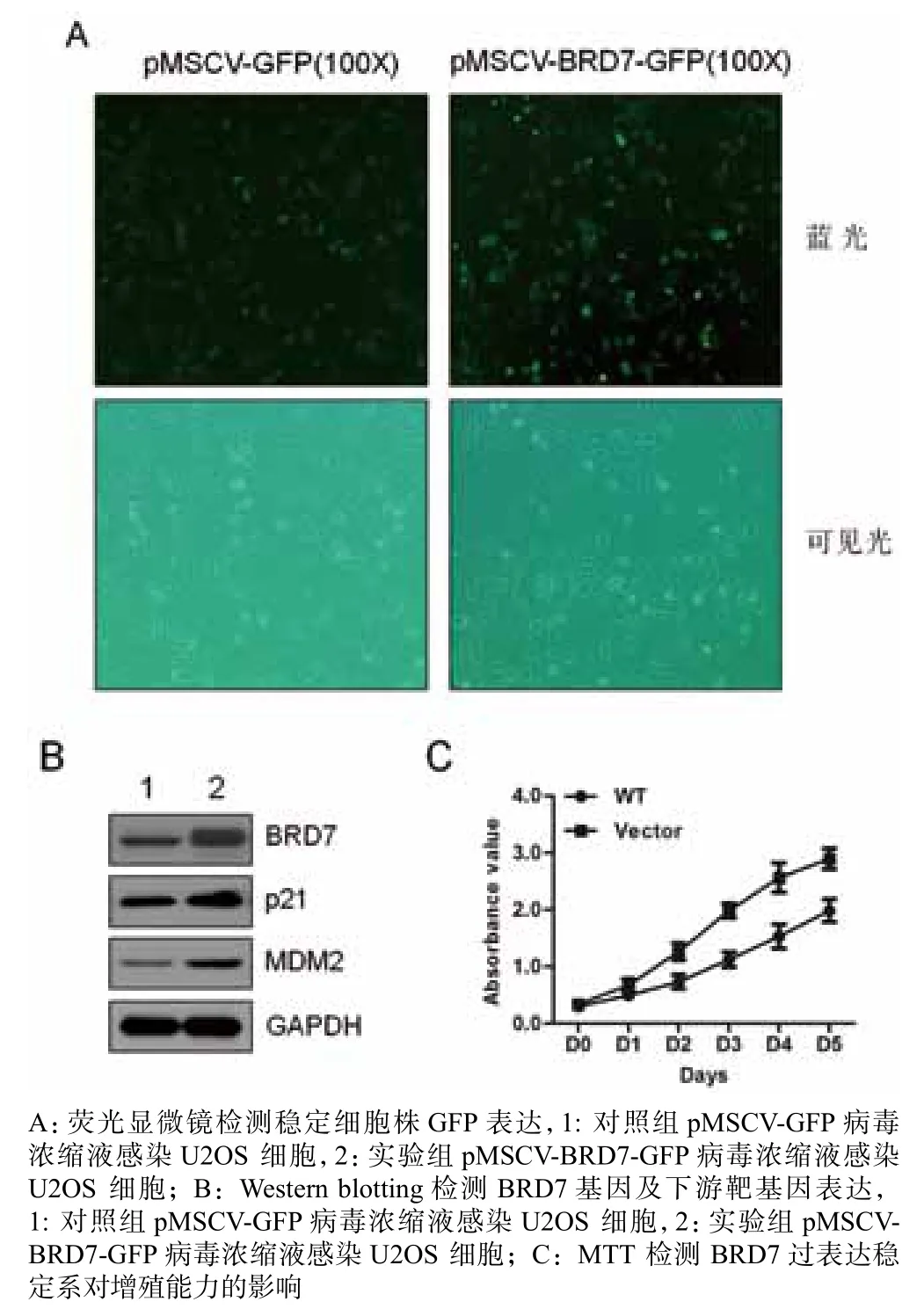
图4 过表达细胞系的鉴定及功能研究Figure 4 Validation of the overexpression stable cell lines and functional research
3 讨论
细胞周期是一个复杂的过程,其精确调控对于维持基因组稳定性以及细胞正常功能是必要条件[11]。已有研究表明很多种调节蛋白参与调控细胞周期的进程,包括细胞周期素(cyclins),周期素依赖性激酶(cyclin-dependent kinase,CDKs)以及CDK抑制分子[12]。
BRD7目前主要作为转录因子发挥功能,在其他方面对其功能的认识甚少。在对鼻咽癌细胞系HNE1研究发现,过表达BRD7能抑制细胞的增殖及G1/S期的进程,主要通过影响13个属于Ras/MEK/ ERK及Rb/E2F通路的基因表达:P19-INK4D表达上调,MEK、ERK1/2、cyclinD1及E2F3下调[10,13]。同时BRD7也能够通过上调α-catenin而阻断细胞核里面的β-catenin聚集影响靶基因c-myc、cyclinD1的表达[10],也许正因为此,鼻咽癌中BRD7表达的下调导致了核β-catenin的异常聚集[14]。 最近又有报道发现,BRD7能直接与BRCA1、Oct1相互作用来调节BRCA1依赖的转录[15],BRD7也能与p53相互作用介导一部分p53下游靶基因的转录,影响组蛋白乙酰化,p53乙酰化及启动子活性,因此BRD7主要通过作为p53互作因子来发挥抑制肿瘤形成作用;而且,进一步发现在乳腺癌的部分组织中BRD7存在缺失或者低表达[16]。
在本实验中我们将BRD7基因成功构建在逆转录病毒载体pMSCV-GFP上,并经测序证实目的基因BRD7序列正确。然后将所构建的重组质粒以及对照质粒与两个包装质粒G vector、E vector共转HEK293T细胞,收集并浓缩病毒颗粒后感染骨肉瘤细胞U2OS,最后用嘌呤霉素筛选得到稳定过表达细胞株。由于逆转录病毒载体pMSCV-GFP上带有绿色荧光蛋白GFP,我们可以利用GFP的表达情况很好地来判定嘌呤霉素筛选的效果。最后,我们通过Western blotting的方法检测筛选后的稳定细胞株中BRD7蛋白的表达,结果发现: pMSCV-BRD7-GFP所感染的U2OS细胞中BRD7表达水平比对照组的细胞表达量明显增加,且显著促进下游靶基因p21与MDM2的表达。进一步通过MTT实验发现BRD7过表达稳定系能显著抑制U2OS细胞的增殖能力,表明BRD7在骨肉瘤中可能发挥抑癌基因的功能。总之,本研究成功构建了能稳定高表达BRD7的细胞系,并初步研究了其功能,为进一步研究BRD7在细胞周期中被调控的机制与功能奠定基础。
[1] Elfring L K, Daniel C, Papoulas O, et al. Genetic analysis of brahma: the Drosophila homolog of the yeast chromatin remodeling factor SWI2/SNF2[J]. Genetics, 1998, 148(1): 251-265.
[2] Dyson M H, Rose S, Mahadevan L C. Acetyllysine-binding and function of bromodomain-containing proteins in chromatin[J]. Front Biosci, 2001, 6: D853-D865.
[3] Winston F, Allis C D. The bromodomain: a chromatintargeting module[J]. Nat Struct Biol, 1999, 6(7): 601-604.
[4] Buschhorn B A, Peters J M. How APC/C orders destruction[J]. Nat Cell Biol, 2006, 8(3): 209-211.
[5] Carrozza M J, Utley R T, Workman J L, et al. The diverse functions of histone acetyltransferase complexes[J]. Trends Genet, 2003, 19(6): 321-329.
[6] Fry C J, Peterson C L. Chromatin remodeling enzymes: who's on fi rst[J]. Curr Biol, 2001, 11(5): R185-R197.
[7] Cuppen E, van Ham M, Pepers B, et al. Identification and molecular characterization of BP75, a novel bromodomaincontaining protein[J]. FEBS Lett, 1999, 459(3): 291-298.
[8] Peng C, Zhou J, Liu H Y, et al. The transcriptional regulation role of BRD7 by binding to acetylated histone through bromodomain[J]. J Cell Biochem, 2006, 97(4): 882-892.
[9] Staal A, Enserink J M, Stein J L, et al. Molecular characterization of celtix-1, a bromodomain protein interacting with the transcription factor interferon regulatory factor 2[J]. J Cell Physiol, 2000, 185(2): 269-279.
[10] Peng C, Liu H Y, Zhou M, et al. BRD7 suppresses the growth of Nasopharyngeal Carcinoma cells (HNE1) through negatively regulating beta-catenin and ERK pathways[J]. Mol Cell Biochem, 2007, 303(1-2): 141-149.
[11] Nakanishi M, Shimada M, Niida H. Genetic instability in cancer cells by impaired cell cycle checkpoints[J]. Cancer Sci, 2006, 97(10): 984-989.
[12] Skaar J R, Richard D J, Saraf A, et al. INTS3 controls the hSSB1-mediated DNA damage response[J]. J Cell Biol, 2009, 187(1): 25-32.
[13] Zhou J, Ma J, Zhang B C, et al. BRD7, a novel bromodomain gene, inhibits G1-S progression by transcriptionally regulating some important molecules involved in ras/MEK/ERK and Rb/ E2F pathways[J]. J Cell Physiol, 2004, 200(1): 89-98.
[14] Morrison J A, Gulley M L, Pathmanathan R, et al. Differential signaling pathways are activated in the Epstein-Barr virus-associated malignancies nasopharyngeal carcinoma and Hodgkin lymphoma[J]. Cancer Res, 2004, 64(15): 5251-5260.
[15] Harte M T, O'Brien G J, Ryan N M, et al. BRD7, a subunit of SWI/SNF complexes, binds directly to BRCA1 and regulates BRCA1-dependent transcription[J]. Cancer Res, 2010, 70(6): 2538-2547.
[16] Drost J, Mantovani F, Tocco F, et al. BRD7 is a candidate tumour suppressor gene required for p53 function[J]. Nat Cell Biol, 2010, 12(4): 380-389.
Construction of BRD7 retroviral stable cell line and the evaluation of its biological functions
ZHANG Ruhua, HU Kaishun, WU Yuanzhong, KANG Tiebang★
(Department of Experimental Research, State Key Laboratory of Oncology in South China, Sun Yat-Sen University Cancer Center, Guangdong, Guangzhou 510060, China)
ObjectiveTo study the tumor suppressor role of BRD7 (bromodomain-containing protein 7).MethodsThe BRD7 gene based on the coding sequence from GenBank was ampli fi ed by RT-PCR. Then the PCR harvested product was suffered to endonuclease digestion and ligation. After transformation to competent cell DH5α,the recombinant positive plasmid clones were identi fi ed by colony-PCR and sequencing analysis. The expressing plasmid were cotransfected into 293T cells, the harvested supernatant was subjected to infect U2OS cells, which will further be selected with puromycin.ResultsColony-PCR and DNA sequencing result indicated that pMSCV-BRD7-GFP vector has been constructed successfully. The GFP fl uorescence showed that there are nearly no untransfected cells remained. Western blotting showed that the protein level of BRD7 in pMSCV-BRD7-GFP transfected cancer cell line is signi fi cantly up-regulated compared with control cancer cell lines. Biological function study showed that overexpression of BRD7 signi fi cantly inhibited the proliferation of U2OS cells and enhanced the expression of target genes p21 and MDM2.ConclusionThe overexpression cancer cell line of pMSCV-BRD7-GFP is successfully constructed. BRD7 may function as a tumor suppressors. Therefore, it provided a new foundation for further mechanism and functional study.
BRD7; Retroviral vector; Stable cell line; Tumor suppressor
国家重点基础研究发展计划(973课题)(2010CB912201)
中山大学肿瘤防治中心实验研究部,华南肿瘤学国家重点实验室,广东,广州 510060
★通讯作者:康铁邦,E-mail: kangtb@mail.sysu.edu.cn
